INTRODUCCIÓN
La tilapia del Nilo (Oreochromis niloticus) es la segunda especie más importante en la acuicultura peruana, registrando una producción anual de 1930.8 t en 2019, la cual se concentra mayormente en los departamentos de Piura (67%), San Martín (27%) y Lima (6%) (SANIPES, 2020). El transporte de alevinos es una práctica común por parte de los piscicultores cuando los adquieren para el engorde en las piscigranjas. Este procedimiento es considerado como un factor de estrés que puede ocasionar mortalidad y variaciones tanto bioquímicas como hematológicas (Nesse et al., 2007; Kubitza, 2009). El marcador clásico de la respuesta primaria frente al estrés es el cortisol, mientras que la glucosa y algunos parámetros hematológicos podrían ser considerados como marcadores complementarios (Sampaio y Freire, 2016).
Con el objetivo de reducir el estrés del transporte de los peces se usan anestésicos como el MS-222 y la benzocaína, ambos relacionados con el bloqueo de los canales de Na+ dependientes de voltaje. Estos fármacos se mezclan en el agua y se absorben rápidamente a través de las branquias (Carter et al., 2011; Weber, 2009). Asimismo, se han estudiado diversas plantas con propiedades sedantes que puedan cumplir la misma función, pero con la ventaja de no producir efectos secundarios, no requieren un periodo de retiro y son económicos (Jerez et al., 2019). Entre los productos naturales más usados, se encuentran el aceite de clavo (Eugenia caryophyllata), el aceite esencial de hierbabuena (Mentha spicata) y la canela (Cinnamomum zeylanicum).
La valeriana (Valeriana officinalis) es una planta muy conocida en América y Eu- ropa por sus propiedades sedantes y ansiolíticas en humanos (Medina et al., 2008; Villar del Fresno y Carretero, 2001). Los componentes más importantes que le confieren estas propiedades son atribuidos al ácido valeriánico y al valepotriato, compuestos con acción depresora del sistema nervioso central debido a que interactúa con los receptores del ácido gamma-aminobutírico (GABA), promoviendo el ingreso de cloro y ocasionando la inhibición neural (Fernández et al., 2004; Murphy et al., 2010). Su efecto anestésico ha sido evaluado previo al transporte de los peces en el caso de la trucha arcoíris (Hajibeglou y Sudagar, 2018) y en el pez cola de espada (Abasali y Mohamad, 2010). Ante esto, el objetivo del estudio fue determinar las dosis sedantes de un extracto de Valeriana sp, así como de la benzocaína y del MS-222 en alevinos de tilapias del Nilo (O. niloticus) y evaluar su efecto sobre parámetros bioquímicos, hematológicos y mortalidad posterior al transporte simulado de tres horas.
MATERIALES Y MÉTODOS
Animales
Los alevinos de tilapia (Oreochromis niloticus) fueron proporcionados por el Centro de Investigación Piscícola (CINPIS) de la Facultad de Pesquería de la Universidad Nacional Agraria La Molina (Lima, Perú). Su alimentación fue a base de concentrado comercial peletizado (Puritilapia 45, Purina). Se seleccionaron 440 alevinos de 6-15 g de peso, 8-13 cm de longitud, de ambos sexos y clínicamente sanos. De estos, 240 se utilizaron para la determinación de las dosis sedantes y 200 para la evaluación de las dosis sedantes en un modelo de estrés por transporte simulado.
Soluciones de Valeriana sp, benzocaína y MS-222
Se utilizaron 500 g de raíces de valeriana (Valeriana officinalis) proporcionada por la empresa Exportadora, Importadora y Distribuidora Perú Nutrition S.R.L. Se seleccionaron raíces entre 2 y 6 cm de longitud y de coloración marrón oscuro, que fueron lavadas con agua destilada, secadas a 37 °C por 7 días y molidas. El producto pulverizado (250 g) se almacenó a temperatura ambiente en un frasco ámbar para evitar alteraciones por efecto de la luz. A partir de esto se pre- pararon soluciones al 15 y 20% con etanol al 96% y maceradas durante 7 días con una agitación cada 24 horas. Posteriormente se filtró con papel Whatman N.° 40 y el líquido obtenido fue almacenado a 4 °C (Camacho y Honorio, 2017). Por otro lado, también se pre- paró una solución alcohólica de benzocaína (Sigma-Aldrich) y una solución acuosa de MS-222 (Sigma-Aldrich) neutralizada con NaHCOƒ (CDH) en una proporción de 1:2. Debido a que MS-222 fue preparado en base acuosa, se adicionó etanol al 96% en los recipientes/bolsas con los peces en el mismo volumen usado para la valeriana y la benzocaína. Estos procedimientos fueron realizados en el Laboratorio de Farmacología y Toxicología de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos (Lima, Perú).
Dosis Sedante
Debido a que no se encontraron reportes de dosis sedantes específicos para alevinos de tilapias, se utilizaron como base dosis de 50 mg/l para valeriana (Hajibeglou y Sudagar, 2018), 40 mg/l para benzocaína (Saldanha et al., 2018) y 80 mg/l para MS-222 (Pirhonen y Schreck, 2003). Tomando como base estos valores, los alevinos fueron sometidos a diferentes concentraciones para determinar las dosis sedantes. En el caso del extracto alcohólico de valeriana se utilizaron las dosis de 75, 100, 150 y 200 mg/l, para la benzocaína (Castro, 2018) las dosis de 30, 35, 40, 45 y 50 mg/l y para MS-222 las dosis de 70, 75, 80, 85 y 100 mg/l. Para esto, se prepararon recipientes de 4 L de agua con 5 alevinos por recipiente y por dosis; además, se utilizó un grupo control al que solo se le adicionó etanol 96% en la proporción usada para preparar las soluciones sedantes y un grupo blanco que no contenía componente externo alguno. Los peces permanecieron en esas condiciones por 30 min y luego fueron transferidos a otro recipiente de 4 L de agua fresca para su recuperación. El procedimiento para la determinación de la dosis sedante fue repetido tres veces en el mismo día en las instalaciones del CINPIS, siendo utilizados grupos diferentes de alevinos para cada repetición para tener mayor seguridad con las observaciones.
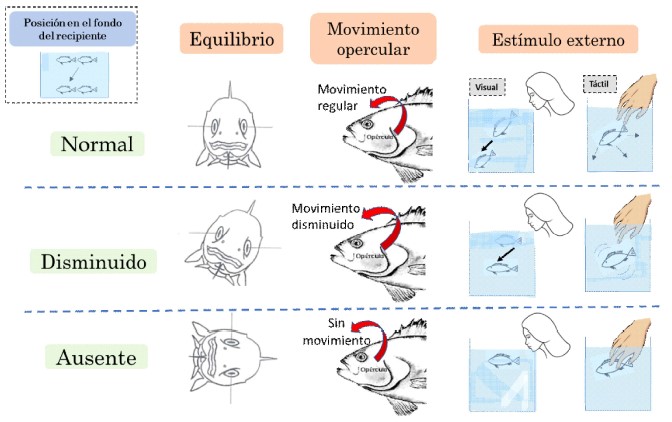
La dosis sedante óptima se determinó de acuerdo con el comportamiento de los alevinos según: 1) Equilibrio, se mantiene la posición normal de nado; 3) Movimientos operculares, menores a 140 movimientos/min; 3) Respuesta a estímulos externos, inmóvil al ver a una persona y al intentar ser tocados; y 4) Posición, ubicados en el fondo del recipiente. Estos criterios fueron adaptados de las etapas de anestesia en peces (Woody et al., 2002; Mohammadi y Khara, 2014), a excepción de la posición que fue una característica observada en este experimento.
Para establecer la dosis sedante se consideró el siguiente patrón de comportamiento para cada grupo de cinco peces: al menos tres peces con equilibrio normal, movimientos operculares disminuidos (<140 movimientos/min) y ausencia de respuesta a estímulos externos, mientras que al menos un pez posicionado en el fondo del recipiente (Figura 1). Asimismo, se registró el tiempo de latencia, medido desde la aplicación de la sustancia sedante hasta alcanzar la etapa de sedación.
Transporte , Muestras y Análisis
Se formaron cuatro grupos, cada uno con 50 alevinos: Control, Valeriana, Benzocaína y MS-222. Se prepararon bolsas dobles transparentes de polietileno de baja densidad (75x50 cm), cada una con 4 L de agua que llenaba la tercera parte de la bolsa. En cada bolsa se colocó el producto a evaluar y cinco alevinos; luego se inyectó oxígeno al 95% hasta completar las otras dos terceras partes y se cerraron haciéndolas girar sobre su eje y sujetándolas con tiras de hule para que el oxígeno no escape (FAO, 2014).
En el caso del grupo control solo se aplicó alcohol al 96% en la misma cantidad utilizada para la preparación de las soluciones de cada tratamiento. Las bolsas de los cuatro grupos fueron colocadas en cajas de plástico y transportadas desde el CINPIS (La Molina, Lima) hasta el Laboratorio de Farmacología y Toxicología Veterinaria de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos (San Borja, Lima), permaneciendo en estas condiciones por tres horas.
Muestras de sangre
Culminado el tiempo del transporte simulado se realizó la eutanasia de los alevinos utilizando una dosis de 250 mg/l de MS-222 (AVMA, 2020) y se procedió a la extracción de sangre mediante un corte de la base del pedúnculo caudal (Witeska et al., 2022). Con ayuda de una micropipeta se retiró entre 55 a 65 µl de sangre directamente de los vasos sanguíneos del pedúnculo caudal de cada alevino, y colocado en tubos cónicos de 500 µl (Eppendorf®) previamente heparinizados. Debido al tamaño de los peces y a la cantidad mínima de plasma necesaria para la de- terminación del cortisol se optó por la formación de «pools» con la sangre recolectada de cinco alevinos del mismo tratamiento obteniendo entre 275 a 325 µl de sangre por cada pool. De esta forma se obtuvieron 10 pools por tratamiento (SERNAPESCA, 2018).
Niveles de cortisol
Los niveles de cortisol en el plasma fueron determinados con el kit comercial Cortisol ELISA Kit N.° 402710 (Neogen Corporation®). Para esto, la sangre de cada pool fue centrifugada (Gemmy-PCL-02, Taiwan) a 1800 g durante 5 min, luego se separó el plasma (150-200 µl) y se inició el proceso de extracción del cortisol utilizando 100 µl de plasma siguiendo las recomendaciones del fabricante del kit. La cuantificación del cortisol se hizo en un lector de microplacas de ELISA (ELx808, Biotek Instruments) con una longitud de onda de 650 nm
Hematocrito, proteínas totales y glucosa
La determinación del hematocrito se realizó con microcapilares con anticoagulante de 75 mm de largo y 1.1 mm de diámetro (Vitrex, Dinamarca), los cuales se llenaron en un 75% de su capacidad con sangre directamente del corte realizado en el pedúnculo caudal de los alevinos. Los capilares fueron sellados en uno de los extremos con calor y llevados a la centrífuga de microcapilares (DLAB-DM1224, China) a 13 680 g durante 5 min. La lectura se hizo con una regla de microhematocrito.
La concentración de las proteínas totales en el plasma se determinó con un refractómetro mecánico (RHC-200, China) previamente calibrado. Para esto, los microcapilares usados en la determinación del hematocrito fueron quebraron por encima de la capa flogística y se colocó una gota en el prisma principal del refractómetro evitando la formación de burbujas. Los resultados se expresan en g/dl
La medición de glucosa sanguínea se realizó con un glucómetro comercial de tiras reactivas (Accu-Chek®). Este procedimiento requirió 1 µl de sangre que fue colocado en la tira reactivas y medida en el glucómetro. El resultado se expresa en mg/dl.
Mortalidad
El recuento de la mortalidad se realizó al término de las 3 h de transporte simulado.
Análisis Estadístico
Los resultados obtenidos se analizaron con la prueba Shapiro-Wilk para confirmar que los datos seguían una distribución normal. Las variables fueron cuantitativas, continuas y normales. Se utilizó el análisis de varianza para contrastar la hipótesis nula que las medias tenían una variación menor al 5%. En los casos en los que la hipótesis nula se rechazó se procedió a realizar la prueba de Tukey para determinar en qué grupos de tratamiento se hallaron diferencias estadísticas significativas (p<0.05). Los análisis fueron ejecutados con ayuda del paquete estadístico GraphPad Prism® 5.00 para Mac.
RESULTADOS Y DISCUSIÓN
Dosis Sedante
Las dosis sedantes óptimas para los alevinos de tilapia fueron 200, 75 y 35 mg/l para valeriana, benzocaína y MS-222, respectivamente. Asimismo, se determinó que los tiempos de latencia y recuperación fueron de 30 y 85, 105 y 90, y 75 y 65 s para los tres anestésicos, respectivamente. No fue posible encontrar reportes del uso de valeriana como sedante en alevinos de tilapia; sin embargo, Hajibeglou y Sudagar (2018) aplicaron extracto de valeriana en truchas arcoíris a una dosis de 50 mg/l en un modelo de transporte de 16 h, mientras que Abasali y Mohamad (2010) utilizaron 1 g/l en peces ornamentales cola de espada (Xiphophorus helleri) de 2.5 g de peso en un modelo de transporte de 24h. En ambos trabajos, las dosis usadas fueron suficientes para reducir el estrés del transporte. En el presente estudio, 200 mg/l de extracto de valeriana fueron suficientes para inducir sedación en los alevinos de tilapia.
Por otro lado, los resultados para el caso de benzocaína se aproximan a los de Saldanha et al. (2018) que obtuvieron tiempos de inducción y recuperación de 86 y 15 s y de 30 y 10 s, respectivamente, para alevinos de tilapia que recibieron 20 y 40 mg/l de benzocaína durante un transporte simulado de 5 h. Asimismo, Rucinque et al. (2016) utilizaron una dosis de 100 mg/l de benzocaína en tilapias juveniles encontrando una pérdida del eje de nado a los 3 min y la recuperación a los 5 min. En el caso de MS-222, Pirhonen y Schreck (2003) y Hoskonen y Pirhonen (2006) determinaron 80 y 70 mg/l, respectivamente, en truchas arcoíris (Oncorhynchus mykiss) de entre 25 y 79 g para disminuir el estrés durante la manipulación. Mohammadi y Khara (2014), asimismo, determinaron una dosis de 150 mg/l para anestesiar truchas arcoíris con MS-222. No obstante, se considera que todo anestésico debe ser evaluado para las condiciones de cada medioambiente, ya que sus efectos responden a la especie, y pueden modificarse por variaciones en condiciones de crianza, manejo y estrés, entre otros.
Transporte Simulado
Los niveles de cortisol plasmático encontrados en los alevinos tratados con los tres anestésicos fueron similares a los del grupo Control; sin embargo, los valores de cortisol al utilizar MS-222 fueron significativamente mayores (p<0.05) que al utilizar valeriana o benzocaína (Cuadro 1). El cortisol es considerado como el biomarcador más importante para la evaluación del estrés, pudiendo por lo tanto incrementarse durante el transporte de los peces (Sampaio y Freire, 2016). Hajibeglou y Sudagar (2018) utilizaron 50 mg/l de un extracto de valeriana en truchas arcoíris en un modelo de transporte de 16 h encontrando valores de cortisol inferiores a los controles. Asimismo, Abasali y Mohamad (2010) evaluaron el efecto de la valeriana en peces cola de espada (X. helleri) en un modelo de transporte de 24 h encontrando valores en músculo por debajo de 60 ng/g, siendo inferior al valor de 80 ng/g del grupo control. Los efectos de V. officinalis como calmante, sedante y ansiolítico podrían ser atribuidos al ácido valerénico, flavonoides como la 6-metilapigenina y glucósidos como linarina y hesperidina, siendo que la combinación de estos componentes potencia los efectos de la planta (Fernández et al., 2004).
Cuadro 1 Resultados de cortisol, glucosa y parámetros hematológicos en alevinos de tilapia del Nilo (Oreochromis niloticus) tratados con dosis sedantes de benzocaína, MS- 222 y valeriana sometidos a un modelo de transporte simulado por 3 h
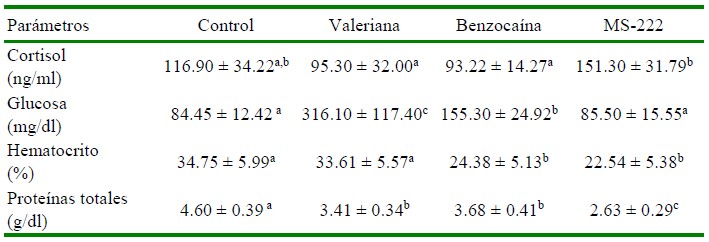
Control: Sin tratamiento; Valeriana: 200 mg/l; Benzocaína: 35 mg/l; MS222: 75 mg/l
a,b,c Superíndices diferentes dentro de filas indican diferencia significativa (p<0.05)
Navarro et al. (2016) utilizaron 40 mg/l de benzocaína en tilapias para reducir el estrés durante el transporte simulado de 3.5 h, obteniendo valores de 11.7±3.87 ng/ml de cortisol frente a 6.74 ± 5.89 ng/ml del grupo control. En el presente estudio se usó 35 mg/l de benzocaína sin que haya afectado los valores de cortisol. Por otro lado, el grupo tratado con MS-222 presentó un valor alto de cortisol (151.30 ng/ml), resultado similar al reportado por Mohammadi y Khara (2014) en truchas arcoíris (O. mykiss). Es importante señalar que el efecto de la forma de eutanasia en el experimento no fue considerado un factor de importancia para los valores de estrés, toda vez que Küçük (2010) concluye que MS-222 utilizado en dosis letales no ocasiona incremento de los niveles de cortisol o glucosa.
Los niveles de glucosa fueron significativamente más altos en el grupo tratado con valeriana, seguido del grupo tratado con benzocaína en comparación con el grupo con- trol (p<0.05; Cuadro 1). No obstante, Hajibeglou y Sudagar (2018) evaluaron un extracto de valeriana (50 mg/l) en truchas arcoíris en un modelo de transporte de 16 h encontrando menores niveles de glucosa que en el grupo control. Se entiende que se liberan catecolaminas y cortisol plasmático como parte de la respuesta primaria al estrés, determinando que se movilicen las reservas energéticas mediante la inducción de la gluconeogénesis y la glucogenólisis, a fin de que el individuo pueda hacer frente al evento estresante debido a la mayor demanda de energía; esto implica que se pueda observar un aumento de glucosa a nivel sanguíneo (Sampaio y Freire, 2016).
El incremento de los valores de glucosa en el grupo tratado con benzocaína también fue reportado por Oliveira et al. (2009) y Navarro et al. (2016) al utilizar 40 mg/l de benzocaína en tilapias de Nilo. Sin embargo, Huanca (2017) observaron una reducción de los niveles de glucosa en truchas arcoíris usando benzocaína previa manipulación. En base a esta información se podría indicar que existe una respuesta fisiológica diferente de la glucosa entre especies. Por otro lado, el uso de MS-222 no alteró los valores de glucosa, aunque Mohammadi y Khara (2014), al utilizar 150 mg/l de este anestésico en truchas arcoíris juveniles observaron un incremento de los valores de glucosa. Esto mismo fue observa- do en peces de agua dulce (Sladky et al., 2001; Holloway et al., 2004) . Además, al igual que en el cortisol, el tiempo de confinamiento puede afectar los valores de glucosa, Pramod et al. (2010) encontraron que tanto la benzocaína como el MS-222 incrementaban significativamente los valores de glucosa durante las primeras 18 h, para luego reducirlos gradualmente hasta niveles basales en 48 h, posiblemente debido al estrés inicial durante la captura en tanto que la reducción estaría relacionada con un efecto de adaptación de los peces a las condiciones de transporte.
Los alevinos tratados con benzocaína y MS-222 presentaron valores de hematocrito significativamente más bajos en comparación al grupo tratado con valeriana y el control (Cuadro 1). No obstante, los valores de hematocrito se mantuvieron dentro de los rangos normales para la especie (Bittencourt et al., 2003; Lemos et al., 2018). Se espera que los niveles de hematocrito se incrementen como respuesta al estrés agudo (Gomes et al., 2006). Por otro lado, Navarro et al. (2016) reportaron valores de hematocrito de 18±1.3% en tilapias tratadas con 40 mg/l de benzocaína en transporte simulado por 3.5 h, en tanto que Mohammadi y Khara (2014) encontraron valores de hematocrito de 35% al aplicar 150 mg/l de MS-222 en truchas arcoíris. Los ni- veles de proteínas totales en todos los grupos se presentaron en un rango entre 2.63 a 4.60 g/dl, rangos similares a los reportados por Bittencourt et al. (2003) y Cnaani et al. (2004) en tilapias.
De una forma global se puede indicar que los valores de cortisol y glucosa indican que ningún grupo logró reducir el estrés. Esto podría deberse a que el tiempo total del experimento no fue suficiente para inducir el estrés en los alevinos. Si bien este modelo de estrés fue tomado de Saldanha et al. (2018), en ese estudio se utilizaron 5 h como tiempo de transporte. En el caso de la aplicación del extracto de valeriana, los valores altos de glucosa indican un incremento de la necesidad de energía superior a los otros grupos, posiblemente a que el extracto no consiguió mantener los efectos sedantes durante las 3 h, aunque también podría atribuirse a otros factores estresantes como el color amarillo y olor penetrante de la valeriana.
Si bien el valor del cortisol en el grupo tratado con MS-222 fue alto, no fue significativamente diferente del grupo con- trol (Cuadro 1). Según Coyle et al. (2004) peces anestesiados con MS-222 experimentan un incremento de los niveles de cortisol, situación similar a lo observado en el presente estudio, con la diferencia que se utilizó este producto para la sedación. Asimismo, en este mismo grupo los niveles de hematocrito bajos se podrían explicar por la reducción de la capacidad de unión del oxígeno asociada a una baja del pH en el medio (Félix et al., 2021); sin embargo; este valor no fue analizado en este experimento.
En los peces no existe necesariamente una relación entre los valores de glucosa y de cortisol. Barton (2000) evaluó la glucosa y el cortisol en varias especies de salmónidos juveniles sometidos a estrés por transporte de 2 h, encontrando que la trucha de lago tuvo el pico más alto de cortisol (124 ng/ml) en comparación con la trucha arcoíris (57 ng/ml), mientras que los niveles de glucosa fueron más altos en la trucha arcoíris (223 mg/dl) y aún más baja en la trucha del lago (143 mg/dl). Sampaio y Freire (2016) indicaron que el metabolismo de la glucosa en peces no está totalmente clarificado y que las variaciones reportadas podrían estar relacionadas a las especies y a las dietas usadas.
Los valores de proteínas totales fueron altos en el grupo control comparado con los tratamientos. Este resultado podría relacionarse con la movilización de proteínas como sustrato para la glucogenólisis hepática, ya que la albúmina puede ser usada como fuente adicional de energía en episodios de estrés (de Oliveira et al., 2019). Finalmente, no hubo casos de mortalidad en los grupos experimentales, resultado similar al estudio de Navarro et al. (2016) con tilapias del Nilo (O. niloticus) utilizando benzocaína (20 y 40 mg/l). No obstante, en el estudio de Pramod et al. (2010) con peces Puntius filamentosus de 12 g sometidos a un transporte simulado de 48 h utilizando benzocaína a dosis de 30 y 40 mg/l se obtuvo 22 y 52% de mortalidad, respectivamente, a las 6 h de transporte.












 uBio
uBio