INTRODUCCIÓN
Las vibriosis son un conjunto de enfermedades causadas por bacterias del género Vibrio, de gran importancia para la acuicultura a nivel mundial, pues afecta a un gran número de especies en cultivo, ya sea peces, crustáceos o moluscos (Rakesh et al., 2018; Arunkumar et al., 2020; Ji et al., 2020; de Souza y Wan, 2021). Las vibriosis son las principales enfermedades bacterianas en el cultivo del camarón blanco Litopenaeus vannamei (Amatul-Samahah et al., 2020; Zuo et al., 2021). Entre ellas, la enfermedad de la necrosis hepatopancreática aguda (AHPND) ha originado fuertes pérdidas económicas en cultivos de camarones de Asia y Norteamérica (Santos et al., 2020; Culot et al., 2021; Restrepo et al., 2021).
En el tratamiento de las vibriosis en camarones se han usado antibióticos como oxitetraciclina, enrofloxacina, florfenicol, norfloxacina, sarafloxacina y ormetoprimsulfametoxazol (Santiago et al., 2009; Bermúdez-Almada et al., 2014; Rakesh et al., 2018). En el caso de los cultivos de camarón en Perú, la oxitetraciclina se utiliza en dosis de al menos 3 g/kg de alimento balanceado, pero algunos acuicultores aplican dosis que superan la máxima recomendable de 4.5 g/kg (Aguirre et al., 2021; Avunje et al., 2021).
Dadas las crecientes restricciones hacia el uso de antibióticos en el cultivo (Amatul-Samahah et al., 2020) y la ocurrencia de resistencia antibiótica (Varela-Mejías y Alfaro-Mora, 2018; Varela y Choc-Martínez, 2020; Vaiyapuri et al., 2021), se viene buscando alternativas no antibióticas para el tratamiento de las vibriosis, habiéndose investigado probióticos, prebióticos, simbióticos, vacunas, fagos y fitobióticos (Amatul-Samahah et al., 2020; Domínguez-Borbor et al., 2020; Borges et al., 2021). Los fitobióticos en particular, presentan interesantes ventajas frente a los antibióticos, pues son biodegradables y no se acumulan en los tejidos animales (Dawood et al., 2021). Los fitobióticos incluyen a los aceites esenciales y extractos obtenidos de plantas con propiedades medicinales (Domínguez-Borbor et al., 2020).
Las plantas del género Mentha han sido tradicionalmente utilizadas por más de 250 años para el tratamiento de enfermedades en humanos poseen múltiples propiedades, entre ellas las antibacterianas (Diniz et al., 2020; Eftekhari et al., 2021; Gholamipourfard et al., 2021), sus aceites esenciales están constituidos por más de 30 compuestos químicos, siendo los más abundantes: mentol, mentona, d-carvona, limoneno, epoxiocimeno, linalool, eucaliptol y neo-mentol (Diniz et al., 2020; Gholamipourfard et al., 2021). La menta se ha utilizado en cultivos acuícolas, principalmente como anestésico (Metin et al., 2015), promotor de crecimiento (Snoussi et al., 2015), antiparasitario (de Oliveira et al., 2016; Costa et al., 2020), inmunoestimulante (Adel et al., 2015a,b), antifúngico (Adel et al., 2020) y antibacteriano (Talpur, 2014; Snoussi et al., 2015; Chagas et al., 2020). En el caso del camarón Litopenaeus vannamei, se le ha usado como promotor de crecimiento y estimulante de enzimas digestivas (Akbary et al., 2017), así como atractante alimenticio (Kawamura et al., 2019).
La literatura científica no revela trabajos de investigación donde se haya empleado la menta como agente antibacteriano para el control de enfermedades o para incrementar la supervivencia del camarón en cultivo. Ante esto, esta investigación tuvo como objetivo determinar el efecto de tres extractos de menta sobre la supervivencia de camarones infectados experimentalmente con Vibrio spp.
MATERIALES Y MÉTODOS
Extractos de Menta
Se recolectaron 9 kg de hojas maduras aparentemente sanas de Mentha piperita, y se secaron bajo sombra durante 10 días. Con las hojas secas se prepararon tres extractos: etanólico procesado en baño maría (EBM), en aceite de oliva y procesado en baño maría (ABM) y 3) macerado en aceite de oliva (MA).
El EBM se preparó colocando 150 g de hojas secas de menta molidas en 200 ml de etanol al 96%, el cual fue colocado en baño maría a 70 °C por 3 h y luego fue filtrado para retirar restos de material vegetal. El ABM fue preparado con las mismas proporciones y método usado para el EBM, pero en lugar de etanol se empleó aceite de oliva. Para el MA, 250 g de hojas secas molidas en 375 ml de aceite de oliva fueron puestas en maceración durante 30 días, y luego fue filtrado.
Cepas de Vibrio spp
Diez camarones L. vannamei con peso promedio de 4 g fueron donados por una empresa langostinera de la zona de Puerto Pizarro (Tumbes). Estos fueron recolectados de un estanque en el que se tuvo problemas por vibriosis durante el cultivo. Los camarones fueron sacrificados siguiendo las directrices de la Royal Society for the Prevention of Cruelty to Animals (RSPCA, 2016).
El aislamiento y purificación de las cepas de Vibrio se realizó según el método de Jeyasanta et al. (2017), con modificaciones. De cada camarón se extrajo el hepatopáncreas e intestino, se tomó una porción de aproximadamente 100 mg entre ambos órganos. Se tomaron las muestras de intestino y hepatopáncreas de tres camarones con las que se hizo un pool que fue triturado en 900 µl de solución salina (0.85% de NaCl). Se obtuvieron cuatro pools, con los cuales se realizaron diluciones sucesivas de 100 a 10-3, que fueron sembradas en placas con medio tiosulfato citrato bilis sacarosa (TCBS) suplementado con NaCl (concentración final de 2.5%). Las placas fueron incubadas a 37 °C por 24 h.
Se seleccionaron 45 colonias que fueron las más representativas que crecieron en el medio TCBS. Estas fueron subcultivadas en medio agar tripticasa soya (TSA) por 24 h a 37 °C hasta obtener cultivos puros. Se obtuvieron 20 cepas puras de Vibrio spp, las que fueron almacenadas en congelación a -20 °C en caldo lisogenia (LB) suplementado con NaCl (concentración final de 2.5%) y glicerol (concentración final de 15%).
Las colonias bacterianas que al crecer en el medio TCBS, fueron circulares, verdes o amarillas, con diámetros pequeños a moderados (1 a 5 mm), bordes enteros y elevación convexa, fueron identificadas presuntivamente como originadas por cepas de Vibrio spp (Sabir et al., 2013). Se verificó la identidad de dichas cepas realizando tinción de Gram y prueba de catalasa y oxidasa, así como crecimiento en soluciones de NaCl, a fin de apreciar las cepas con características compatibles con las de Vibrio spp (Rosado, 2018).
Sensibilidad de las Cepas de Vibrio spp
Se prepararon discos de papel filtro de 6 mm de diámetro a los que se agregó 10, 15 y 20 µl de cada extracto (EBM, ABM y MA). El ensayo in vitro se realizó mediante un diseño en bloques completamente al azar, teniendo como tratamientos los extractos en sus tres dosis y como control discos comerciales de oxitetraciclina (30 µg). Se consideró como bloques las 20 cepas de Vibrio spp que fue- ron aisladas a partir de los camarones infectados.
Las cepas de Vibrio spp fueron sembradas a una concentración de 1.5 x 108 UFC/ ml (equivalente al estándar de MacFarland 0.5) en placas con agar Mueller Hinton (MH). En las placas se colocaron los discos de papel filtro con las tres dosis de cada extracto, así como el disco control. Las placas se incubaron por 24 h a 37 °C, luego de lo cual se midió el diámetro de los halos de inhibición formados por cada uno de los tratamientos. Los datos de los halos de inhibición fueron analizados estadísticamente con las pruebas de análisis de varianza de una vía y prueba de Tukey, ambas con 0.05 de nivel de significancia.
Control de Vibriosis
Para el ensayo se obtuvieron 186 camarones de 4.5 ± 0.5 g obtenidos por donación de la misma empresa langostinera de la zona de Puerto Pizarro (Tumbes) que donó los ejemplares para la fase in vitro. Los camarones, aparentemente sanos, se recolectaron del mismo estanque del que procedieron los camarones usados en la fase in vitro, pero correspondieron a la siguiente campaña de cultivo en que no se presentó problemas de vibriosis. Estos fueron colocados en nueve acuarios con 40 L de agua del estero cada uno. Se seleccionaron 62 camarones por tratamiento, dos de ellos fueron sacrificados al iniciar el experimento para determinar la carga inicial de Vibrio spp en el hepatopáncreas.
Los 60 camarones restantes de cada tratamiento fueron distribuidos en los acuarios experimentales a razón de 20 ejemplares por acuario.
Se realizó la infección experimental de los camarones con una mezcla de las 20 cepas de Vibrio spp que fue agregada a cada acuario hasta lograr una concentración de 105 UFC/ml. Se trabajó con tres tratamientos y cada uno con tres repeticiones: 1) experimental, se aplicó 15‰ (v/w) del extracto EBM al alimento balanceado de los camarones; 2) control positivo, se aplicó 3‰ (w/w) de oxitetraciclina al alimento balanceado y, control negativo, sin aplicar alguno de los productos al alimento balanceado.
El alimento balanceado fue suministrado dos veces al día (09:30 y 15:00 h), inicialmente en una cantidad equivalente al 10% de su biomasa, y posteriormente ajustado de acuerdo con el consumo. El ensayo de control de vibriosis duró 16 días. Cada cuatro días se evaluó la supervivencia, el crecimiento en peso y la carga de Vibrio spp en el hepatopáncreas de los camarones. Para esto último dos camarones por tratamiento fueron sacrificados. La selección de los camarones se hizo al azar por cada tratamiento; primero se seleccionó por sorteo dos de los tres acuarios que conformaron el tratamiento, luego se eligió al azar un camarón de cada acuario seleccionado. Los camarones sacrificados semanalmente no fueron considerados para el cálculo de la supervivencia.
El ensayo se realizó con un diseño completamente al azar y los resultados fueron analizados utilizando el análisis de varianza de una vía y la prueba de Tukey, ambas con un nivel de significancia de 0.05.
RESULTADOS Y DISCUSIÓN
Sensibilidad de las Cepas de Vibrio spp
Las 20 cepas de Vibrio spp aisladas fueron sensibles a los tres tipos de extracto de menta (Cuadro 1). Los diámetros promedio de los halos de inhibición se incrementaron progresivamente conforme se aumentó la dosis (desde 10 hasta 20 µl) en los tres extractos de menta.
Cuadro 1 Diámetro de halos de inhibición (media ± desviación estándar) en cepas de Vibrio spp según tipo de extracto y dosis
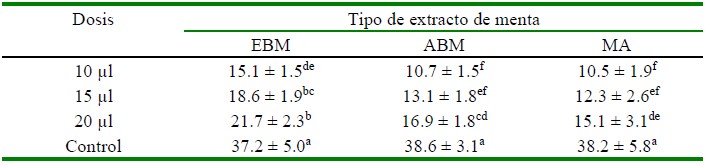
EBM: Menta en etanol al 96% en baño maría a 70 °C por 3 h; ABM: en forma similar al EBM pero aceite de oliva en lugar de etanol; MA: Menta en aceite de oliva macerada por 30 días; Control: oxitetraciclina Superíndices diferentes indican diferencia significativa según la prueba de Tukey.
El tratamiento control (OTH, 30 µg) presentó los mayores halos de inhibición en las cepas de Vibrio spp con diámetros de halos de inhibición entre 37.2 y 38.6 mm. Entre los grupos tratados, los mejores resultados se obtuvieron con el extracto etanólico en baño maría (EBM) en dosis de 15 y 20 µl, sin diferencia significativa entre ellos. Por otro lado, su poder inhibidor fue inferior al de la OTH, dado que el halo de inhibición del EBM fue el 58.2% de aquel con OTH; no obstante, estos resultados se pueden considerar aceptables, considerando que se trata de un extracto artesanal y que se probó en dosis menores que la del control (15 µl vs. 30 µg).
En investigaciones utilizando la menta (M. spicata) como antibacteriano se determinó que los extractos ensayados tuvieron potencial antimicrobiano (Shahbazi, 2015; Radaelli et al., 2016), incluso cuando sus resultados fueron más modestos que los observados en este estudio. Así en el primer caso, la eficiencia de la concentración mínima bactericida (CMB) fue menor al 1% del correspondiente al antibiótico control (cloranfenicol), y en el caso del estudio de Shahbazi (2015), el diámetro de los halos de inhibición producido en dos cepas de Escherichia coli fue de 43.3% al correspondiente al antibiótico control (tetraciclina). Resultados similares a los del presente estudio han sido hallados con otros extractos; por ejemplo, con el extracto metanólico de dos macroalgas (Padina tetrastromatica y Sargassum ilicifolium) en la inhibición de Vibrio parahaemolyticus obtenido de camarones Penaeus monodon utilizando como antibiótico control a la ciprofloxacina (AftabUddin et al., 2021).
El hecho de que el extracto etanólico en baño maría (EBM) haya sido más efectivo en inhibir a Vibrio spp podría deberse a que el mentol, principal componente presente en el aceite esencial de la menta y potente bactericida (Yunilawati et al., 2021), es más soluble en alcohol que en agua o aceites (NCBI, 2021).
Supervivencia de Camarones
La supervivencia de los camarones infectados con Vibrio spp que fueron tratados con los extractos de meta se redujo progresivamente a lo largo del tiempo del ensayo, siendo a partir del octavo día que los camarones que recibieron oxitetraciclina y el EBM presentaron mayores tasas de supervivencia que los camarones del grupo control negativo (Figura 1; p<0.05). Al final del ensayo (día 16), la tasa de supervivencia de los grupos tratados con OTH y EBM fueron estadísticamente similares (entre 56.7 a 70.0%), pero mayores a la del tratamiento control negativo (46.7%).
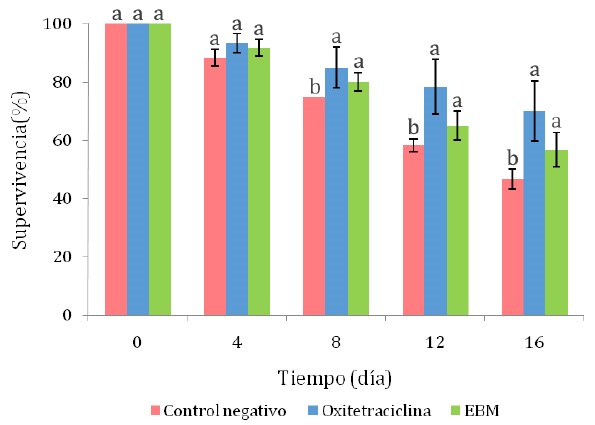
Figura 1 Supervivencia de camarones Litopenaeus vannamei infectados experimentalmente con cepas de Vibrio sp. EBM: extracto etanólico de menta en baño maría. Las letras que acompañan a cada barra indican diferencia significativa según la prueba de Tukey (p<0.05)
En términos generales, el extracto etanólico de menta en baño maría (EBM) logró reducir la mortalidad de los camarones infectados experimentalmente con Vibrio spp, en comparación a aquellos en los que no se aplicó ninguna medicación. Casos similares han sido reportados en L. vannamei y contra Vibrio spp utilizando aceites esenciales de orégano (Origanum vulgare) y del árbol del té (Melaleuca alternifolia) (Domínguez-Borbor et al., 2020); así como del extracto de cebolla tiwai (Eleutherine americana) (Azis y Cahyadi, 2020). Así mismo, el extracto de menta también pudo incrementar la supervivencia de la trucha arcoíris (Oncorhynchus mykiss) infectada experimentalmente con la bacteria Yersinia ruckeri (Adel et al., 2016).
La razón del mejor resultado del extracto de menta en la prueba in vivo en comparación con la prueba de sensibilidad in vitro puede deberse a que este producto contiene no solo sustancias bactericidas, sino también inmunoestimulantes. Así, el resultado in vivo podría indicar que el extracto de menta mejoraría el rendimiento del sistema inmunitario del camarón (Adel et al., 2015a), tal y como ha sido demostrado en peces como Labeo rohita (Padala et al., 2021) Oncorhynchus mykiss (Adel et al., 2016), Salmo trutta caspius (Adel et al., 2015b), Rutilus frisii kutum (Adel et al. 2015a), Lates calcarifer (Talpur, 2014), con lo cual sería más eficiente la eliminación del Vibrio spp que infecta al camarón.
Crecimiento de Camarones
El EBM produjo un efecto positivo en el crecimiento en peso de los camarones infectados con Vibrio spp, siendo estadísticamente superior al tratamiento control negativo (p<0.05), y sin diferencia significativa con el control positivo (OTH) (Figura 2). En experimentos similares se observó un efecto benéfico del aceite esencial de menta adicionado al alimento balanceado, dado que algunos de sus compuestos estimulan la producción de enzimas digestivas que actúan como atractante e incrementan el consumo de alimento en L. vannamei (Akbary et al., 2017; Kawamura et al., 2019), así como de otros crustáceos como Macrobrachium rosenbergii (Kawamura et al., 2019) y de peces (Talpur, 2014; Adel et al., 2015a,b).
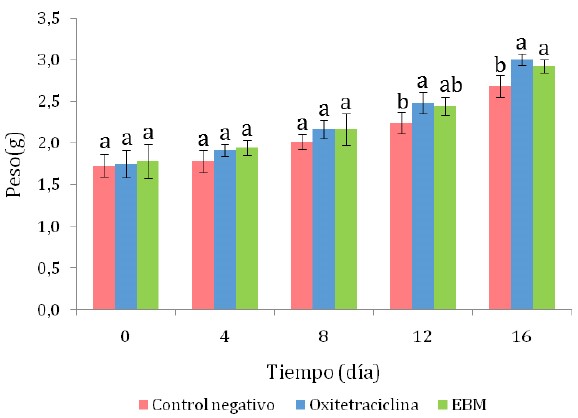
Figura 2 Crecimiento en peso de camarones Litopenaeus vannamei infectados experimen- talmente con cepas de Vibrio sp. EBM: extracto etanólico de menta en baño maría. Las letras que acompañan a cada barra indican diferencia significativa según la prueba de Tukey (p<0.05)
Por otro lado, el hecho que los camarones del grupo control positivo con OTH hayan obtenido un peso promedio similar al logrado con el extracto de menta, se justifica debido a que la OTH, como muchos antibióticos, tiene la propiedad de actuar como promotor de crecimiento (Arsène et al., 2021; Hosain et al., 2021), cuando se aplica en dosis que no rebasan la máxima recomendada, que en el caso del camarón es de 4.5 g/kg de alimento (Bermúdez-Almada y Espinosa-Plascencia, 2012; Avunje et al., 2021), como ha sido el caso en el presente estudio.
Carga de Vibrio spp en Hepatopáncreas
La carga de Vibrio spp no fermentadores de sacarosa, que se desarrollan como colonias de color verde en el medio TCBS, se incrementó luego de la infección experimental con Vibrio spp. La carga fue estadísticamente similar en los tres tratamientos hasta el cuarto día, pero del octavo día en adelante se observó una carga significativamente menor en el tratamiento con OTH, seguido del tratamiento con EBM (Figura 3).
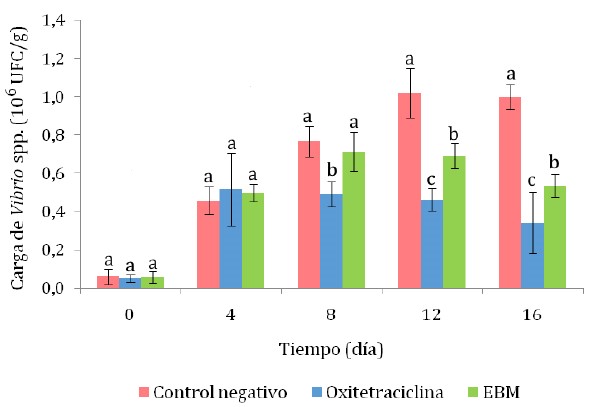
Figura 3 Carga de Vibrio spp no fermentadores de sacarosa (colonias verdes) en hepatopáncreas de camarones Litopenaeus vannamei infectados experimentalmente con cepas de Vibrio sp. EBM: extracto etanólico de menta en baño maría. Las letras que acompañan a cada barra indican diferencia significativa según la prueba de Tukey (p<0.05)
De manera similar, la carga total de Vibrio spp (tanto fermentadores como no fermentadores de sacarosa), desde el octavo día en adelante fue significativamente menor en el tratamiento con OTH (p<0.05), seguido del tratamiento con EBM, en comparación con el control negativo (p<0.05) (Figura 4). El hecho de que el recuento de la carga total de Vibrio spp haya sido menor en el grupo tratado con OTH en comparación con el grupo tratado con EBM es coherente con lo observado en este mismo estudio in vitro, en el que se observó que el EBM tuvo un poder inhibidor equivalente al 58.2% de la oxitetraciclina.
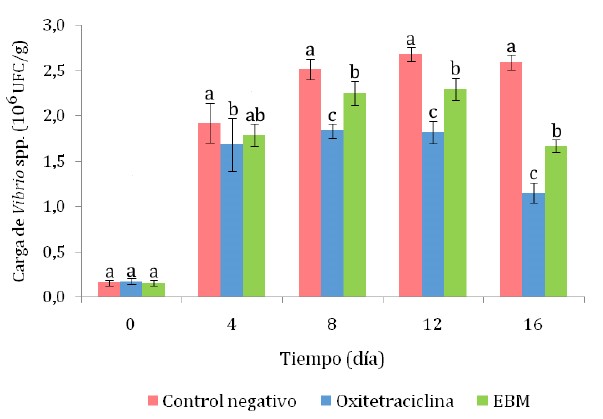
Figura 4 Carga total de Vibrio spp (fermentadores y no fermentadores de sacarosa) en hepatopáncreas de camarones Litopenaeus vannamei infectados experimentalmente con cepas de Vibrio sp. EBM: extracto etanólico de menta en baño maría. Las letras que acompañan a cada indican diferencia significativa según la prueba de Tukey (p<0.05)
El recuento de Vibrio spp en hepatopáncreas indicó un crecimiento elevado de dichas bacterias según el criterio establecido otros estudios (Gómez-Gil, 2005; Rosado, 2018). Así mismo, el recuento de Vibrio spp no fermentadores de sacarosa que superó la carga de 106 UFC/g (en el caso del tratamiento control), indicó una vibriosis (Gómez-Gil et al., 2015).
Si bien el recuento de Vibrio spp en el tratamiento con EBM no fue tan bajo como el logrado con la OTH, pero que la supervivencia y el peso de los camarones con dicho tratamiento fuera similar a los obtenidos con OTH, indica que más allá del efecto bactericida e inmunoestimulante del EBM, es posible que su efecto como atractante y estimulante del apetito (Akbary et al., 2017; Kawamura et al., 2019) esté relacionado con un mayor apetito del camarón infectado, lo cual le podría conferir mayor resistencia a morir y mejorar su peso.
CONCLUSIONES
El extracto etanólico de menta en baño maría (EBM) demostró ser una alternativa viable para incrementar la supervivencia de camarones infectados con Vibrio spp.
Los tres extractos de menta preparados (etanólico en baño maría [EBM], en aceite de oliva en baño maría [ABM] y macerado en aceite de oliva [MA]) pudieron inhibir el crecimiento de Vibrio spp en ensayo in vitro, especialmente con EBM (15 y 20 µl/disco), aunque su poder inhibidor in vitro fue solo equivalente al 58.2% del obtenido con oxitetraciclina.
El EBM al 15‰ (w/v) mejoró la supervivencia y el peso de los camarones infectados experimentalmente con Vibrio spp (p<0.05), con resultados estadísticamente similares a los logrados con el tratamiento con oxitetraciclina.
El EBM redujo la carga de Vibrio spp en el hepatopáncreas de los camarones infectados experimentalmente (p<0.05), aunque en menor proporción al obtenido con oxitetraciclina.
Los resultados indican un excelente potencial terapéutico del EBM, el cual podría ser incluso mejorado, si se realizan ensayos con extractos más puros como con aceite esencial o extractos concentrados usando soxhlet o rotaevaporador.












 uBio
uBio 


