INTRODUCCIÓN
El semen de los camélidos sudamericanos presenta características únicas respecto al de otras especies domésticas, tales como extrema viscosidad, bajos parámetros de motilidad, concentración y viabilidad, entre otros, además de considerar el depósito intrauterino durante la cópula, produciendo su mezcla con sangre y fluidos uterinos e inflamatorios (Franco et al., 1981; Bravo, 2002). Se han desarrollado técnicas de obtención de semen a través de la vagina artificial y la electroeyaculación, obteniéndose diferente tipo y calidad de semen, lo cual ha limitado en alguna forma el desarrollo de protocolos de refrigeración y congelamiento de semen (Sumar, 1991; Pacheco, 2008).
Un estudio en el semen humano demostró la presencia de bacterias de diversos géneros sin relación alguna con los parámetros seminales, evidenciando posible intercambio de bacterias presentes en el tracto vaginal (Baud et al., 2018), habiéndose también descrito poblaciones bacterianas habituales en órganos reproductivos de vacas (Boscan et al., 2010). En el humano se observa una relación en pacientes con cierto grado de infertilidad con bacterias, especialmente con la presencia de E. coli (Moretti et al., 2009). En alpacas vacías se ha demostrado la presencia de bacterias de los géneros Micrococus, Staphylococus, Escherichia, Streptococus, Bacillus, Corynebacterium, Pseudomonas, Proteus y levaduras en vagina (Ccama y Soto, 1997). Estos géneros bacterianos coinciden con el trabajo de Tibary y Anohuassi (2001). Asimismo, se ha descrito la presencia de poblaciones bacterianas en útero y vagina (Jiménez, 2016) y en prepucio de llamas (Jarvinen y Kinyon, 2010), dado que los tractos reproductivos presentan pH neutro favorable para el crecimiento bacteriano, tanto en hembras (Pacheco et al., 2011) como en machos (Huamantuco, 2005).
Entre las técnicas de colecta de semen que vienen siendo investigadas, se describe la obtención de semen pos-cópula, electroeyaculación, vagina artificial, aspiración intrauterina del semen pos-cópula y el uso de un vaginoscopio para obtener el reflujo de la mezcla de semen y fluidos uterinos pos-cópula (Pacheco, 2008), siendo esta última técnica posible de realizar en campo, lográndose obtener gestaciones mediante el uso de muestras frescas y refrigeradas en inseminación artificial (García et al., 2017). No obstante, el avance del uso de la inseminación artificial se ve retrasado por la posibilidad de contaminación intrauterina de las hembras inseminadas, así como posible causa de inflamaciones e infecciones uterinas, por la presencia de carga bacteriana en el fluido colectado pos-cópula (Dellepiane y Morales-Cauti, 2018). Ante estos antecedentes, el objetivo del presente estudio fue determinar la calidad microbiológica y micológica del semen fresco de las alpacas obtenidos mediante las técnicas de electroeyaculación, poscópula y vagina artificial.
MATERIALES Y MÉTODOS
Ubicación
Las muestras de semen fueron colectadas de alpacas del rebaño experimental de La Estación IVITA Maranganí, ubicados en el Fundo La Raya, a 4400 msnm, en Cusco, Perú. Las muestras fueron procesadas en el Área de Microbiología de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos, en Lima.
Animales y Muestras
Se utilizaron 5 hembras y 15 machos Huacaya, con edad promedio de 6 años, mantenidas en condiciones de crianza extensiva, alimentadas en pasturas naturales y clínicamente sanas. Los animales utilizados para las técnicas de electroeyaculación y pos-cópula fueron utilizados anteriormente en monta natural, en tanto que los machos entrenados y utilizados para la técnica de vagina artificial no tuvieron contacto sexual previo con hembras de la especie.
Las muestras para bacteriología fueron tomadas con un hisopo estéril que fue colocado en un tubo estéril conteniendo agar de transporte (medio Stuart). Los fluidos se colectaron en frascos estériles de 15 ml. Las muestras se almacenaron en cajas de poliestireno expandido (Tecnopor) con hielo en geles de 500 g y trasladadas al laboratorio de bacteriología en un lapso de 24 horas.
Las muestras fueron colectadas según los siguientes procedimientos:
Hisopado prepucial. Se hizo un raspado del prepucio y fórnix prepucial (5 machos) utilizando un hisopo estéril.
Hisopado vaginal. Se hizo un hisopado de la porción media y profunda de la vagina (5 hembras) con la ayuda de un espéculo vaginal.
Electroeyaculación (EE). Previo a la toma de muestra, se hizo un lavado del prepucio, glande y fórnix prepucial con suero fisiológico estéril. Se obtuvo el semen por el procedimiento de electroeyaculación descrito por Director et al. (2004) en cinco machos y la muestra se obtuvo introduciendo el hisopo estéril dentro del tubo de colecta. Se utilizaron los mismos machos para la técnica pos-cópula.
Pos-cópula (PC). Se utilizaron 5 machos y 5 hembras. La colección se realizó luego de la cópula. Para ello se utilizó un sigmoidoscopio para alcanzar la os externa del cérvix (Tibary y Pearson, 2015). La muestra fue colectada con hisopo estéril del fluido colectado del tracto reproductivo de las hembras.
Vagina artificial (VA). Se utilizaron cinco machos entrenados para vagina artificial, usando maniquí de hembra, de acuerdo con la técnica descrita por Bravo et al. (1997). Las muestras fueron colectadas del tubo de colección mediante un hisopo.
Para las muestras de hisopado prepucial se utilizaron machos diferentes a los usados en las técnicas de colección de semen. Las muestras fueron obtenidas por separado para cada método de colección, con intervalos de una semana entre colectas.
Análisis Bacteriológico
El aislamiento microbiológico se realizó en agar Sangre y agar MacConkey, con el uso de generadores de anaerobiosis en Anaerocult®, cultivándose entre 24 a 72 h a 37 °C. Se realizaron coloraciones Gram a las colonias obtenidas y se realizaron pruebas bioquímicas primarias como Oxidasa y Catalasa. Posterior a ello, según el Manual Bergey para la identificación del género y especie bacteriana, se utilizaron las pruebas bioquímicas: fermentación de carbohidratos (lactosa, glucosa y sacarosa), prueba de citrato, movilidad, indol, urea, coagulasa, hidrolisis de la esculina, reducción de nitratos, producción de sulfuro de hidrógeno y producción de gas (Brenner et al., 2005).
En el recuento bacteriano se emplearon diluciones de la muestra utilizando agua peptonada tamponada para la dilución. Se emplearon nueve volúmenes del dilutor con un volumen de la muestra, obteniéndose diluciones de 10-1 hasta 10-5. Se transfirió 1 ml y se agregó 20 ml de los medios PCA (Plate count agar) para el recuento de mesófilos y agar BRV (Violeta cristal-rojo neutro-bilis-lactosa) para la cuantificación de coliformes. La incubación se realizó a 37 °C durante 24-48 h. El contaje de colonias se realizó mediante un estereoscopio, de manera de expresar el promedio de (UFC/ml). Los datos fueron analizados mediante estadística descriptiva.
RESULTADOS Y DISCUSIÓN
Los géneros de bacterias u hongos identificados en hisopados de órganos reproductivos de machos y hembras se describen en el Cuadro 1. Las bacterias identificadas en muestras de semen obtenidos por EE, PC y VA se presentan en el Cuadro 2 y la evaluación cuantitativa de la cantidad de unidades formadoras de colonias (UFC) en el Cuadro 3:
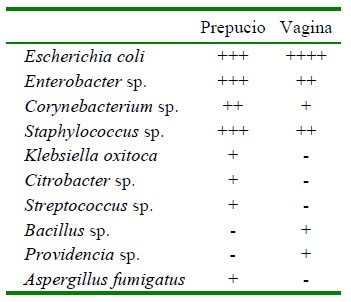
Cuadro 1 Bacterias y hongos aislados de prepucio y vagina de alpacas aparentemente sanas (Cusco, Perú)
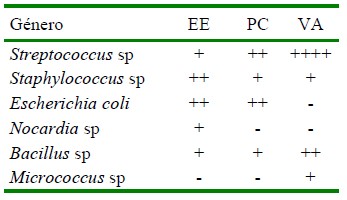
Cuadro 2 Bacterias identificadas en muestras de semen de alpaca obtenidas por electroeyaculación (EE), pos-cópula (PC) y vagina artificial (VA)
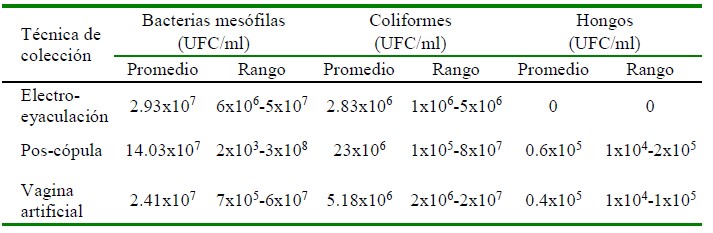
Cuadro 3 Determinación cuantitativa de la presencia de unidades formadoras de colonias (UFC/ml) en muestras de semen de alpaca colectadas mediante las técnicas de electroeyaculación, pos-cópula y vagina artificial
En prepucio se identificaron siete géneros bacterianos y un género fúngico, mientras que en muestras vaginales fueron seis géneros bacterianos, compartiendo especies de los géneros Escherichia, Enterobacter, Corynebacterium y Staphylococcus, por lo que podrían considerarse como géneros saprofitos o residentes comunes de estos órganos, tal como sucede en vacas (Boscan et al., 2010) y ovejas (Swartz et al., 2014). Por otro lado, una evaluación más exhaustiva mediante secuenciamiento genético en semen de cerdos identificó 291 géneros bacterianos (Zhang et al., 2020), lo que refleja la gran diversidad microbiana relacionada a los órganos genitales de los animales.
Todos los géneros bacterianos encontrados en muestras de prepucio de alpaca coinciden con los géneros descritos anteriormente en pene y prepucio de alpacas y llamas (Jarvinen y Kinyon, 2010; Jiménez, 2016) y dromedarios (Ghoneim et al., 2014), con excepción del género Citrobacter que no ha sido descrito en estudios previos. Por otro lado, el hongo Aspergillus fumigatus fue descrito en muestras de semen de alpacas colectado pos-cópula (Dellepiane y Morales-Cauti, 2018), hongo que se encuentra en el medioambiente, de modo que podría fácilmente contaminar el prepucio, especialmente durante la cópula que se realiza con la hembra en recumbencia esternal (Bravo, 2014).
Los géneros bacterianos aislados con mayor frecuencia en muestras vaginales fueron Escherichia, Staphylococcus, Streptococcus y Bacillus, lo cual coincide con descripciones anteriores en alpacas (Ccama y Soto, 1997) y llamas (Jiménez, 2016), mientras que Dellepiane y Morales-Cauti (2018) reportaron la presencia de Escherichia y Providencia en útero de alpaca. E. coli fue una de las bacterias predominantes y en mayor cantidad (Cuadro 1), pudiendo influir negativamente en los parámetros reproductivos (Alfaro-Escalona et al., 2019). Sin embargo, E. coli suele ser el principal contaminante de los genitales, lo que requiere mayor análisis, pues muchas de ellas son comensales, mientras que algunas pueden ser muy específicas, como las E. coli uropatogénicas (Kaper et al., 2004), de las que no se dispone de reportes en alpacas.
Las muestras seminales obtenidas mediante electroeyaculación, a pesar de ser una técnica que permite lavar el prepucio antes de la colección, mantuvo una carga bacteriana similar a las otras dos técnicas utilizadas. Estas poblaciones bacterianas pueden ubicarse en zonas de difícil acceso para ser higienizadas, así como en otras especies como en las criptas del glande en equinos (Clement et al., 1995), el glande, surco coronal y uretra distal en humanos (Lin et al., 2012; Nelson et al., 2012).
Las especies bacterianas presentes en el prepucio de los camélidos tienen mucha probabilidad de contaminar las muestras seminales, a pesar de que en la técnica de electroeyaculación se realiza un lavado del prepucio (Director et al., 2007). En el presente trabajo se encontraron 3 de los 4 géneros descritos por Jiménez (2016) y 3 de los 10 géneros descritos por Jarvinen y Kinyon (2010) en prepucios de llama y alpaca, respectivamente. El lavado prepucial disminuye la carga bacteriana cuando se realiza con soluciones de antibiótico (Bhakat y Raina, 2001); sin embargo, en el presente estudio el lavado se hizo con suero fisiológico estéril, procedimiento que pudo controlar la carga fúngica presente (Rota et al., 2011), pero no la bacteriana (Clement et al., 1995).
Para el caso de las muestras seminales obtenidas pos-cópula, considerando el tipo de cópula, las bacterias presentes deben provenir tanto del macho como de la hembra. Se identificaron cargas bacterianas de Streptococcus sp, Staphylococcus sp, E. coli y Bacillus sp, siendo también estas bacterias comunes en tractos reproductivos del humano (Nelson et al., 2012), ovino (Swartz et al., 2014), vacuno (Peña et al., 2011; Swartz et al., 2014), equino (Clement et al., 1995) y camélidos (Ccama y Soto, 1997; Mshelia et al., 2014; Jiménez, 2016; Dellepiane y Morales-Cauti, 2018).
La introducción intracornual del pene en los camélidos sudamericanos (Bravo, 2014) durante la cópula provoca erosión y sangra do de la mucosa uterina (Vélez, 1997), lo cual conlleva a formar un fluido en fondo vaginal que es una mezcla de semen, sangre y fluidos uterinos de coloración rojiza, baja viscosidad y presencia de contaminantes (Alarcón et al., 2012). Además, el pH cercano al neutro en el tracto reproductivo del macho permite el crecimiento bacteriano (Huamantuco, 2005), mientras que por el tipo de cópula y eyaculación intracornual, la vagina no se comporta como barrera antibacteriana y no se acidifica, presentando un pH de 6.8 en vaginas de hembras vacías, favoreciendo el crecimiento bacteriano (Pacheco et al., 2011).
En semen obtenido por vagina artificial se aislaron bacterias de los géneros Streptococcus, Staphylococcus, Bacillus y Micrococcus, siendo los dos primeros aislados en muestras prepuciales en el presente trabajo. Cabe indicar que los machos sometidos a la técnica de colección por vagina artificial no han tenido contacto sexual previo con hembras.
El conteo de las Unidades Formadoras de Colonias por unidad de volumen (UFC/ml) permitió determinar la cantidad de UFC/ml para bacterias mesófilas, coliformes y hongos en los tres tipos de colecta de semen de alpaca (Tórtora et al., 2007). En el presente estudio, si bien no se evaluaron las características espermáticas, tales como motilidad, viabilidad e integridad de membrana, las cantidades de UFC/ml de bacterias mesófilas y coliformes son mayores a lo reportado en otras especies como el ovino, donde se permite el uso y refrigeración de muestras que tengan menos de 100 UFC/ml, sin efecto detrimental sobre la motilidad y velocidad progresiva (Yániz et al., 2010). Benneman et al. (2018) reportaron en semen de porcinos cantidades inferiores (1x102-3x106 UFC/ml), mientras que Golberg et al. (2013) indican que la máxima cantidad para permitir el procesamiento de semen es de 2.2x102 UFC/ml para bacterias mesófilas y de 3.5x104 UFC/ml para E. coli, siendo las cantidades más elevadas para bacterias mesófilas y coliformes, las muestras obtenidas por la técnica post cópula.
Si bien, en alpacas no existe un estándar de las cantidades máximas de UFC/ml, las cargas bacterianas y fúngicas reportadas en el presente estudio mediante los tres métodos empleados para la obtención de semen son comparables al permitido en porcinos (Golberg et al., 2013). Sin embargo, los métodos de colección de semen tienen un riesgo de contaminación muy alto (Althouse et al., 2000), lo que podría explicar las cargas bacterianas similares en los tres métodos empleados (Cuadro 3).
CONCLUSIONES
La presencia de bacterias en el semen de alpaca fue similar entre los diferentes métodos de colección (vagina artificial, electroeyaculación y pos-cópula).
Los géneros de las bacterias que predominaron fueron Escherichia, Staphylococcus, Streptococcus y Bacillus.
El lavado prepucial permitió eliminar la presencia de hongos en muestras colectadas por electroeyaculación.












 uBio
uBio 


