INTRODUCCIÓN
La acuicultura se consolida como una de las actividades de mayor desarrollo en el sector pecuario en Colombia, con una producción que asciende a 174 607 t anuales, siendo la tilapia el principal contribuyente a la producción nacional, representando el 58% de la producción piscícola (MADR, 2020; Bondad-Reantaso et al., 2021). La tilapia es considerada como un pez resistente a las enfermedades bacterianas y parasitarias comparada con otras especies; sin embargo, se ha evidenciado que es más susceptible a patógenos tales como, Aeromonas hydrophila y Trichodina sp, afectando el rendimiento económico de los productores (Iregui, 2008, Noor El-Deen et al., 2009).
Uno de los ectoparásitos más comunes en tilapias es Trichodina sp, protozoario que puede llegar a causar la muerte de sus huéspedes, especialmente a las larvas (Rodríguez et al., 2019). Los peces, ante una infestación por Trichodina sp presentan secreción excesiva de mucus en el cuerpo y branquias, desprendimiento de escamas, enrojecimiento de la zona infectada y opacidad en la piel (Balbuena et al., 2011). Asimismo, disminución de la tasa de crecimiento, inflamación del tejido epitelial de las branquias y menor capacidad del sistema inmune (Valladão et al., 2014). Los peces se encuentran aletargados en la superficie del estanque, presentan anorexia, oscurecimiento de la piel, úlceras cutáneas, desgaste de las aletas (Roberts, 2012; Valladão et al., 2013; Oliveira et al., 2018) y distrés respiratorio (Sierra et al., 2006).
Dentro de los tratamientos empleados contra ectoparásitos en peces está el uso de inmersiones en soluciones de sal común al 1% y en formol al 33% (Balbuena et al., 2011; Carpenter, 2018). Adicionalmente, se ha utilizado el metronidazol, fármaco que ha mostrado su efectividad en el tratamiento de las Giardias y ha demostrado ser útil contra Neoparamoeba sp (Peyghan et al., 2008). El albendazol ha sido empleado en cachama Colossoma macropomum para el control de monogéneos. Pero son pocos los trabajos en tilapias, tanto en su efecto como en la fase de cultivo. No obstante, Trichodina sp es un protozoario difícil de eliminar mediante tratamientos químicos convencionales, por lo cual se deben hacer mejoras en los tratamientos y probar alternativas sustentables como el ajo Allium sativum y el jengibre Zingiber officinalis.
El objetivo del estudio fue evaluar la eficacia de sustancias farmacológicas (alopáticas) y homeopáticas en la disminución de infestación por Trichodina sp en larvas de tilapia roja Oreochromis sp en el Centro Experimental Piscícola del Politécnico Colombiano Jaime Isaza Cadavid en San Jerónimo (Antioquia, Colombia)
MATERIALES Y MÉTODOS
Este trabajo se realizó en los acuarios del laboratorio del Centro Experimental Piscícola del Politécnico Colombiano Jaime Isaza Cadavid, ubicado en el municipio de San Jerónimo (Antioquia, Colombia), a una altitud de 780 msnm, temperatura media de 28 °C y humedad relativa de 50%. La topografía es de pendiente y con zona de vida bosque seco tropical (bs-T) (Holdridge, 1967).
En el primer ensayo se utilizaron 300 larvas de tilapia roja Oreochromis sp, en fase de reversión capturadas en los estanques de reproducción y llevadas a los 15 acuarios de 85 L, con volumen efectivo de 63 L cada uno. Los tratamientos experimentales para eliminar a Trichodina sp, presentes en las larvas en cultivo, consistieron en dos sustancias homeopáticas (ajo [5 mg/l] y jengibre [5 mg/l]) y dos fármacos alopáticos (metronidazol [10 mg/l] y albendazol [10 mg/l]) que fueron suministrados a las 0 y 48 h. Además, se tuvo un grupo control (sin medicamentos). Cada grupo estuvo conformado por tres réplicas. Las observaciones del número de Trichodina sp se hicieron a las 0 y 48 h, permanecieron las larvas en los acuarios durante las 72 horas para medir el efecto residual.
Con el fin de obtener la cantidad de cada uno de los compuestos, considerando las dosis establecidas en el protocolo, se realizaron los siguientes cálculos: metronidazol para una dosis de 10 mg/l (10 * 63 = 630 mg/acuario), albendazol para una dosis de 10 mg/L (10 * 63 = 630 mg/acuario) y ajo y jengibre en bulbos macerados para una dosis de 5 mg/l (5 * 63 = 315 mg/acuario). De la misma manera se calcularon las dosis para el segundo ensayo. Los pesos se determinaron en una balanza digital Pioneer PA3102 (Ohaus®). Además, se tuvo un grupo control (sin medicamentos). Cada grupo estuvo conforma- do por tres réplicas. Las observaciones del número de Trichodina sp se hicieron a las 0, 48 y 72 h.
En cada muestreo, las larvas fueron anestesiadas con 0.1 ml de Quenaldine® (2-methylquinoline) diluidos en 10 L de agua, durante 30 s. Este proceso se llevó a cabo en grupos de cinco larvas. Cada larva fue observada en microscopio óptico DM3000 (Leica Instruments®), con un aumento de 4X para determinar el número de parásitos contenidos en la cabeza, la aleta dorsal, la aleta ventral y la aleta caudal hasta completar 20 larvas por acuario, para un total de 60 larvas por tratamiento (80 observaciones/larva). Al finalizar el conteo, las larvas fueron puestas en agua con oxígeno y se vigilaron hasta obtener la recuperación fisiológica, momento en el cual se devolvieron a los mismos acuarios de los cuales fueron tomadas.
Se determinó el porcentaje de prevalencia ([N.° larvas con Trichodina sp / N.° larvas observadas] * 100), y el porcentaje de mortalidad ([N.° de larvas muertas / N.° larvas vivas] * 100) de cada grupo experimental.
En un segundo ensayo y con el propósito de validar el efecto de la dosis, se utilizó un compuesto homeopático (ajo) y otro convencional (metronidazol) a dosis de 10, 15 y 20
mg/L y 5, 15 y 20 mg/l, respectivamente. Se siguió el procedimiento empleado en el primer ensayo.
El diseño experimental fue por bloques al azar (cinco tratamientos x tres tiempos de observación [0, 48, 72 h]). En cada larva se hicieron cuatro contajes por tiempo de observación (cabeza, aleta dorsal, aleta ventral y aleta caudal de un lado de la larva). La variable respuesta fue la sumatoria del número de Trichodina sp encontrados en los cuatro puntos de observación sobre la larva.
Los parámetros fisicoquímicos del agua (temperatura, nivel de oxígeno, pH y turbi- dez) fueron determinados con el multiparámetro PCSTest 35 (Oakton®) y HACH (Hanna Instruments®). Los datos, tanto del número de protozoarios como los del agua fueron verificados para el supuesto de Normalidad utilizando la prueba Shapiro-Wilk con un nivel de significancia de p<0.05. En los casos que no se cumplió la normalidad y homogeneidad de varianza, se aplicó el análisis de varianza por rangos de Kruskal-Wallis, estableciendo las diferencias entre los tratamientos con la prueba de Comparación Múltiple de Wilcoxon. En el caso de cumplimiento del supuesto de normalidad, se estableció la diferencia de medias mediante la Prueba de Tukey. Todos los datos fueron registrados en la aplicación de Excel y procesados mediante el paquete estadístico PAST®.
El Comité de Bioética en Investigación con Animales de la Corporación Universitaria Autónoma de las Américas (CICUA) avaló el protocolo, manejo y disposición de los animales utilizados durante el ensayo. Adicionalmente el Centro Experimental Piscícola, cuenta con el aval del Instituto Colombiano Agropecuario (ICA) de Establecimiento de Acuicultura Bioseguro (Resolución ICA 074237 de 2020).
RESULTADOS Y DISCUSIÓN
Los parámetros fisicoquímicos del agua estuvieron dentro del rango óptimo para el cultivo de larvas de tilapia roja Oreochromis sp (Cuadro 1), lo que concuerda con lo reportado por Vidal-Martínez et al. (2017), e indica que las sustancias utilizadas para el control del ectoparásito no alteraron la calidad del agua.
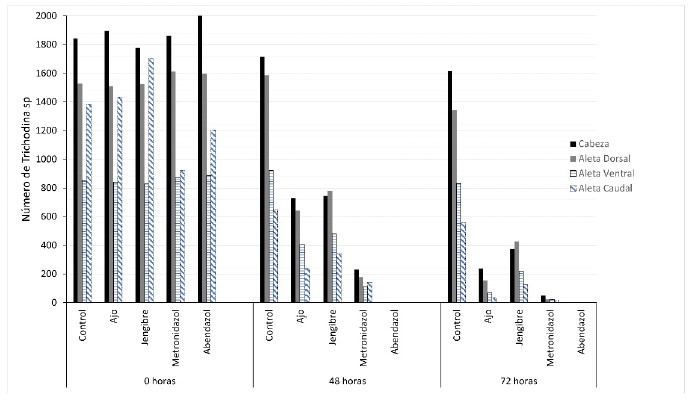
El tratamiento farmacológico con metronidazol y los homeopáticos con ajo y jengibre tuvieron un efecto significativo (p<0.05) sobre la disminución de Trichodina sp, en las larvas de tilapia roja, en tanto que el tratamiento con albendazol causó mortalidad a todas las larvas a las 48 h (Figura 1). El número de Trichodina sp inicial en promedio fue de 5622 y disminuyó a 494 con el ajo (5 mg/l), 1151 con jengibre (5 mg/l) y 111 con metronidazol (10 mg/l) a las 72 h (Cuadro 2).
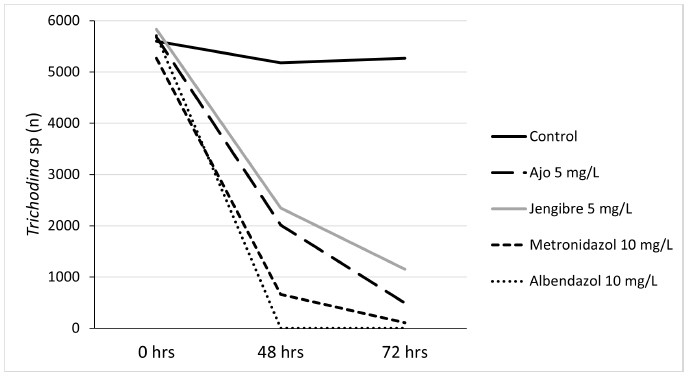
Figura 1 Efecto de los tratamientos farmacológicos y homeopáticos sobre el número de Trichodina sp en larvas de tilapia roja Oreochromis sp
Cuadro 2 Estadística descriptiva del resultado de la aplicación de sustancias farmacológicas (alopáticas) y homeopáticas en la disminución de infestación por Trichodina sp en larvas de tilapia roja Oreochromis sp
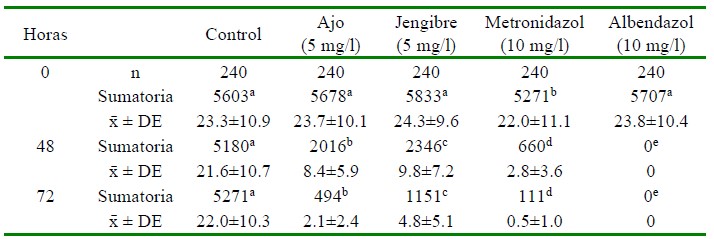
a,b,c,d,e Diferentes letras dentro de filas indican diferencias significativas (p<0.05)
n: número de observaciones (60 larvas x cuatro estructuras anatómicas)
Ẋ±DE: Promedio por cada larva
El promedio de Trichodina sp por larva a las 0 h fue de 23.5, reduciéndose a un promedio de 2.5 a las 72 h. Cabe mencionar que no hubo registros del protozoario en algunas de las estructuras anatómicas observadas (Cuadro 1).
El albendazol tuvo un efecto letal en las larvas de tilapia roja con un porcentaje de mortalidad del 100% en las dosis de 5 y 10 mg/l (Cuadro 2). Sin embargo, en un ensayo preliminar con 5 mg/l sobrevivieron algunas larvas (datos no mostrados). La muerte en larvas de peces provenientes del medio silvestre o en cautiverio puede derivarse en algunos casos por el poco desarrollo o madurez de su sistema inmune, lo cual las hace sensibles a los agentes infecciosos y a diversos factores estresantes del ambiente (Fergusson, 1989; Kubitza, 2008; Roberts, 2012). Carpenter (2018) reporta un rango de dosis eficaz en peces entre 10 y 50 mg/l, pero en el presente estudio las larvas de tilapia roja en reversión no resistieron la dosis de 10 mg/l. Sin embargo, este compuesto ha sido empleado con éxito por Guimarães-Alves et al. (2019) en cachama negra (Colossoma macropomum) para el control de monogéneos con dosis entre 500 a 2000 mg/l. El albendazol como benzimidazólico actúa como un tóxico mitótico en la división celular que desagrega los cromosomas en las células hijas, produciendo aneuploidía, y a su parámetro de lipofilicidad (Oh et al., 2006). Otros estudios han observado concentraciones letales de albendazol; por ejemplo, Iannacone et al. (2016) con 508 y 346 mg/l a las 24 y 48 h en el crustáceo Artemia franciscana y Iannacone y Alvariño (2007) con 479 y 180 mg/l a las 24 y 48 horas de exposición para Daphnia magna.
El metronidazol demostró ser un fármaco efectivo que redujo a 111 el número de Trichodinas sp al final del tratamiento (Cuadro 2). También ha mostrado su efectividad en el tratamiento de Giardia y de Neoparamoeba sp (Peyghan et al., 2008). En el caso de los protozoarios, se ejerce un efecto citotóxico al inmovilizarlos por hialinización del citoplasma, formación de figuras esferoides y ruptura de la membrana celular (Sumano, 2006).
El tratamiento con ajo Allium sativum resultó en una reducción del 91% de Trichodinas sp. La alicina es uno de los principios activos que tiene actividad antibacteriana y antiparasitaria al interferir con las reacciones químicas con los grupos tipo tiol de diferentes enzimas (Peyghan et al., 2008). También ha sido utilizado para combatir la trichodiniasis en tilapia a dosis de 300 mg/l eliminando el 75% de los parásitos a las 24 h (Abd El-Galil y Aboelhadid, 2012). Además, Nor El-Deen et al. (2009) removió el parásito en tilapias adultas tras dos días de tratamiento demostró con dosis de 800 mg/kg. Por otro lado, en el estudio de Mohamed et al. (2012 con prevalencias de tricodiniasis entre 23 y 40.5% e intensidad de infección de 25 o más parásitos en larvas de tilapia nilotica (Oreochromis niloticus) se logró eliminar el 100% de los parásitos con el uso de 2.0 a 3.0 mg/l de aceite de ajo en 24 h.
Cuadro 3 Porcentaje de prevalencia de Trichodina sp por efecto del tratamiento (horas pos-exposición) con sustancias farmacológicas (alopáticas) y homeopáticas en larvas de tilapia roja Oreochromis sp los tratamientos utilizados durante el tiempo de observación
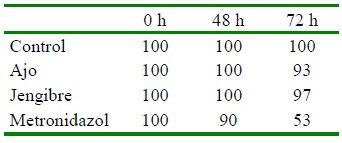
Según Narain et al. (2022), las propiedades de la alicina como antimicrobiano y antiparasitario se deben al efecto citotóxico o letal que ejerce sobre las células de diferentes microorganismos. Ocurre inflamación de las células, la disfunción de las mitocondrias, la permeabilización de la membrana plasmática, y la liberación del contenido citoplasmático al espacio extracelular (Baeza Martín, 2014). Asimismo, se describe que ciertos microorganismos son sensibles a los compuestos del ajo a través de la disminución del consumo de oxígeno (Ramírez et al., 2016). Esta investigación valida la eficacia de acción del ajo sobre los ectoparásitos, y se resalta que las dosis aplicadas fueron meno- res a lo reportado por otros investigadores.
El uso de jengibre Zingiber officinalis disminuyó en 80% la presencia de Trichodina sp (Cuadro 2). Otros estudios han revelado las propiedades del aceite esencial de jengibre como estimulante del sistema inmune en trucha arcoíris Oncorhynchus mykiss, las cuales mostraron un aumento de los neutrófilos, así como el incremento de la enzima lisozima, la cual rompe las paredes de ciertos microorganismos mediante la hidrólisis de enlaces glucosídicos (Fadeifard et al., 2018).
Al comparar el efecto de la dosis del compuesto homeopático ajo (10, 15, 20 mg/l) respecto a las de metronidazol (5, 15. 20 mg/l) se obtuvo una disminución del 99% del número de Trichodina sp, a medida que aumentaron las concentraciones de ambos compuestos. Estas dos sustancias fueron elegidas por su mejor respuesta en el control del protozoario. Los resultados sugieren una eficacia del ajo a 20 mg/l similar a la que presentó el metronidazol a 20 mg/l (Figuras 2 y 3), lo cual permitiría reemplazar los medicamentos farmacológicos convencionales por alternativos u homeopáticos, constituyéndose en un manejo sanitario orgánico adecuado dentro del cultivo de peces en esta fase. Los productos alternativos son más seguros e inocuos para los peces y amigables con el medio ambiente por tener un menor impacto sobre las propiedades fisicoquímicas del agua, redundando en la seguridad alimentaria y salud pública por los menores efectos tóxicos y secundarios.
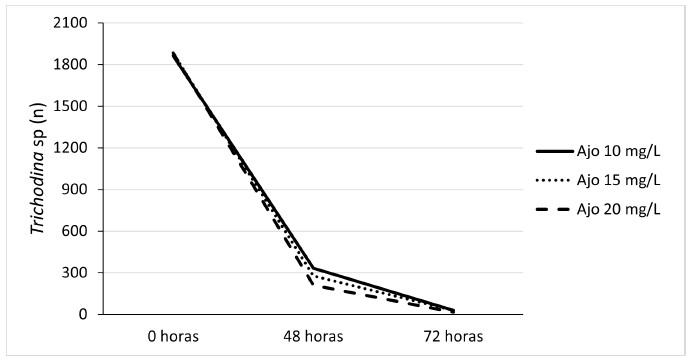
Figura 2 Efecto de tres dosis de ajo (Allium sativum) sobre la carga parasitaria de Trichodina sp en larvas de tilapia roja (Oreochromis sp)
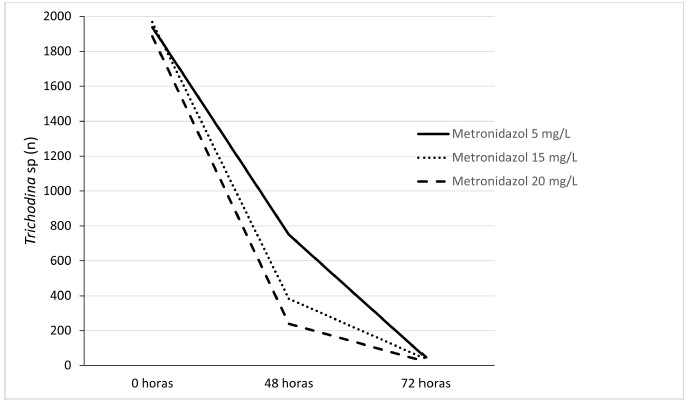
Figura 3 Efecto de tres dosis de metronidazol sobre la carga parasitaria de Trichodina sp en larvas de tilapia roja (Oreochromis sp)
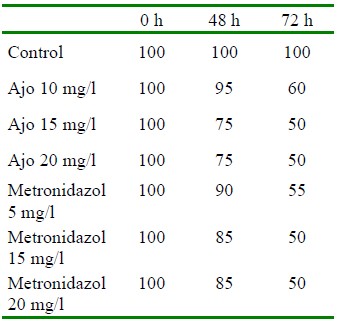
La prevalencia es un indicador primordial en salud para evaluar el efecto de diferentes compuestos; por tanto, en este estudio se consideró importante determinar el efecto del aumento de concentraciones del ajo Allium sativum y del metronidazol que fueron las sustancias que indicaron un mejor efecto en el control del parásito. Los resultados mostraron que el efecto de las tres concentraciones de ajo y metronidazol fue similar en las dosis de 15 mg/l de ambos compuestos, donde la prevalencia disminuyó al 50% a las 72 horas (Cuadro 4).
Cuadro 4 Porcentaje de prevalencia de Trichodina sp por efecto del tratamiento (horas pos-exposición) la dosis diferencial de ajo y metronidazol en larvas de tilapia roja Oreochromis sp los tratamientos utilizados durante el tiempo de observación
En cuanto al tropismo del parásito, el mayor número de Trichodina sp se observó en el área superficial de la cabeza, seguido de la aleta dorsal (Figura 4). La literatura reporta predilección de algunas especies de Trichodinidae por determinadas estructuras anatómicas y tejidos; así, Paratrichodina africana ha sido encontrada en tejido de branquias y Trichodina centrostrigeata en piel, branquias y especialmente en tejido res piratorio en tanto que T. compacta, T. magna y T. heterodentata en tilapias tienen predilección por la piel y las aletas (Benites de Pádua et al., 2011). La predilección de la Trichodina de esta investigación por la cabeza y aleta dorsal se puede deber a los requerimientos metabólicos y de sobrevivencia del parásito que requieren de iones, nutrientes, oxigenación y abundante riego sanguíneo, los cuales son aportados, en gran medida, por las branquias de las larvas de tilapia roja.
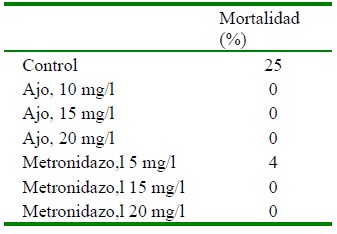
La mortalidad de larvas de tilapia roja Oreochromis sp fue de 100% con el tratamiento de albendazol a una dosis de 10 mg/l. Por otro lado, el porcentaje de mortalidad del grupo control fue superior respecto a los tratamientos de ajo, jengibre y metronidazol, lo que muestra el grado de afectación en las larvas en reversión (Cuadro 5). El efecto de letalidad del albendazol se debe a la citotoxicidad de este compuesto.
Cuadro 5 Porcentajes de mortalidad de larvas de tilapia roja Oreochromis sp obtenidos en los tratamientos aplicados contra la Trichodina sp a las 72 horas de exposición

En el segundo ensayo, cuando se compararon varias dosis de ajo y metronidazol, el porcentaje de mortalidad de las larvas fue de 0% con el aumento de las dosis evaluadas (Cuadro 6), lo que sugiere un uso seguro de estas sustancias para la disminución de la Trichodina sp de larvas de tilapia en reversión.
CONCLUSIONES
Tanto el ajo Allium sativum como el metronidazol tuvieron una eficacia similar y positiva en el control de Trichodina sp en larvas de tilapia roja Oreochromis sp.
El uso de albendazol a 10 mg/l L causó alta mortalidad en larvas de tilapia de roja Oreochromis sp.
El empleo del ajo podría reemplazar el uso de sustancias farmacológicas para el tratamiento de tricodiniasis.
El uso de sustancias homeopáticas en el tratamiento sobre Trichodina sp aporta a la sustentabilidad de los sistemas productivos acuícolas.












 uBio
uBio