INTRODUCCIÓN
Toxoplasma gondii es un parásito protozoo intracelular obligado. Es agente causal de la toxoplasmosis, enfermedad zoonótica reemergente que tiene una distribución mundial y que, en individuos inmunocompetentes, cursa generalmente asintomática o con sintomatología muy leve; sin embargo, su importancia radica en la transmisión vertical en mujeres embarazadas que ocasiona alteraciones o malformaciones en el feto o abortos espontáneos (Tenter et al., 2000; Grandía et al., 2013). En individuos inmunocomprometidos afecta principalmente a los órganos del sistema nervioso central, ocasionando signos de focalización neurológica como desorientación, cefalea, trastornos del habla, etc. (Barba-De la Torre et al., 2011). En México, los casos de toxoplasmosis son más frecuentes en habitantes de regiones con climas tropicales o subtropicales debido a las condiciones de alta temperatura y humedad que permiten el mantenimiento de los ooquistes infectantes en el ambiente (Hernández-Cortazar et al., 2015). En este contexto, se ha sugerido que el calentamiento global tiene un papel determinante en la distribución, extensión y presencia de la enfermedad en regiones no endémicas (Robert-Gangneux y Darde, 2012).
Se considera que hasta un tercio de la población humana de adultos tiene evidencia de respuesta inmune (inmunoglobulinas [Ig]) contra T. gondii (Hernández-Cortazar et al., 2015), con grandes variaciones en las frecuencias de anticuerpos entre habitantes de distintas regiones, dependiendo de las condiciones climáticas, higiene personal o comunitaria, los hábitos alimenticios, calidad de agua para consumo, tipo y método de crianza del ganado, entre otros (Tenter et al., 2000; Barba-De la Torre et al., 2011; Palmezano-Díaz et al., 2015). La infección con T. gondii puede adquirirse a cualquier edad, por lo que la implementación de medidas preventivas es necesaria para limitar la transmisión, sobre todo en regiones donde la infección es endémica (Barba-De la Torre et al., 2011).
En México, la infección es endémica, habiéndose reportado tasas de anticuerpos contra T. gondii entre 1 y 50%, llegando hasta 64% en los estados del Golfo de México y de las costas del Océano Pacífico (Hernández-Cortazar et al., 2015). Específicamente, en el estado de Yucatán se han descrito frecuencias de IgG del 55% y del 20% para IgM en mujeres con abortos espontáneos (Vado-Solís et al., 2013).
Toxoplasma gondii es capaz de parasitar a un gran número de hospederos, entre ellos los intermediarios como el humano, y definitivos que son los felinos domésticos y silvestres33. La infección activa se ha reportado en alrededor de 200 especies de hospederos vertebrados, mamíferos y aves. No obstante, los más importantes son los gatos domésticos (Felis catus) por ser las fuentes principales de infección para el humano (Tenter et al., 2000; Mimica et al., 2015; Khademvatan et al., 2017).
El ciclo de transmisión de T. gondii es diverso y complejo porque puede transmitirse por diferentes mecanismos y vías. En este sentido, para la salud pública, la vía más importante es el consumo accidental de quistes tisulares en carne cruda o mal cocida o por consumo de fuentes de agua contaminada con ooquistes liberados en el ambiente (Hernández-Cortazar et al., 2015; Palmezano-Díaz et al., 2015). Así mismo, la transmisión del parásito puede ocurrir de hospederos finales a hospederos intermediarios y viceversa, así como entre hospederos intermediarios sin la presencia necesaria de hospederos finales (Tenter et al., 2000). Los pequeños roedores son relevantes en el ciclo de transmisión, dado que los gatos se infectan al consumir este tipo de animales con infecciones activas (Dubey et al., 2006; Dabritz et al., 2008). Igualmente, se ha demostrado que la circulación de roedores con anticuerpos contra el parásito es un factor importante para el contagio de los hospederos finales, al constituir una fuente de alimento para ellos (Navarro et al., 2015). Ante esto, el objetivo del presente estudio fue detectar ADN de T. gondii en músculo esquelético y riñón recolectados de pequeños roedores silvestres capturados en la península de Yucatán, México.
MATERIALES Y MÉTODOS
Sitios de Captura
Los sitios de captura se distribuyeron en los tres estados que conforman la península de Yucatán, México: Campeche, Quintana Roo y Yucatán (Figura 1). Estos fueron seleccionados por su cercanía a caminos pavimentados o en buen estado (fácil acceso), disponibilidad de energía eléctrica y agua corriente y con zonas extensas de vegetación silvestre (conservadas sin manipulación o aprovechamiento).
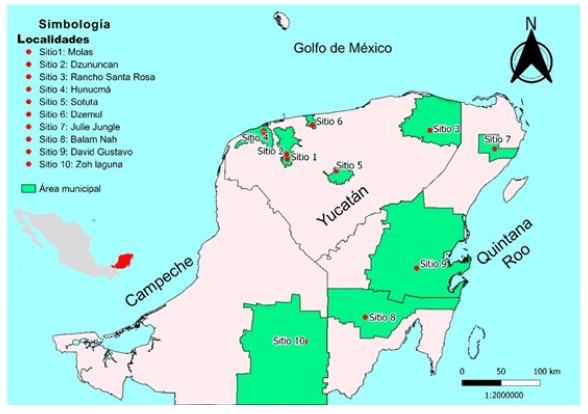
Figura 1 Mapa de la península de Yucatán, México, mostrando los sitios de captura (puntos rojos) de los roedores utilizados en la presente investigación. Las áreas verdes corresponden a la extensión (área municipal) del municipio al cual pertenece el sitio de captura. Los sitios están numerados según el orden cronológico de las capturas
Sitio 1. Comisaría de Molas (20°47’54.5" N, 89°37’56.9" W), perteneciente al municipio de Mérida, Yucatán. Se ubica en la reserva ecológica Cuxtal. Clima cálidosubhúmedo con una temperatura media de 26 °C y precipitación pluvial de 850 a 1100 mm (Torres-Castro et al., 2014; Sosa-Escalante et al., 2017).
Sitio 2. Comisaría de Dzununcán (20°51’31.7" N, 89°38’28" W), ubicada también en la reserva Cuxtal, Mérida, Yucatán. Tiene las mismas condiciones medioambientales (clima, temperatura media y precipitación pluvial media) que Molas (sitio 1). La vegetación dominante en ambos sitios es de selva baja caducifolia (Sosa-Escalante et al., 2017).
Sitio 3. Rancho Santa Rosa (21°08’54.4" N, 87°54’37.8" W), ubicado en el municipio de Tizimín, Yucatán. Tiene una temperatura media de 25.8 ºC y precipitación pluvial de 1200 mm. La mayor parte del municipio está ocupado por pastos, forrajes y árboles maderables (INAFED, 2021a).
Sitio 4. Municipio de Hunucmá (21°02’10.26" N, 89°53’00.6" W), Yucatán. Clima cálido semiseco con lluvias en verano, temperatura media de 26 °C y precipitación pluvial de 1200 mm. La vegetación dominante es la selva baja caducifolia (INAFED, 2021b).
Sitio 5. Municipio de Sotuta (20°35’45.15" N, 89°0’33.96" W), Yucatán. Clima cálido subhúmedo con lluvias en verano, temperatura media de 24 °C y precipitación pluvial de 1100 mm. La vegetación dominante es la selva baja caducifolia (INAFED, 2021c).
Sitio 6. Municipio de Dzemul (21°12’50.8" N, 89°19’39.2" W), Yucatán. Clima cálido-semiseco con lluvias en verano, temperatura media de 26.3 °C y precipitación pluvial de 1200 mm. La mayor parte de su territorio está dedicada al cultivo de henequén (Agave fourcroydes) y agricultura de temporal (INAFED, 2021d).
Sitio 7. Eco-hotel ‘Julie Jungle’ (20°50’54" N, 86°52’34" W), ubicado en el municipio de Puerto Morelos, Quintana Roo. Clima cálido subhúmedo con lluvias en verano, con temperatura media de 24 °C (centro) y de 28 °C (este) y con precipitación pluvial variada de 1000 (centro) a 1500 mm(este). La mayor parte de la vegetación está compuesta por selva mediana subperennifolia conservada (INEGI, 2017).
Sitio 8. Centro recreativo ecoturístico ‘Balam Nah’ (19°28’35.77" N, 88°4’2.07" W), ubicado en el municipio de Felipe Carrillo Puerto, Quintana Roo. Clima subhúmedo con lluvias en verano, con temperaturas medias de 24.6-28.4 °C y precipitación pluvial de 1322 mm. El tipo dominante de vegetación es similar a la del sitio 7 (INEGI, 2017).
Sitio 9. Localidad de David Gustavo Gutiérrez Ruiz (18°53’44.85" N, 88°42’16.19" W), ubicado en el municipio de Bacalar, Quintana Roo. Clima cálido subhúmedo con lluvias en verano, con temperatura media de 24-28 °C. La mayor parte de su extensión está cubierta por selva con vegetación hidrófila y pastizales (INEGI, 2017).
Sitio 10. Localidad de Zoh Laguna (18°35’36.45" N, 89°25’1.52" W), ubicada en el municipio de Calakmul, Campeche. Clima cálido subhúmedo con lluvias en verano con distintos subtipos. En la región de la biosfera y la fracción colindante con el municipio de Escárcega domina el clima cálido subhúmedo con lluvias en verano de media humedad (72% de la superficie regional). Calakmul ha sido descrito como predominantemente selva mediana subperen-nifolia con porciones de selva alta perennifolia, selva baja subperennifolia, sabanas y vegetación de hidrófitas (Galindo-Leal, 1999).
Lineamientos Bioéticos
La captura y el procesamiento de los animales se realizaron con aprobación del Comité de Bioética del Campus de Ciencias Biológicas y Agropecuarias (CCBA) de la Universidad Autónoma de Yucatán (UADY) (Acta CB-CCBA-I-2018-001), Mérida, México. Para el procesamiento de los roedores se consideraron los lineamientos establecidos en la Norma Oficial Mexicana NOM-062-ZOO-1999 que contiene las especificaciones técnicas para la producción, cuidado y uso de animales de laboratorio (https://www.fmvz.unam.mx/fmvz/principal/archivos/062ZOO.PDF). Además, se consideraron los estatutos de la American Society of Mammalogists para el uso de animales silvestres en investigación (Sikes et al., 2016) y los protocolos de bioseguridad descritos por el Centro de Prevención y Control de Enfermedades (CDC, por sus siglas en inglés) de los Estados Unidos de América (Mills et al., 1995; Mauldin et al., 2016).
Captura de Roedores
Se realizó un periodo de captura de tres noches consecutivas en cada sitio de estudio. Las capturas fueron en septiembre (sitios 1 y 2) y noviembre (sitio 3) de 2018, y en enero (sitio 4), marzo (sitios 5 y 6), agosto (sitio 7) y septiembre (sitios 8, 9 y 10) de 2019. En cada lugar se colocaron 280 trampas Sherman (7.5 x 23 x 9 cm) distribuidas en transectos lineales (aproximadamente 5 m entre trampas) para cubrir la mayor parte de la superficie con vegetación conservada. Las trampas se inspeccionaron durante las mañanas de los días de muestreo, substituyendo con una vacía aquellas con captura y colocadas en el mismo punto. Las trampas fueron cebadas con una mezcla de esencia artificial de vainilla y semilla de girasol o avena y se posicionaron en lugares protegidos de la luz solar y el calor.
Identificación y Manejo de los Roedores
Los roedores capturados fueron trasladados a una estación de campo (armada en el interior de cada sitio de estudio) para su identificación y procesamiento. Para la identificación de las especies se empleó la guía «Mamíferos de Centroamérica y del Sureste de México» de Reid (2009). Adicionalmente, se crearon bases digitales de datos (Microsoft Excel®) para depositar la información y obtener las frecuencias de captura por especie y por sitio de estudio.
Los animales fueron insensibilizados, anestesiados y eutanasiados previo a la toma de muestras biológicas. La insensibilización y anestesia se realizaron con isoflurano (Sofloran® Vet, PiSA®; México) y la eutanasia por dislocación cervical (Medina-Pinto et al., 2019). Posteriormente, se realizó una necropsia para la recolección aséptica de un fragmento de músculo estriado y otro de riñón que se depositaron en microtubos para microcentrífuga de 1.8 ml, embebidos en etanol al 96% para su conservación y traslado al Laboratorio de Enfermedades Emergentes y Reemergentes (LEER) del Centro de Investigaciones Regionales «Dr. Hideyo Noguchi» (CIR), UADY.
Extracción y Viabilidad de ADN
Todos los fragmentos colectados de órganos se lavaron con agua destilada durante mínimo 5 min para retirar el exceso de etanol que interfiere con la calidad del proceso. Para la extracción del ADN total se empleó el kit comercial QIAamp DNA Mini Kit® (Qiagen®; Alemania) siguiendo las especificaciones del protocolo «DNA Purification from liquids and fluids». Los productos obtenidos fueron evaluados con un espectrofotómetro (NanoDrop-2000®, Thermo Scientific®; EUA) para conocer su pureza y concentración. Consecutivamente, se depositaron a 4 °C hasta su empleo en las reacciones moleculares.
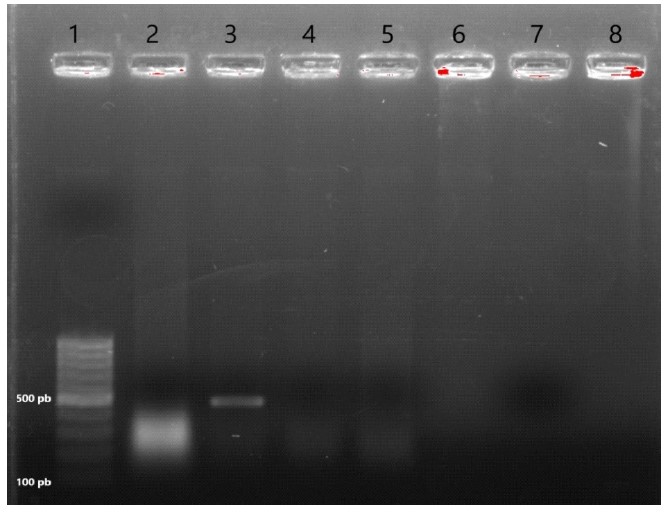
La viabilidad del ADN extraído se valoró a través de la amplificación de un fragmento del gen que codifica para la enzima gliceraldehído-3-fosfato deshidrogenasa (GAPDH). Para lo cual se emplearon los oligonucleótidos (sentido: 5’-CTTTGGTA- TCGTGGAAGGAACTC-3 y antisentido: 5’- GTAGAGGCAGGGATGATGTTCT-3) y el control interno (Control GAPDH RNA) proporcionados en el RevertAid First Strand cDNA Synthesis Kit® (Thermo Scientific™; EUA). Las extracciones de ADN que presentaron el tamaño de banda deseado (496 pares de bases [pb]) fueron utilizados en la reacción para la identificación de ADN de T. gondii.
Detección de ADN de T. gondii
Para la detección molecular de ADN de T. gondii se realizó una PCR anidada de punto final con la finalidad de aumentar la sensibilidad y especificidad de la prueba (Campo-Portacio et al., 2014). La reacción se dirigió a la amplificación de un fragmento de 560 pb del gen B1 del parásito. Para la primera etapa de la reacción se utilizaron los oligonucleótidos Pml/S1 5’-TGTTC- TGTCCTATCGCAACG-3’ (sentido) y Pml/AS1 5’-ACGGATGCAGTTCCTTTCTG-3’ (antisentido). En la segunda etapa se usaron los oligonucleótidos Pml/S2 5’-TCTTC- CCAGACGTGGATTTC-3’ (sentido) y Pml/ AS2 5’-CTCGACAATACGCTGCTTGA-3’-(antisentido) (Sroka et al., 2009).
El volumen final de los reactivos empleados en ambas etapas de la PCR anidada fue de 25 µl conformado de: 2.5 µl de PCR Buffer 5X, 2.5 mM de MgCl2, 0.5 µl de dNTP’s, 0.2 µM de cada oligonucleótido, 1U µl de Taq ADN polimerasa (Fermentas®; EUA), 13.3 µl de agua ultrapura y 5 µl (53.2-246.5 ng/µl) de ADN templado. Se utilizaron las siguientes condiciones en el termociclador: desnaturalización inicial a 95 °C por 3 min, seguido de 35 ciclos de 30 s a 95 °C para desnaturalización, 30 s a 64.2 °C para hibridación y 45 s a 72 °C para elongación; concluyendo con un ciclo de 5 min a 72 °C para elongación final. Estas condiciones fueron utilizadas igualmente para la segunda etapa de la reacción.
En todas las reacciones se incluyó un control positivo, que consistió en ADN de T. gondii identificado en animales infectados de estudios previos conducidos en el LEER, y un control negativo que consistió en una mezcla de los reactivos de las reacciones más agua de grado biología molecular (sin ADN templado).
RESULTADOS
Se capturaron 127 roedores pertenecientes a siete especies. En el Cuadro 1 se presentan las familias, especies y el número total de individuos capturados por especie y por sitio de estudio. La especie con el mayor número de individuos capturados fue Heteromys gaumeri con 39 (se capturó por lo menos un individuo en cada sitio de estudio), seguida de Peromyscus yucatanicus con 35. Las especies Reithrodontomys gracilis, Mus musculus y Rattus rattus tuvieron el número menor de especímenes capturados con dos. El sitio con el número mayor de roedores capturados fue el 5 (Sotuta) con 30, seguido del sitio 10 (Zoh Laguna) con 16. En los sitios 5, 6 (Dzemul), 7 (Julie Jungle) y 10 se capturó el mayor número de especies distintas con cuatro.
Cuadro 1 Familias, especies y número de roedores capturados por sitio de estudio en la península de Yucatán, México
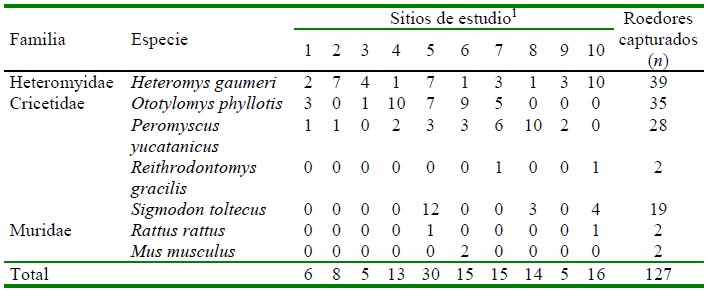
1 1. Molas; 2. Dzununcán; 3. Rancho Santa Rosa; 4. Hunucmá; 5. Sotuta; 6. Dzemul; 7. Julie Jungle; 8. Balam Nah; 9. David Gustavo; 10. Zoh Laguna
Todas las extracciones de ADN presentaron la banda correspondiente al control de la enzima GAPDH. No se encontró evidencia de ADN de T. gondii en alguno de los órganos evaluados (músculo esquelético y riñones) (Figura 2).
DISCUSIÓN
Varias investigaciones han descrito que los roedores sinantrópicos y otros micromamíferos son protagonistas de los ciclos de transmisión de agentes etiológicos, como Leptospira spp, Rickettsia spp y Trypanosoma cruzi, que impactan de forma negativa en la salud pública y animal de la península de Yucatán (Reyes-Novelo et al., 2011; Torres-Castro, 2017; Haro et al., 2021; Panti-May et al., 2021). Sin embargo, los estudios realizados con roedores silvestres capturados en ambientes conservados o con poca actividad antropogénica son escasos. Aunado a que, hasta donde los autores reconocen, no existen trabajos previos realizados con roedores capturados en Campeche o Quintana Roo que hayan intentado detectar la infección con T. gondii (Hernández-Cortazar et al., 2015). En este contexto, y para contribuir con la comprensión de la cadena epidemiológica de T. gondii en la región, se decidió evaluar la infección activa con T. gondii en muestras de músculo esquelético y riñón colectadas de pequeños roedores sil- vestres en ambientes naturales de la península de Yucatán.
A nivel internacional, los pequeños roedores han sido implicados como hospederos intermediarios de T. gondii, principalmente en países en vías de desarrollo (Araújo et al., 2010; Khademvatan et al., 2017; Wang et al., 2019) y en áreas con poblaciones numerosas de felinos (hospederos finales), sobre todo gatos domésticos o ferales, ya que los pequeños roedores y otros animales insectívoros representan uno de los mecanismos de transmisión más relevantes (por ser presas habituales u ocasionales) para estos hospederos finales que a su vez diseminan al ambiente ooquistes de T. gondii, perpetuando el ciclo de transmisión y afectando a otros hospederos susceptibles como los humanos (DeFeo et al., 2002; Dabritz et al., 2008; Jittapalapong et al., 2011; Machaèová et al., 2016; Sroka et al., 2019; Dubey et al., 2021). En relación con esto, se indica que los roedores pueden llegar a representar dos terceras partes de la dieta de felinos silvestres, dependiendo de factores como su densidad poblacional, estación del año y presencia de otras presas como aves pequeñas (Dabritz et al., 2008).
Las evidencias, obtenidas con herramientas de diagnóstico molecular de la infección activa con T. gondii en animales capturados en ambientes urbanos o suburbanos de Yucatán, han sido establecidas previamente. Animales como los roedores sinantrópicos M. musculus y R. rattus (Torres-Castro et al., 2016a) y zarigüeyas Didelphis virginiana (Torres-Castro et al., 2016b) han presentado frecuencias de infección de 5.3% (10/187) y 76.9% (10/13), respectivamente; hallazgos que difieren totalmente con los resultados de esta investigación. En lo relacionado con animales de ambientes silvestres de la misma región, también se tuvo evidencias de la infección con T. gondii en murciélagos (11.6%, 8/69), incluyendo especies como Artibeus jamaicensis, Glossophaga soricina y Chiroderma villosum (Torres-Castro et al., 2019a). En cadáveres de animales silvestres recolectados en carreteras, se describió la presencia de ADN de T. gondii en órganos como riñón y músculo esquelético de una ardilla (Sciurus yucatanensis), un coati (Nasua narica) y un grisón mayor (Galictis vittata) (Torres-Castro et al., 2019b).
No obstante lo anterior, este trabajo no es el primero que no logra establecer la presencia de ADN de T. gondii en tejidos colectados de roedores capturados en Yucatán. Previamente, Torres et al. (2016) no encontraron evidencia del parásito en muestras de encéfalo tomadas de M. musculus y R. rattus (0/228) capturados en distintas localidades. Resultados similares exponen Herrmann et al. (2012) en 69 roedores Microtus arvalis capturados en Brandenburg, Alemania, con ausencia de infección en pulmón y corazón, y Saki y Khademvatan (2014) en muestras de cerebro, músculo e hígado de seis ejemplares M. musculus capturados en Irán. Recientemente, Krijger et al. (2020) reportaron la ausencia de infección en cerebros recolectados de roedores de las especies Apodemus sylvaticus, Micromys minutus, M. arvalis, M. musculus, Ondatra zibethicus y R. rattus.
Se asume que los pequeños roedores y otros mamíferos se infectan con T. gondii por diferentes vías y mecanismos, como la vía congénita (vertical), el canibalismo (Murphy et al., 2008) y principalmente, por el consumo de alimentos o agua contaminados con ooquistes del parásito (Marshall et al., 2004; Dabritz et al., 2008; Thomasson et al., 2011; Sroka et al., 2019). No obstante, existen algunos factores que pueden explicar la ausencia de ADN de T. gondii en los órganos de los roedores utilizados en este trabajo. Uno de ellos es la baja o nula circulación de hospederos finales (felinos) en los sitios de estudio, lo que puede limitar considerablemente la circulación del parásito (Dabritz et al., 2008). Aunque es difícil de aseverar, es importante señalar que, durante los días de captura, no se observaron gatos silvestres, domésticos o ferales. En relación con esto, Dabritz et al. (2008) describen que, en los sitios de captura de su investigación, tampoco se observaron felinos por lo que la contaminación ambiental o de las fuentes de alimento con ooquistes de T. gondii es limitada, contrario a lo que sucede en áreas con altas densidades de felinos como los sitios urbanizados (ciudades y otros asentamientos urbanos).
Otro factor pudo ser los efectos limitados antropogénicos en los sitios de captura, ya que la alta perturbación de los ambientes está relacionada con la amplia distribución de los ooquistes y la transmisión activa de T. gondii en hospederos susceptibles, sobre todo en mamíferos pequeños (Gennari et al., 2015). Adicionalmente, la falta de evidencia de ADN de T. gondii en los roedores silvestres sugiere que, dentro del ciclo silvestre de transmisión, estos animales no son la principal fuente de contagio, sino otros pequeños mamíferos como ardillas (Pinedo et al., 2019), murciélagos (Torres-Castro et al., 2019a), aves (Pinedo et al., 2019) e incluso otros mamíferos medianos (Torres-Castro et al., 2019b).
Aunque especulativa, otra de las causas que se puede relacionar con los resultados negativos, es la limitada cantidad de ooquistes del parásito en los órganos evaluados. Vujaniæ et al. (2011) indicaron que la prueba de PCR resulta negativa en órganos con pocos ooquistes de T. gondii, esto debido a la pequeña cantidad (25 µg) de tejido que se emplea en la extracción de ADN genómico. No obstante, la técnica de PCR para la identificación de T. gondii tiene valores elevados de sensibilidad y especificidad (Vujaniæ et al., 2011; Saki y Khademvatan, 2014), por lo que su empleo en investigación y diagnóstico está ampliamente recomendado.
En relación con los tejidos evaluados, se decidió trabajar con músculo esquelético y riñón debido a que han sido previamente empleados en la detección de la infección con T. gondii en animales silvestres de la región (Torres-Castro 2019b); sin embargo, debido a la amplia cantidad de órganos que este parásito puede invadir, se recomienda realizar una nueva captura de roedores silvestres para incluir otros órganos como cerebro, corazón, hígado, linfonódulos, bazo y pulmón (Richini-Pereira et al., 2016). Otra recomendación es aplicar pruebas serológicas en pequeños roedores de Yucatán para determinar la presencia de anticuerpos contra T. gondii y verificar que estos animales han estado expuestos (o no) al parásito y, de esta forma, ampliar el panorama sobre su participación en el ciclo epidemiológico de T. gondii. En relación con esto, Pinedo et al. (2019) reportaron frecuencias de anticuerpos contra T. gondii en roedores (Rattus spp) capturados en un zoológico de Lima, Perú.












 uBio
uBio