INTRODUCCIÓN
Las derivaciones portosistémicas o anomalías vasculares portosistémicas congénitas en perros consisten en vasos anómalos que permiten que la sangre proveniente del estómago, intestinos, páncreas y bazo pase directamente a la circulación sistémica eludiendo el hígado (Greenhalgh et al., 2010), lo cual resulta en un inadecuado desarrollo hepático, disminución del metabolismo y producción de proteínas, reducción en la eliminación de toxinas y medicamentos, y posible falla hepática (Karen y Berent, 2018). Los sistemas afectados son el sistema nervioso central, gastrointestinal y urinario. Los síntomas neurológicos suelen ser inespecíficos, y pueden incluir ceguera, ataxia, convulsiones, disminución de la propiocepción y presión de la cabeza, signos que, se relacionan con el consumo de alimentos en cerca de la mitad de los pacientes (Weisse y Berent, 2017).
Entre las técnicas de diagnóstico por imagen se encuentran la ecografía Doppler, la portovenografía, la angiografía por tomografía computarizada (CTA), la cintigrafía y la gammagrafía portal transesplénica (TSPS); sin embargo, aunque estas últimas técnicas son reconocidas por ser fiables para detectar derivaciones portosistémicas, requieren la sedación de los animales, equipos especializados y personal experto en la interpretación de las imágenes. Ante eso, se prefiere la ecografía Doppler, además de pruebas bioquímicas de función hepática (Devriendt et al., 2020).
En medicina veterinaria se ha reportado el tratamiento médico y quirúrgico de las derivaciones portosistémicas congénitas en perros, habiendo un consenso en que la mejor opción es el tratamiento quirúrgico; sin embargo, aún no se ha podido determinar si la mejor opción es el uso del anillo ameroide sobre las bandas de celofán (Serrano et al., 2019). El tratamiento médico en perros con derivaciones portosistémicas congénitas presenta una tasa de mortalidad del 48%, en comparación con 12% de mortalidad de los casos sintomáticos tratados quirúrgicamente, y de 5-7% tras la cirugía correctiva en perros asintomáticos. En las cirugías se aplica un anillo ameroide, el cual mediante la distensión del material higroscópico presente en su parte interna logra ocluir lentamente el vaso sanguíneo anómalo. También se han utilizado bandas de celofán, las cuales gracias a la respuesta aguda inflamatoria y la reacción tisular ocluyen lentamente el vaso sanguíneo anómalo (Radlinsky y Fossum, 2019). En este artículo se reporta el caso de una derivación portosistémica congénita en un canino tratada con éxito mediante una banda de celofán.
CASO CLÍNICO
Anamnesis y hallazgos clínicos
Se presenta a consulta un canino macho de raza Shih-Tzú de 9 meses y 4 kg de peso, remitido por una clínica de Tunja (Colombia), con diagnóstico presuntivo de derivación portosistémica extrahepática. La propietaria reporta que el paciente deambula por la noche, no descansa, vomita, apoya la cabeza contra las paredes y ha presentado convulsiones. En la evaluación física presentó deshidratación, taquicardia, taquipnea, sialorrea, desorientación, dolor abdominal y condición corporal 2.5/5.
Ayudas diagnósticas
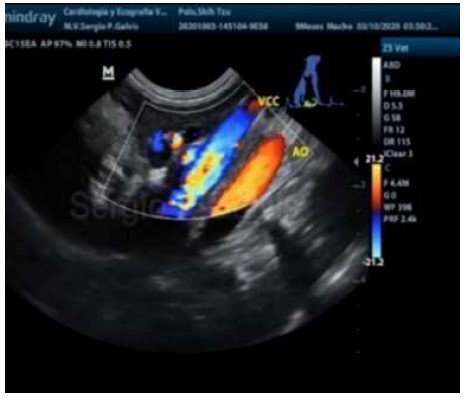
Se tomaron muestras de sangre para determinar amonio (NH3), ácidos biliares preprandial y posprandial con 4 h de diferencia, hemograma, perfil bioquímico hepático (alanina aminotransferasa [ALT], fosfatasa alcalina sérica) y muestra para urianálisis por cistocentesis. Asimismo, como imágenes diagnósticas se obtuvieron radiografías simples de abdomen (evidenciando presencia de materia fecal), y ecografía Doppler color (se identificó la comunicación entre la vena cava caudal y la vena porta) (Figura 1).
Tratamiento
Se inició tratamiento médico con 20 mg/ kg de Levetiracetam c/8 horas, 0.2 mg/kg de metoclopramida c/12 h y fluidoterapia con NaCl al 0.9%. Se programó para cirugía luego de recibir los resultados de laboratorio.
Se realizó laparotomía exploratoria, y con la ayuda de un separador de abdomen tipo Balfourt, se logró visualizar la comunicación anómala entre la vena porta y la vena cava caudal (Figura 2A). Una vez identificado el vaso sanguíneo, se ubicó una sonda uretral nelaton calibre # 6 paralelo al vaso sanguíneo anómalo para evitar la obliteración total de dicho vaso en el momento de instalar la banda de celofán, la cual se fijó con sutura no absorbible calibre 3-0, e inmediatamente después fue retirada la sonda uretral (Figura 2B). Una vez instalada la banda de celofán, se cerró el abdomen y se envió al paciente al área de recuperación.
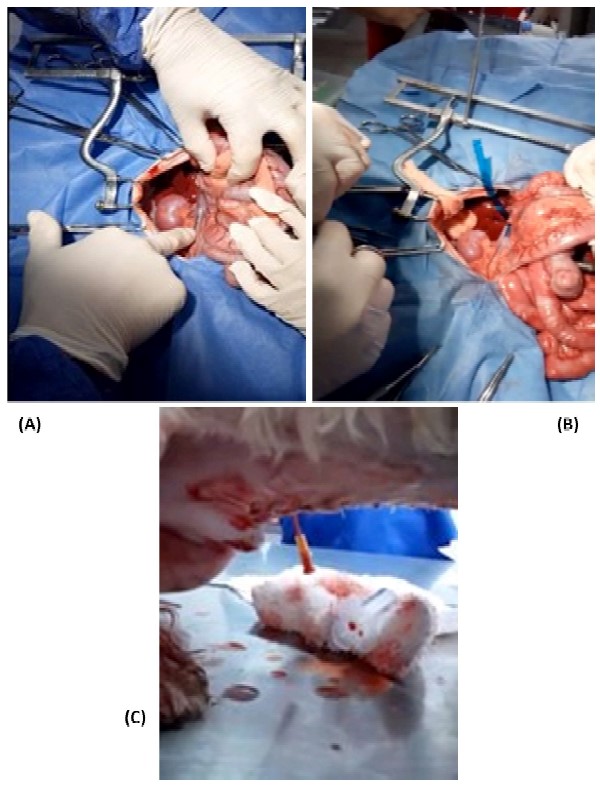
Figura 2 Intervención quirúrgica en un perro perro Shih-Tzú de 9 meses con derivación portosistémica extrahepática (Tunja, Colombia). A: Vaso sanguíneo anómalo comunicando vena cava-vena porta; (B): Banda de celofán rodeando el vaso sanguíneo anómalo; (C): Abdominocentesis con catéter calibre 14
Luego de 6 h del procedimiento quirúrgico se detecta efusión peritoneal a través de la incisión quirúrgica, la cual fue drenada mediante abdominocentesis con un catéter calibre 14 (Figura 2C). En el momento en que remite la secreción abdominal, el paciente es dado de alta con medicación en casa. Pasados 60 días de la cirugía se tomaron muestras de sangre para medición de amonio y ácidos biliares pre y posprandial, arrojando como resultado valores normales en sangre.
DISCUSIÓN
Los signos clínicos de derivación portosistémica son inespecíficos; sin embargo, el paciente presentó síntomas comunes de derivación extrahepática congénita en perros como vómito, baja condición corporal, convulsiones, presión de la cabeza y ausencia de ascitis (Watson, 2020). Aunque existen derivaciones extrahepáticas de diferentes morfología, incluidas vena porta a vena cava caudal, vena porta a vena ácigos, vena gástrica izquierda a vena cava caudal, vena esplénica a vena cava caudal, mesentérica craneal y mesentérica caudal a la vena cava caudal, los estudios sugieren que los pacientes que presentan derivaciones hacia la vena cava, sobre todo, los que se desarrollan caudales al hígado son más propensos a desarrollar signos clínicos de encefalopatía hepática (Kraun et al., 2014).
El diagnóstico de laboratorio en perros con derivaciones portosistémicas se basa en pruebas inespecíficas como la medición de proteína, colesterol, glucosa, tiempo de coagulación, y pruebas de función hepática como los niveles de amonio en ayunas, tolerancia al amonio posprandrial, medición de ácidos biliares posprandriales, la combinación de tolerancia al amonio con ácidos biliares en ayuno, medición de proteína C, y pruebas de metabolitos de fármacos; sin embargo, Bridger (2008) demostró que la medición de ácidos biliares postprandriales tienen una sensibilidad y especificidad de 100% para el diagnóstico de la enfermedad. El diagnóstico del presente caso se confirmó mediante ecografía Doppler color, en el cual se evidenció la comunicación vena porta hacia a la vena cava caudal; sin embrago existen otras opciones diagnósticas como radiografías contrastadas, tomografía computarizada, resonancia magnética, cintigrafía, ecografía con Doppler pulsado (Daniel, 2009). En animales es difícil evaluar los déficits cognitivos por la falta de pruebas neuropsicológicas, tal como se ha documentado en humanos (Or et al., 2017). También se presenta disminución del flujo sanguíneo en la corteza temporal y región subcortical, de allí que la hipoperfusión cerebral en perros con derivaciones portosistémicas puede ser demostrada con tomografía computarizada por emisión de fotones (Or et al., 2017).
Aunque se puede intentar el tratamiento médico, este sería solo paliativo, ya que el tratamiento definitivo es la oclusión progresiva del vaso sanguíneo anómalo. Además, la complejidad del procedimiento dependerá si el vaso sanguíneo anómalo es intra o extrahepático ((Bussadori et al., 2008). Para la intervención quirúrgica se dispone de técnicas que, aunque invasivas, han demostrado ser útiles para el tratamiento de derivaciones portosistémicas extrahepáticas, las cuales utilizan un constrictor ameroide o una banda de celofán (Bussadori et al., 2008). A pesar de que se ha reportado entre 18 a 35% de casos de persistencia de derivación portosistémica después de usar bandas de celofán, la utilización de este biomaterial ha sido aceptado como tratamiento de las derivaciones extrahepáticas en perros y gatos ((Bussadori et al., 2008). Si bien no se ha determinado el mecanismo por el cual inducen la oclusión del vaso sanguíneo anómalo, estudios realizados por espectrometría a diferentes tipos de plásticos comercializados como celofán, indican que esa respuesta inflamatoria sería generada por aditivos utilizados para su fabricación como el fosfato de dicetilo (Field et al., 2019). En el paciente no fueron detectados urolitos compuestos de biurato de amonio, a pesar de que, los machos con derivaciones portosistémicas que han recibido tratamiento médico previo, son más propensos a desarrollarlos (Caporali et al., 2015).












 uBio
uBio