INTRODUCCIÓN
La alpaca en su hábitat natural en el Altiplano peruano se reproduce entre los meses de diciembre y abril, época considerada como «época de lluvias»; no obstante, la alpaca no es considerada como una especie de reproducción estacional (Pollard et al., 1995), aunque diversos estudios indican que el fotoperiodo es un factor que interviene en aspectos reproductivos como la duración gestacional y el horario de los nacimientos (Vaughan y Tibary, 2006).
La glándula pineal es una glándula neuroendocrina impar ubicada en el epitálamo, directamente conectada con el tercer ventrículo. Se le considera como un órgano circunventricular, cuya función principal es la producción de la indolamina N-acetyl-5- methoxytryptamina, también llamada melatonina. Esta es la principal hormona neuroendocrina partícipe en la regulación del ritmo circadiano y que, además, provee información que regula los sus aspectos fisio- lógicos de determinadas especies llamadas «especies fotoperiódicas» (Prada, 2014; Tan et al., 2018).
Macroscópicamente, la forma y tamaño de la glándula pineal varía con la especie y la latitud (Celi, 2002; Tan et al., 2018), siendo en su mayoría en forma de arveja a cónica con un tamaño entre 5 a 8 mm de longitud y de 3 a 5 mm de ancho (Macchi y Bruce, 2004; Afroz et al., 2014; Roa y del Sol, 2014). La glándula ha sido caracterizada según su localización con respecto al cuerpo calloso como subcallosa, post callosa y supracallosa (Blin y Maurin, 1956), y por su posición con respecto al tercer ventrículo como tipo A, AB, ABC y subtipos (Vollrath, 1981).
Histológicamente, la glándula se encuentra rodeada de una cápsula de piamadre, de la cual se desprenden tabiques de tejido conectivo hacia el parénquima que se caracteriza por carecer de un patrón estructural, encontrándose de esta manera diversas agrupaciones celulares en forma de cordones, folículos o en roseta (Koshy y Vettivel, 2001; Junqueira y Carneiro, 2003; Güney et al., 2013; Roa y Del Sol, 2014). Esta glándula presenta abundante vascularización y algunas especies presentan un receso pineal y un receso suprapineal (Boya et al., 1995; Lewczuk y Przybylska, 2013, Pal et al., 2013). Los principales componentes celulares de la glándula pineal son los pinealocitos seguidos de las neuroglias, además de poder encontrase células pigmentadas y calcificaciones pineales.
El presente estudio morfológico tuvo como objetivo aportar una visión macro y microscópica de la glándula pineal de la alpaca (Vicugna pacos) adulta para su posterior aplicación en disciplinas afines como fisiología, reproducción y cirugía.
MATERIALES Y MÉTODOS
Se utilizaron 10 encéfalos de alpacas Huacaya (cinco hembras y cinco machos) de cuatro dientes (3-4 años) y boca llena (>4 años), obtenidas en septiembre de 2019 de alpacas de descarte beneficiadas en el Ca- mal Municipal de Huancavelica, Perú, situado a una altitud de 3660 msnm.
En las instalaciones del camal se extrajeron los encéfalos. Para esto, se realizó la disección de la piel y musculatura de la cabeza hasta la visualización de los huesos frontal, parietal, temporal y occipital, los cráneos fueron abiertos con sierra eléctrica para proceder a la descripción de la ubicación in-situ, forma y relación de la glándula con las estructuras adyacentes.
Las glándulas pineales fueron extraídas y fijadas en solución conservadora de formol tamponado al 4% y transportadas al Laboratorio de Anatomía Animal y Fauna Silvestre de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos, en Lima, Perú. Se midió el tamaño de cada glándula pineal (largo, ancho y espesor) usando la herramienta de medición del software del estereoscopio AmScope 5MP con cámara incorporada 5.1 MLJ500.
Para la evaluación microscópica, se prepararon cortes longitudinales y transversales de las glándulas, que fueron sometidas a técnicas histológicas, realizándose cortes de 5 µm de espesor y teñidos con Hematoxilina- Eosina y Tricrómico de Masson. Para la observación y descripción de la estructura histológica y las características de las células que la conforman se utilizó el microscopio Leica DM1000 LED con cámara incorpora- da ICC50W.
RESULTADOS
Evaluación Macroscópica
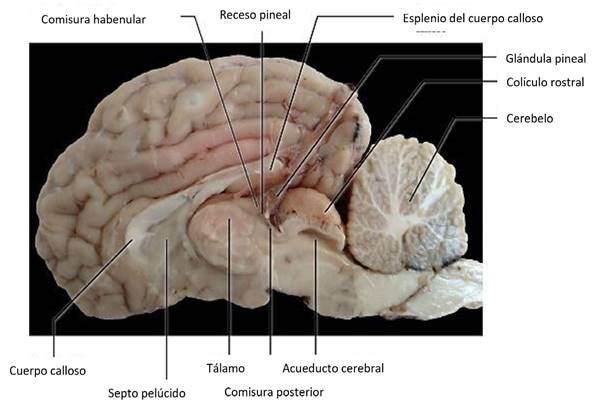
La glándula pineal de la alpaca Huacaya adulta es un órgano impar situado en el epitálamo, localizada en medio de los hemisferios cerebrales, cubierta y suspendida por la piamadre, en dirección dorso-caudal entre la comisura habenular y posterior (figuras 1- 3). Presenta una parte distal o ápice y una proximal o base fijada mediante fibras provenientes de la comisura habenular y que se encuentra en estrecho contacto con el tercer ventrículo, formando así el receso pineal (fi- guras 2 y 4). La superficie caudal de la glándula se encuentra en contacto con los colículos rostrales, mientras que la superficie craneal presenta en relación con el plexo coroideo formando un receso suprapineal.
La forma predominante de la glándula pineal fue la forma de cono de pino y en menor proporción, una forma de arveja (Figura 5). La coloración es mostaza claro a oscuro con ocasionales áreas de hiperpigmentaciones marrones.
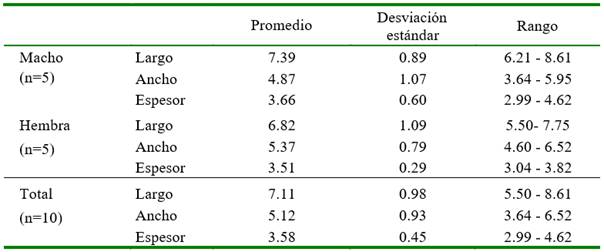
Las medidas de las 10 glándulas pineales en estudio se presentan en el Cuadro 1. Se observa que la glándula pineal es más larga y gruesa en los machos, pero menos ancha que en las hembras. Según los datos obtenidos, la glándula pineal puede ser clasificada como subcallosa y de tipo A o proximal.
Evaluación Microscópica
La glándula pineal se encuentra rodea- da por una cápsula de tejido conectivo la cual proyecta trabéculas con abundantes vasos sanguíneos que ingresan en el parénquima sin formar lobulaciones (Figura 6). Se presenció además una zona revestida por una capa de células ependimarias pseudoestratificadas ciliadas correspondiente al receso pineal. Estas células varían a cúbicas ciliadas en la superficie craneal pineal y van perdiendo los cilios a medida que continúan a lo largo de la cápsula (Figura 7).
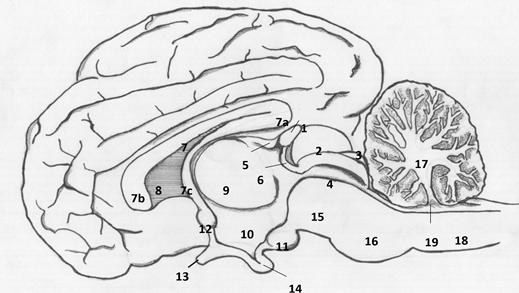
Figura 3 Representación esquemática del encéfalo de alpaca en corte mediano (vista medial). El bulbo olfatorio no se encuentra graficado. 1. Glándula pineal, 2. Colículo rostral, 3. Colículo caudal, 4. Acueducto cerebral, 5. Comisura habenular, 6. Comisura caudal, 7. Cuerpo calloso: 7a. Rodilla, 7b. Esplenio y 7c. Fórnix, 8. Septo pelúcido, 9. Tálamo, 10. Tercer ventrículo, 11. Cuerpo mamilar, 12. Comisura rostral, 13. Quiasma óptico, 14.Hipófisis, 15. Pedúnculo cerebral 16. Puente, 17. Cerebelo, 18. Médula espinal, 19. Cuarto ventrículo (Fuente: propia).
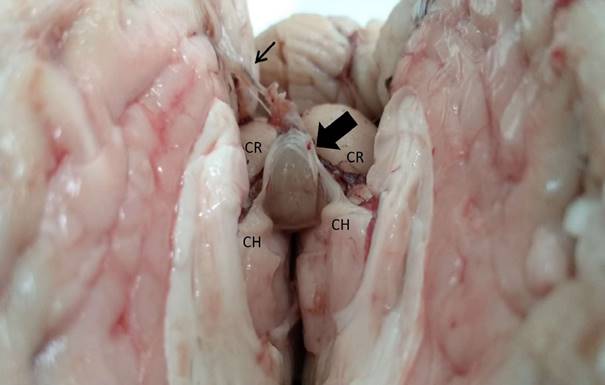
Figura 4 Glándula pineal de la alpaca vista desde rostral. La flecha gruesa indica las fibras provenientes de la comisura habenular (CH). La flecha delgada muestra la piamadre. CR: Colículo rostral
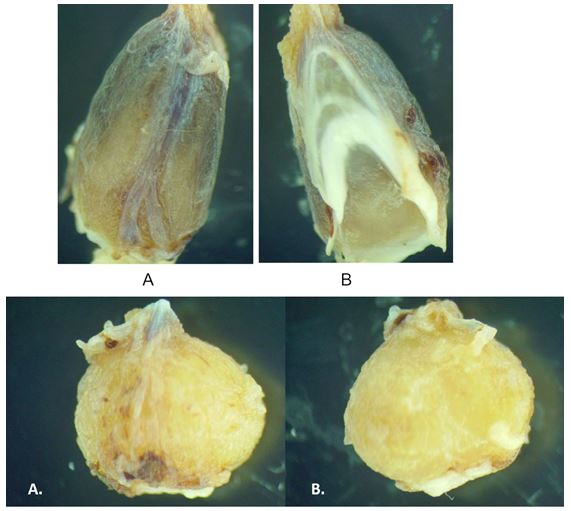
Figura 5 Glándula pineal de la alpaca. Forma de cono de pino (foto superior.). A. Vista aboral de la pineal, las flechas indican áreas de hiperpigmentación, B. Vista rostral de la pineal. Forma de arveja (foto inferior). A. Vista aboral de la pineal, B. Vista rostral de la pineal

Figura 6 Cápsula y parénquima de la glándula pineal de alpaca. Nótese la estrecha relación con el plexo coroideo (flechas). No se observa una diferenciación entre corteza y médula (H-E, 40X)
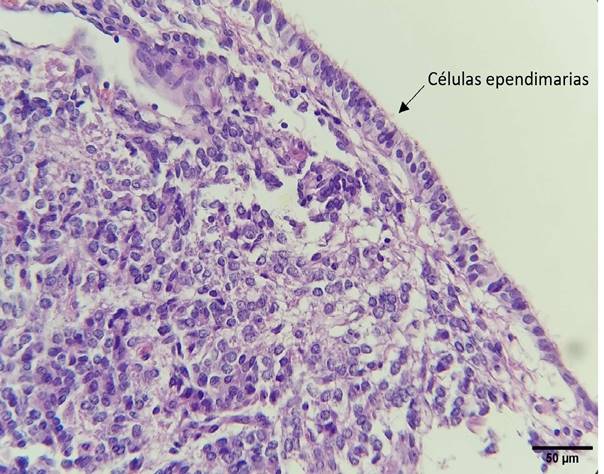
Figura 7 Células ependimarias en cápsula de la glándula pineal de alpaca (Tricromico de Masson, 400X)
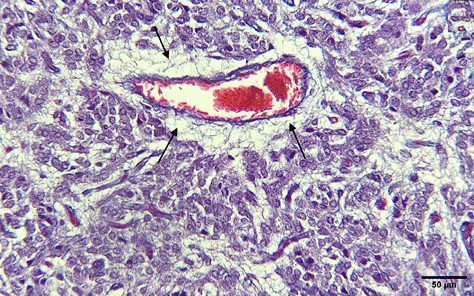
Figura 8 Presencia de prolongaciones citoplasmáticas perivasculares (flechas) en la glándula pineal de alpaca (Tricromico de Masson, 400X)
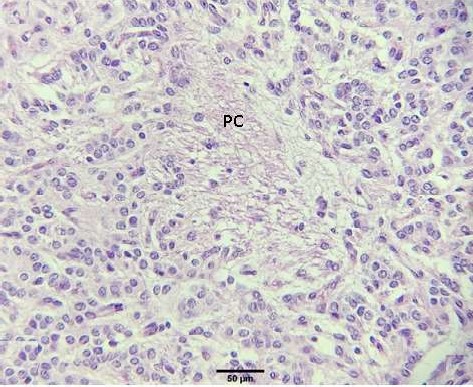
Figura 9 Presencia de proyecciones citoplasmáticas (PC) formando un estroma glandular en la glándula pineal de alpaca (H-E, 400X)

Figura 10 Pinealocitos. Presencia de patrón en cordones (flechas negras) y en rosetas (flechas rojas) en la glándula pineal de alpaca (H-E, 400X)
En el parénquima glandular no existe una clara diferenciación entre corteza y médula; no obstante, se observa una mayor concentración de vasos sanguíneos en la zona central, algunos de estos rodeados por abundante espacio perivascular.
Entre las células que componen a la glándula pineal, predominan los pinealocitos, los cuales a la tinción de hematoxilina y eosina presentan un citoplasma eosinófilo claro con limites no definidos de los cuales se emiten prolongaciones hacia sus semejantes, glías y espacio perivascular formando de esta forma un estroma glandular (Figuras 8-9). El núcleo es redondo a ovalado basófilo con apariencia granular con uno o más nucleolos. Estas células se distribuyen irregularmente a manera de cordones aleatorios y rosetas (Figura 10). En segundo lugar se encuentran las neuroglias, que se distribuyen entre los pinealocitos y con mayor frecuencia en los espacios perivasculares. A la tinción de H-E presentan citoplasma acidófilo con un núcleo alargado a triangular con la presencia de un nucleolo (Figuras 11-12). Además de las células principales se observó la presencia de estructuras acidófilas de formas indefinidas formando cavernas en el parénquima, correspondientes a calcificaciones pineales o corporea arenacea (Figura 13, estructura que fue identificada en una alpaca hembra de boca llena).
En el parénquima se hallaron también de manera aleatoria células con citoplasma acidófilo granular y núcleo redondo a ovalado basófilo conteniendo uno o más nucleolos, así como además pigmentos de coloración amarronada con una marcada disposición hacia las áreas perivasculares (Figuras 14-15).
DISCUSIÓN
Según los datos obtenidos, la localización de la glándula pineal de la alpaca Huacaya adulta concuerda con la encontrada en los humanos y ungulados previamente estudiados (Hasegawa et al., 1987; Abou- Easa et al., 2009; Carvalho et al., 2009; Nawal et al., 2012; Lewczuk y Przybylska, 2013; Beheiry y Moselhy, 2016). El receso pineal contemplado es semejante a lo descrito en otras especies; además, la relación que mantiene la superficie dorsal de la glándula con los plexos coroideos evidencia la presencia de un receso suprapineal similar a lo referido en humanos, ovinos y felinos (Boya et al., 1995; Lewczuk y Przybylska, 2013).

Figura 11 Presencia de neuroglias (flechas negras) en zona perivascular y proyecciones citoplasmáticas (flechas rojas) acidófilas en la glándula pineal de alpaca (H-E, 400X)
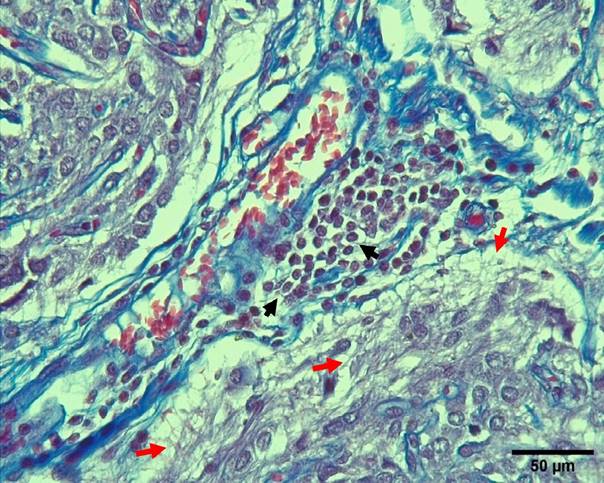
Figura 12 Presencia de neuroglias (flechas negras) en zona perivascular y proyecciones citoplasmáticas (flechas rojas) en la glándula pineal de alpaca (Tricromico de Masson, 400X)
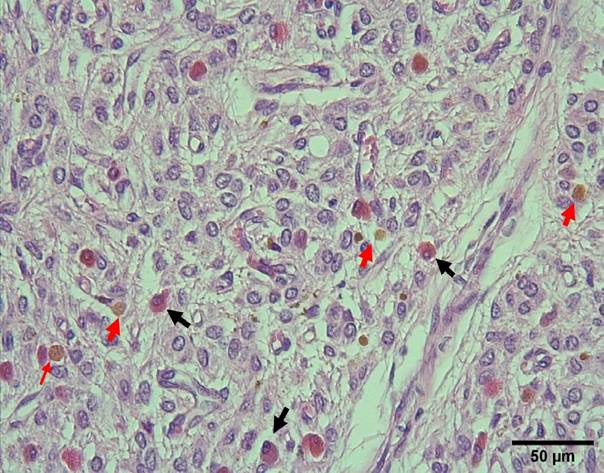
Figura 14 Presencia de células de citoplasma acidófilo granular (flechas negras) y pigmentos (flechas rojas) en la glándula pineal de alpaca (H-E, 400X)
En lo que respecta a la forma, esta presenta variaciones en las muestras evaluadas, pudiendo encontrarse principalmente la forma de cono de pino, similar a lo expuesto en los dromedarios (Nawal et al., 2012; Beheiry y Moselhy, 2016), bovinos (Phansuwan-Pujito et al., 1993; Lewczuk y Przybylska, 2013) y humanos (Macchi y Bruce, 2004; Afroz et al., 2014; Roa y Del Sol, 2014); sin embargo, en estas dos últimas especies se halló también la forma de arveja, similar a lo encontrado en este estudio y a lo descrito en búfalos (Abou- Easa et al., 2009; Carvalho et al., 2009) y ovinos (Tricoire et al., 2002; Lewczuk y Przybylska, 2013).
La coloración del órgano fue mostaza clara a oscura con zonas de hiperpigmentación marrón, semejante a lo descrito en búfalos (Carvalho et al., 2009) y difiriendo de dromedarios, los cuales presentan una pineal de tonalidad rojiza a marrón (Nawal et al., 2012). La glándula pineal del búfalo y de la alpaca adulta son muy similares; sin embargo, a diferencia del búfalo, la epífisis cerebral del búfalo presenta lobulaciones macroscópicas (Carvalho et al., 2009).
El tamaño de la glándula pineal fue de 7.15 ± 0.98 mm de largo y de 5.12 ± 0.92 mm de ancho, dimensiones similares a las descritas en humanos (5-8 x 3-5 mm) y en ovinos (4-8 mm de diámetro) y difieren de los búfalos, solo por la dimensión, y de los equinos porque en estos, la glándula es más grande y alargada, siendo la longitud el doble del ancho (Tricoire et al., 2002; Carvalho et al., 2009; Lewczuk y Przybylska, 2013; Roa y Del Sol, 2014).
En este estudio, las dimensiones largo y espesor de las glándulas pineales de los machos fueron mayores que en las hembras, mientras que el ancho fue superior en las hembras. Esto difiere a lo descrito por Hasegawa et al. (1987), quienes no encontraron diferencia entre las glándulas pineales de hombres y mujeres.
La clasificación de la glándula pineal adulta, siguiendo las pautas de Blin y Maurin (1956), es de posición subcallosa, similar a la encontrada en carnívoros y primates (Gomes et al., 2008), y es de tipo A, siguiendo los lineamientos propuestos por Vollrath (1981), dado que presenta un tallo pineal diferenciable que se encuentra conectado a la comisura posterior; además, no cumple con la pauta dada para la clasificación AB, la cual exige que la longitud de la glándula sea al menos el doble del ancho.
Microscópicamente, la cápsula pineal de la alpaca adulta está compuesta por tejido conectivo coincidiendo con lo hallado en otras especies animales anteriormente descritas. La cápsula también presenta tabiques o septos conteniendo abundantes vasos sanguíneos que se interiorizan en el parénquima glandular, mas no dividen el parénquima en lóbulos, difiriendo de esta forma a lo descrito en humanos (Junqueira y Carneiro, 2003) y búfalos (Carvalho et al., 2009), pero coincidiendo con lo hallado en ovinos (Dualde, 2003), perros y gatos (Calvo et al., 1988; Boya et al., 1995).
La abundante vascularización, tanto en los septos como en el parénquima, concuerda con lo hallado por Pal et al. (2013); no obstante, en cuanto a su disposición se halló una predominancia hacia el interior de la glándula coincidiendo con la especie ovina (Dualde, 2003). Los vasos sanguíneos se ven rodeados de espacio perivascular, como lo descrito en dromedarios por Beheiry y Moselhy (2016).
Una porción de la cápsula se encontró constituida principalmente por células ependimarias pseudoestratificadas ciliadas, correspondiendo al receso pineal, que a medida que continua a lo largo de la glándula van cambiando a células cúbicas ciliadas hasta perder los cilios, similar a lo descrito en el coatí por Favaron et al. (2008) y en el ovino por Dualde (2003).
Los pienalocitos, a la tinción de H-E, presentan un citoplasma eosinófilo claro, sin límites definidos, presentando prolongaciones los cuales se emiten hacia sus semejantes, glías y espacios perivasculares, similar a lo descrito en ovinos, humanos y dromedarios (Dualde, 2003; Macchi y Bruce, 2004; Pal et al., 2013; Nawal et al., 2012; Yu et al., 2016). En su interior presentan un núcleo redondo a ovalado basófilo de apariencia granular conteniendo de uno a más nucleolos (Junqueira y Carneiro, 2003; Kus et al., 2004; Abou- Easa et al., 2009; Carvalho et al., 2009; Beheiry y Moselhy, 2016). No se observa un patrón uniforme en la organización de estas células, empero, pudo identificar que los pinealocitos pueden disponerse en cordones y rosetas, similar a lo descrito por Güney et al. (2013) en el humano y por Dualde (2003) en el ovino.
Las neuroglias de la glándula pineal de la alpaca presentan una estructura celular similar a lo descrito en otros reportes (Abou- Easa et al., 2009; Nawal et al., 2012; Pal et al., 2013; Roa y Del Sol, 2014; Yu et al., 2016). Dichas células se encuentran distribuidas con mayor frecuencia en los espacios perivasculares y entre los pinealocitos, similar a lo descrito en los dromedarios (Beheiry y Moselhy, 2016) y humanos (Macchi y Bruce, 2004).
En el parénquima pineal, principalmente alrededor de los vasos sanguíneos, se observó la presencia de proyecciones citoplasmáticas a modo de estroma que a la tinción de H-E, son de afinidad acidófila, formando una membrana basal perivascular, similar a lo encontrado por Roa y Del Sol (2014) en los humanos. A pesar de estar principalmente en áreas perivasculares, se pudo observar también la organización de este estroma entre los pinealocitos sin estar asociado a algún vaso sanguíneo. No se observó distinción alguna entre edades o sexo, difiriendo a lo descrito por Dualde (2003) y Boya y Calvo (1984), quienes hallaron diferencias por edad.
En el presente estudio se hallaron pigmentos similares a lo encontrado en las vizcachas (Busolini et al., 2017) y los dromedarios (Abou-Easa et al., 2009; Nawal et al., 2012) en los que su localización fue predominantemente cerca de los vasos sanguíneos. También se encontraron células de citoplasma acidófilo granular y núcleo redondo a ovalado basófilo conteniendo uno a más nucleolos, distribuidas de manera aleatoria en el parénquima pineal. Estas células se asemejan a las encontradas por Abou-Easa et al. (2009) y Nawal et al. (2012) en dromedarios.
La calcificación pineal se evidenció en las alpacas, así como en humanos y búfalos (Abou-Easa et al., 2009; Carvalho et al., 2009; Tan et al., 2018). En este sentido, Carvalho et al. (2009) encontraron que las concreciones ocurrieron principalmente en la región caudal de la glándula pineal del búfalo, en tanto que en la alpaca no se halló predisposición alguna en el parénquima pineal.
CONCLUSIONES
Macroscópicamente, la glándula pineal de la alpaca no presenta lobulaciones y tiene una forma predominante de pino. El ancho de la glándula es mayor en las hembras, en tanto que en los machos son más largas y gruesas. Las glándulas se clasifican como Tipo A, mientras que por su posición anatómica se consideran como subcallosa. Asimismo, mantiene una estrecha relación con las estructuras adyacentes formando recesos como el pineal y suprapineal.
Microscópicamente, presenta una alta vascularización y carece de diferenciación entre corteza y médula. El parénquima contiene pigmentos y calcificaciones dispuestos irregularmente, presentando además un estroma glandular proveniente de proyecciones citoplasmáticas de los pinealocitos, que se disponen en forma de cordones y rosetas, y neuroglias, estos últimos se disponen mayormente en espacios perivasculares.












 uBio
uBio