INTRODUCCIÓN
Las variaciones en el medio ambiente son afrontadas por los bovinos mediante cambios en el comportamiento, consumo de nutrientes y respuestas fisiológicas (Arias et al., 2008; Sanin et al., 2016), las cuales son más pronunciadas a medida que el ganado se aleja de la denominada zona de confort térmico (Brody, 1956). Dependiendo de la raza, línea genética y nivel de producción, la zona de confort térmico para vacunos se encontraría dentro del rango de 10 a 20 °C (Nascimento et al., 2013; Sanin et al., 2016); sin embargo, para efectos de evaluación por encima o por debajo de la zona de confort, el índice temperatura-humedad (ITH) es el indicador más común para evaluar la magnitud del estrés por calor (Hernández et al., 2011). Por otro lado, Donnely (1984) construyó el índice de estrés por frío (ISF), considerando temperatura, velocidad del viento y precipitación, que sería más adecuado para evaluar el efecto de climas frígidos sobre la producción bovina (Bryant et al., 2007).
Otros factores físico-ambientales que afectan las constantes fisiológicas del gana- do son la altitud, presión atmosférica, luz ultravioleta y polvo. La humedad relativa acentúa las condiciones adversas de las altas temperaturas, estando asociadas a una reducción de la efectividad en la disipación de calor por sudoración y respiración (Arias et al., 2008). El viento ayuda a reducir los efectos de estrés por calor mejorando los procesos de disipación de calor por vías evaporativas, pero también incrementa los efectos de estrés por frío (Young, 1981), mientras que la radiación solar tiene fuerte impacto en la carga total de calor incrementando la temperatura rectal y la tasa de respiración (Arias et al., 2008).
Entre los principales cambios fisiológicos observados bajo condiciones de estrés por calor se encuentra el aumento en la tasa de respiración, frecuencia cardiaca, sudoración, temperatura superficial y vasodilatación (Martello, 2006). Adicionalmente, aspectos genéticos inherentes a la raza, así como características del pelaje y la piel, desarrollados como adaptación evolucionaria, son elementos importantes en los animales que interactúan de manera armónica con el ambiente, para mantener la temperatura corporal dentro de rangos normales (Esquivel, 2012), habiéndose reportado diferencias entre Bos taurus y Bos indicus (Da Silva et al., 2003; Landaeta-Hernández et al., 2011). Diversos autores han mostrado que la densidad y diámetro del pelo de vacunos guardan relación con las respuestas fisiológicas y pro- ductivas bajo condiciones de estrés térmico y de frío (Gilbert y Bailey, 1991; Olson et al., 2002; da Silva et al., 2003; Yoo, 2013; Maia et al., 2003; Bertipaglia et al., 2005, Esquivel, 2012; Da Cruz et al., 2016).
Si bien existe bastante información acerca del efecto medioambiental, bajo condiciones alejadas de la zona de confort; sin embargo, se dispone de escasa evidencia de las relaciones existentes entre las variaciones ambientales reducidas y las respuestas fisiológicas del ganado. Así, el objetivo del presente trabajo fue conocer los efectos que las variaciones de la temperatura y humedad dentro de un rango reducido sobre algunos signos vitales y características de pelaje en vaquillas Holstein y criollas, criadas en condiciones semi extensivas en zona de altitud.
MATERIALES Y MÉTODOS
El estudio se realizó entre octubre de 2017 y marzo de 2018 en un establo de vacunos de la Universidad Nacional Autónoma de Chota (UNACH), ubicada en Cajamarca, Perú. Para la evaluación de características de pelaje se trabajó con diez vaquillas de 14 a 18 meses de edad (4 Holstein y 6 criollas); sin embargo, el monitoreo de signos vitales solo se realizó en 8 vaquillas (4 Holstein y 4 criollas). Los animales se encontraban al pastoreo sobre Lolium perenne y Trifolium pratense. Las evaluaciones de los pelos se realizaron en un ambiente acondicionado de la Vicepresidencia de Investigación de la UNACH.
Se determinó la densidad de los pelos mediante el dispositivo FIBER DENTM (Natural Fiber´s Tech SAC) y lo signos vitales se registraron con un monitor llevable MOSIVILLe (Maxcorp Technologies SAC), siendo estos la frecuencia cardiaca (FC), frecuencia respiratoria (FR) y temperatura de piel (T°P). Paralelamente mediante un termómetro de bulbo de mercurio se registró la temperatura rectal (T°R). Con los datos de temperatura se calculó la gradiente entre T°R y T°P (gradiente T°R-TP). Además, el grosor de los pelos se determinó con el caracterizador electrónico de fibras y pelos FIBER EC (Maxcorp Technologies SAC) utilizándose muestras de 2 g de pelo. La temperatura ambiental (T°A) y humedad relativa (H°R) fueron monitorizadas en una estación meteorológica portátil de precisión (Oregon Sientific, modelo WMR 300) con el fin de determinar el índice temperatura-humedad (ITH), mediante la fórmula recomen- dada por Dikmen y Hansen (2009).
Los registros se realizaron durante cuatro días intercalados en tres momentos por día: a) Mañana (09:00-11:00) caracterizada por una T°A de 17.98±0.61 y una H°R de 66.50±1.04; b) Tarde (14:00-16:00) con 20.41±0.61°C y 57.75±1.04% de T°A y H°R, respectivamente, y c) Noche (18:00-20:00) con T°A de 14.62±0.75 °C y 66.50±1.27% de H°R.
El monitoreo de los signos vitales se realizó de acuerdo con el procedimiento seguido por Quispe et al. (2019), para lo cual se rasuró un área aproximada de 6 x 6 cm en tres lugares del perímetro toráxico, a fin de colocar los electrodos de gel con una banda elástica donde también se adhirió el dispositivo MOSIVILLe mediante broches metálicos. La ubicación de los tres electrodos se referenció acorde a la derivada base-ápice modificado (B-Am), ubicándose el electrodo positivo a nivel del séptimo espacio intercostal en la unión costo condral del lado izquierdo del animal y el electrodo negativo en la unión costo vertebral izquierdo a nivel de la sexta vértebra torácica, mientras que el ultimo electrodo (que sirvió para filtrar «artefactos» de movimiento y ruidos) se colocó en el lado derecho al mismo nivel que el electrodo negativo. El registro de las señales se inició 10 s después del encendido del instrumento. Se hicieron tres registros de tres minutos con intervalos de un minuto. Los datos fueron almacenados en la memoria interna del dispositivo y luego fue- ron trasladados a una computadora portátil para los análisis respectivos.
La determinación de la densidad de pelaje se realizó según el procedimiento señala- do por E. Quispe y M. Quispe (2019), rasurando áreas de 5x5cm en el anca y costillar medio. Mediante el dispositivo FIBER DEN se capturaron 5 imágenes de 1 mm2 por zona por animal y las imágenes fueron procesadas mediante un software incorporado al propio equipo FIBER DEN, que permitió el recuento de la cantidad de pelos a fin de obtener la densidad de pelo/mm2 (MDenP) y su respectiva desviación estándar (DEMDenP).
Para la determinación de la media de diámetro del pelo (MDP) y la desviación estándar de la MDP (DEMDP) de cada muestra de pelo obtenido previamente, se obtuvieron fragmentos de pelos de 0.8 mm de longitud mediante un cortador de fibras que se colocaron en un porta muestras del equipo FIBER EC. Las mediciones se realizaron de acuerdo con el procedimiento indicado por Quispe et al. (2017).
Se determinaron las diferencias de los valores de FC, FR, T°P de la mañana (M) y de la noche (N), abreviados como FC:M-N, FR:M-N y T°P:M-N, respectivamente; así como diferencias de la N y de la M de T°R y la gradiente T°R-T°P (T°R:N-M y T°P:N- M, respectivamente.
Los datos fueron procesados haciendo uso de estadística descriptiva e inferencia. Se calcularon promedios, desviación y error estándar, valores mínimos y máximos, mientras que para comparar variaciones entre diferentes variables se determinó el coeficiente de variación (CV=Promedio/desviación estándar*100). Para evaluar el efecto de los factores sobre la FC, FR, T°R, T°P y T°R- T°P se utilizó un modelo aditivo lineal con dos factores (raza y periodo) y con dos covariables (T°A y H°R), mientras que evaluar el efecto de la raza sobre los cambios de los signos vitales durante el día y las características de pelaje, se utilizó un modelo aditivo lineal con una variable. La prueba de Duncan fue utilizada para las comparaciones múltiples.
Para la evaluación de las relaciones entre las variables en estudio se determinó las correlaciones de Pearson. Luego se seleccionaron las variables correlacionadas con diferencia significativa y se realizaron los correspondientes análisis de regresión que posteriormente fueron graficadas. Todos los procesos estadísticos fueron realizados mediante el software libre R v. 3.1.1 (R Core Team, 2016).
RESULTADOS
Condiciones medioambientales, constantes fisiológicas, y características de pelaje
En el Cuadro 1 se muestran las mediciones de los signos vitales, sus cambios entre la mañana y la noche y las características de los pelos de las vaquillas en estudio. La FR presentó la mayor variación durante el día (CV=36.9%), seguido de la gradiente T°R- T°P (CV=20.9%), mientras que la tempera- tura rectal y de piel fueron las más estables (CV=0.8 y 4.4%, respectivamente). Se observó una marcada diferencia entre T°R (38.8°C) y T°P (31.6 °C). La alta variación de la gradiente T°R-T°P se debe a la gran variación que tiene la T°P.
Si bien se presentan variaciones de las constantes fisiológicas vitales durante el día, estas se encuentran dentro de los parámetros normales correspondientes a vaquillas en buenas condiciones de salud. Las condiciones medioambientales no fueron extremas. Los rangos de T°A, H°R e ITH fueron de 12.0 y 21.1 °C, 55.0 y 69.5%, y 54.6 y 68.3, respectivamente.
Los signos vitales registrados durante el día presentan un CV alrededor del 50%, con promedios ± error estándar (EE) de 10.4±1.8 rpm y 2.6±0.6 lpm, respectivamente para FR:M-N y FC:M-N, mientras que la T°R:M-N y T°P:M-N exhiben promedios menores a 1.9 °C, con errores estándar de 0.11 y 0.35, respectivamente.
El grosor del pelo (MDP) y la densidad de pelos (MDenP) fue de 40.6±1.49 y 11.3±0.51, encontrándose animales con pe- los de grosor regular (cerca de 31 µm) y muy gruesos (alrededor de 50 µm). También, se encontró que la variación de la MDP dentro y entre animales difieren marcadamente, con desviaciones estándar de 17.9 y 4.7 µm, respectivamente, que revela marcadas variaciones de los diámetros de pelo dentro de las muestras de cada animal, pero que entre animales la MDP no variaría mucho. De otro lado, al evaluar la MDenP se encontró que las variaciones dentro y entre animales son muy similares, con desviaciones estándar de 1.5 y 1.6 fibras/mm2, respectivamente.
Raza y momento del día sobre las constan- tes fisiológicas y las características del pelo
El efecto de los factores raza y momento del día, y de las covariables T°A y H°R sobre la frecuencia cardiaca y respiratoria, temperatura rectal y de piel y la gradiente T°R-T°P, se puede observar en los Cuadros 2 y 3. La raza no tuvo efecto sobre los variables en estudio; sin embargo, el momento del día y la T°A tuvieron efecto sobre la T°R, T°P, FR y gradiente T°R-T°P, en tanto que la H°R tuvo efecto solo sobre la T°P y la gradiente T°R-T°P. No se encontró evidencia del efecto del momento del día sobre la FC. Por otro lado, la FR registrada durante la tarde y noche (23.1±6.7 y 18.6±5.8 °C) son menores al de la mañana (29.0±5.8 °C), mientras que la T°R y la T°P durante la mañana es mayor al de la noche, pero la gradiente T°R-T°P en la noche es mayor al de la mañana y tarde.
Los valores de los signos vitales de las vaquillas Holstein tuvieron una aparente mayor variación entre momentos del muestreo (con excepción del FR:M-N); sin embargo, las diferencias no fueron significativas y, por lo tanto, no se encontró evidencia del efecto de la raza sobre los cambios en los signos vitales. Por otro lado, las vaquillas criollas presentaron un diámetro de pelo más fino que las Holstein (38.13±1.39 vs. 42.61±1.37 µm, respectivamente), aunque sin diferencia estadística entre DEMDP, MDenP y DEDenP.
Relación entre las condiciones ambienta- les y los signos vitales
Las correlaciones entre signos vitales y condiciones ambientales se presentan en el Cuadro 4 y la Figura 1, habiéndose encontrado relaciones moderada, directa y significativa de la frecuencia respiratoria con la temperatura de piel, la frecuencia cardiaca, la temperatura ambiental y el diámetro de pelo, así como entre la frecuencia respiratoria y la temperatura ambiental (r=0.56). Asimismo, se encontró relaciones inversas y significativas entre la temperatura rectal y la humedad relativa ambiental (r=-0.52), así como la gradiente T°R-T°A con la temperatura de piel y la frecuencia respiratoria (r = -0.99 y -0.43).
Cuadro 1 Estadísticos de condiciones ambientales, signos vitales y características del pelaje de vaquillas lecheras criadas al pastoreo en Cajamarca, Perú
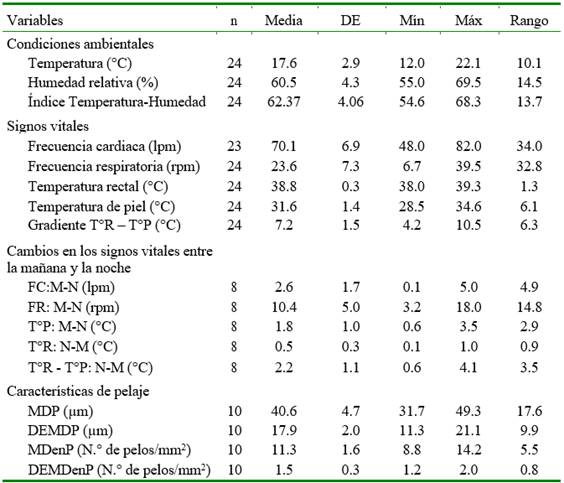
lpm: latidos por minuto; rpm: respiraciones por minuto; Gradiente T°R-T°P: Diferencia entre la temperatura rectal y la temperatura de piel; T°R-T°P: N-M: Diferencia de las gradientes de temperatura rectal y de piel, de los periodos noche y mañana; FC:M-N: Diferencia de la frecuencia cardiaca entre la mañana y la noche; FR:M-N: Diferencia de la frecuencia respiratoria entre la mañana y noche; T°P:M-N: Diferencia de la temperatura de piel entre la mañana y la noche; T°R:N-M: Diferencia de la temperatura rectal entre la noche y la mañana. MDP: Media del diámetro de pelo. DEMDP: Desviación estándar de la MDP: MDenP: Media de la densidad de pelos; DEMDenP: Desviación estándar de la MDenP
Cuadro 2 Efecto de la raza, periodos, temperatura (T°A) y humedad ambiental (H°R) sobre los signos vitales de vaquillas lecheras criadas al pastoreo en Cajamarca, Perú
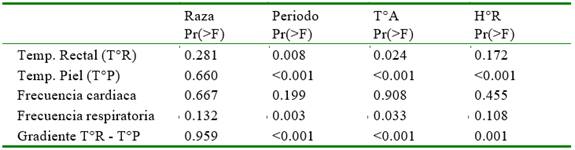
Los resultados indican que a mayor temperatura de piel corresponde una mayor frecuencia respiratoria y cardiaca, a mayor T°A corresponde mayor frecuencia cardiaca, respiratoria y temperatura rectal, a mayor humedad ambiental corresponde menor temperatura rectal y al incrementarse la gradiente T°R-T°A se disminuye la temperatura de piel y la frecuencia respiratoria. Asimismo, se observó que un incremento del diámetro de pelo conlleva a un incremento de la frecuencia cardiaca, pero a una disminución de la media de densidad de pelo.
Al analizar las correlaciones significativas (Cuadro 4) mediante regresiones lineales se encontró el coeficiente de determinación es menor a 0.31, con excepción de la relación entre MDP y la frecuencia respiratoria, donde el modelo explica más del 50% de la relación entre dichas variables (r2=0.57), reafirmándose que a mayor diámetro de pelo resultan mayores frecuencias respiratorias; sin embargo, otras correlaciones son bajas y sin importancia biológica.
Las relaciones entre los cambios de los signos vitales durante el día y las características del pelaje se muestran en el Cuadro 5. El cambio T°R:M-N tiene una relación directa y significativa con el diámetro de pelo (r=0.87) pero inversa y significativa con la MDenP (r = -0.92), mientras que la T°R-T°P: N-M tiene una relación directa y significativa con el T°P:M-N. Asimismo al análisis de estas relaciones mediante regresión lineal simple se encontró que por cada incremento en una micra del diámetro de pelo se incrementa la gradiente T°R-T°P en 0.05±0.1 °C (p=0.01), pero contrariamente disminuye en 0.18±0.04 °C (p-valor<0.01) por cada incremento en la densidad de pelo. Los modelos de regresión lineal simple explican las relaciones anteriormente mencionadas, pues los coeficientes de determinación son mayores a 0.75 (Figura 1).
DISCUSIÓN
El trabajo se desarrolló bajo condiciones ambientales dentro de la zona de confort del ganado bovino, basado en los estudios de Nascimento et al. (2013) y Sanin et al. (2016), quienes indican que temperaturas ambientales de confort están en el rango de 10 a 20 °C; asimismo, el NRC (1971) y Hernández et al. (2011) indican que con un THI >75 las vacas disminuyen la producción de leche y el consumo de alimento, pero que con un THI <74 los animales se encuentran en estado de confort. Asimismo, los valores de los signos vitales encontrados se ubican dentro de los rangos normales de animales en buenas condiciones de salud, (FC: 60-80 lpm, FR: 16-80 rpm, T°R y T°P: alrededor de 38.5 y 32.7 °C, respectivamente, con una gradiente de T°R-T°P en torno a 8.35 °C (Martello, 2006; Araujo et al., 2016; Da Cruz et al., 2016). Sin embargo, las ligeras variaciones de los signos vitales ocurridos durante el día serían como respuesta del organismo animal a las variaciones ambientales (Arias et al., 2008), pero también podría deberse a las actividades físicas y manipulación de los animales (NRC, 1971; Sanin et al., 2016), aunque esto último podría descartarse, ya que el registro de los signos vitales se realizó con un monitor de signos vitales llevable que no interfería con las actividades normales de los animales (Quispe et al., 2019).
Cuadro 3. Efecto de la raza y periodos sobre signos vitales y características de pelaje en vaquillas criadas al pastoreo en Cajamarca, Perú (media ± DE)
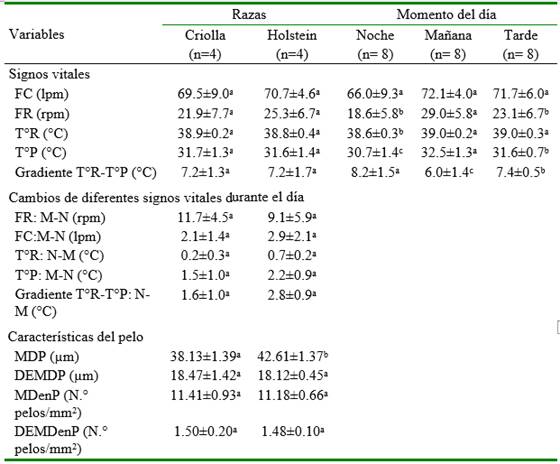
a,b,c Promedios con diferentes superíndices indican diferencias estadísticas dentro de cada fila por factor (p<0.05) FC: Frecuencia cardiaca; lpm: latidos por minuto; FR; Frecuencia respiratoria; rpm: respiraciones por minuto; T°R: Temperatura rectal; T°P: Temperatura de la piel; Gradiente T°R-T°P: Diferencia entre la T°R y T°P; T°R-T°P: N-M: Diferencia de las gradientes de temperatura rectal y de piel de la noche y mañana; FC:M-N: Diferencia de la frecuencia cardiaca entre la mañana y la noche; FR:M-N: Diferencia de la frecuencia respiratoria entre la mañana y noche; T°P:M-N: Diferencia de la temperatura de piel entre la mañana y noche; T°R:N-M: Diferencia de la temperatura rectal entre la noche y la mañana; MDP: Media del diámetro de pelo; DEMDP: Desviación estándar de la MDP: MDenP: Media de la densidad de pelos; DEMDenP: Desviación estándar de la MDenP
Cuadro 4 Correlaciones de Pearson (r) - en la parte superior de la diagonal - y grado de significancia (p-valor) - en la parte inferior de la diagonal - entre constantes fisiológicas, características del pelo y condiciones ambientales de vaquillas criadas al pastoreo en Cajamarca, Perú
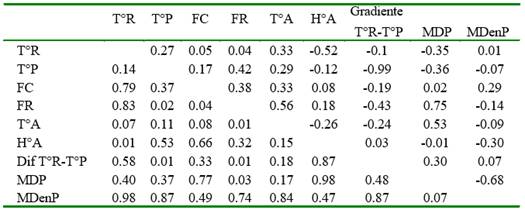
T°R=temperatura rectal; T°P=temperatura de piel; FC: frecuencia cardiaca; FR: frecuencia respiratoria; T°A: temperatura ambiental; H°A: humedad relativa ambiental; Dif T°P- T°R: Diferencia entre la temperatura rectal y la temperatura de piel; MDP: Media de diámetro de pelo; MDenP: Media de densidad de pelo/mm2
La media del de diámetro de pelo obtenido se encuentra dentro de los rangos reportados para ganado Holstein por Gebremedhin et al. (1984), Gilbert y Bailey (1991) y Yoo (2013); sin embargo, son menores a los reportados por Maia et al. (2003), Hillman et al. (2005) y Bertipaglia et al. (2005), quienes obtuvieron MDP mayores a 60 µm, quienes trabajaron con vacas adultas, lo cual es un factor para considerar (Maia et al., 2003).
La densidad de pelos (11.3±0.51 pelos/ mm2) fue similar a lo reportado por Maia et al. (2003) que obtuvieron 11.21 pelos/mm2 en vacas Holstein, aunque ligeramente inferior a los obtenidos por Cena y Monteith (1975) y Da Cruz et al. (2016), quien reportaron densidades de 12.6 pelos/mm2 en Holstein x Gyr y 13.2 pelos/mm2 en terneros de capa roja y blanca, respectivamente. Densidades menores fueron reportadas por Bertipaglia et al. (2005) y Hillman et al. (2005) con valores entre 9.9 y 7.5 pelos/mm2 en vacas Holstein y Charolais, respectivamente; diferencias que podrían deberse a la metodología para la obtención de la densidad de pelo, edad, raza y genotipo de los animales entre otros factores (Maia et al., 2003; Landaeta-Hernández et al., 2011; Yoo, 2013).
El efecto del momento del día, temperatura ambiental y humedad relativa sobre la temperatura rectal, temperatura de piel, frecuencia respiratoria y gradiente T°R-T°P en un medio ambiente de confort se encuentra poco documentado. No obstante, se reconoce que la temperatura ambiental y la humedad relativa afectan en forma directa y proporcional los signos vitales en vacunos de carne y leche (Collier et al., 2006; Bryant et al., 2007; Leyva-Corona et al., 2015), donde los animales pueden disipar el exceso de temperatura dependiendo de la temperatura ambiental presente (Sanin et al., 2016), la cual se acentúa ante una mayor humedad relativa bajo condiciones de estrés térmico (Arias et al., 2008), razón por la cual se desarrolló el índice temperatura-humedad como indicador para evaluar la magnitud de estrés por calor (Dikmen y Hansen, 2009; Hernández et al., 2011).
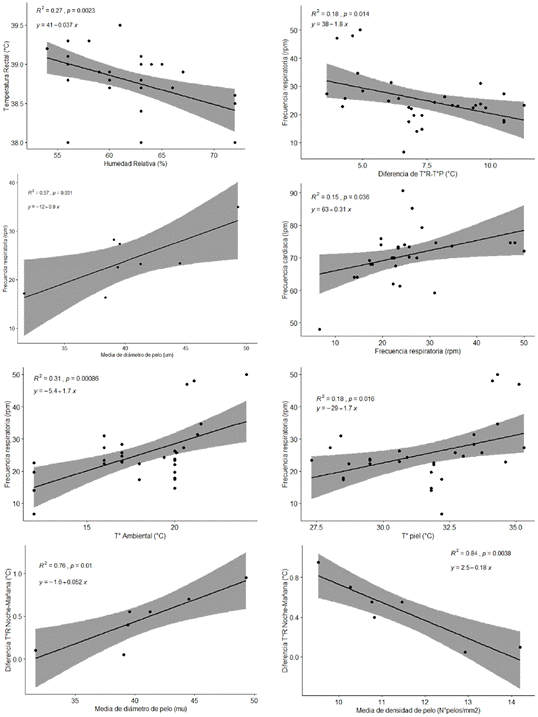
Figura 1 Ploteo de signos vitales, condiciones medioambientales, incluyendo línea de ajuste de regresión con intervalo de confianza. Se presentan las ecuaciones de regresión, coeficientes de determinación y p-valor. Solo se presentan las correlaciones significativas del Cuadro 5
Cuadro 5 Correlaciones de Pearson, intervalos de confianza y p-valor entre los cambios de signos vitales y entre estos con las características del pelo en 8 vaquillas criadas al pastoreo en Cajamarca, Perú
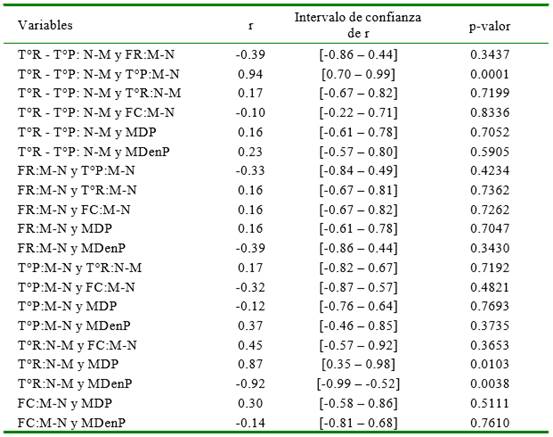
T°R-T°P:N-M: Diferencia de las gradientes de la temperatura rectal y de piel entre los periodos noche y mañana; FR:M-N: Diferencia de la frecuencia respiratoria entre los periodos de la mañana y noche; FC:M-N: Diferencia de la frecuencia cardiaca entre los periodos de la mañana y noche T°P:M-N: Diferencia de la temperatura de piel entre la mañana y noche; T°R:N-M: Diferencia de la temperatura rectal entre la noche y la mañana; MDP: Media de diámetro de pelo; MDenP: Media de la densidad de pelo/mm2
El efecto encontrado del cambio de la T°A (entre 12 y 22°C) sobre la T°R contra- dice lo indicado por Spiers (2011), quien refiere que la temperatura corporal de muchos animales domésticos adultos no responde a los cambios en la temperatura ambiental por debajo de 25 °C y por encima de 10-15 °C. Sin embargo, esto se debería a que los cambios de la temperatura corporal están en función a la masa corporal, donde los terneros son más sensibles, pero en el presente estudio se utilizaron vaquillas. Es así que los resultados obtenidos sobre la T°R son concordantes con otros realizados en vacunos adultos (Amakiri y Funsho, 1979; Silanikove, 2000; Olson et al., 2002; McManus et al., 2009) quienes demostraron que la T°A por encima de los 24°C tiene efecto sobre la T°R.
Los reducidos efectos del cambio medioambiental sobre la FR concuerdan con otros autores (Eigenberg et al., 2000; Gaughan et al., 2000; Arias et al., 2008) quienes indican que la FR es la respuesta fisiológica más resaltante por ser una vía de pérdida de calor importante bajo un amplio rango de condiciones medioambientales, No obstan- te, puede ser influenciado por la edad, genotipo, momento de la alimentación y condición corporal entre otros factores (Collier et al., 2006).
El efecto de la T°A sobre la T°P con- cuerda con otros reportes (Mota, 1997; Martello, 2006; Collier et al., 2006; Sanin et al., 2016, Yadav et al. 2017), quienes indican que la temperatura de la superficie de la piel se encuentra influenciada por la temperatura ambiental, pero también por la radiación infrarroja, velocidad del viento y capacidad de sudoración. En función a los resultados obtenidos, se podría indicar que la T°P resultaría un buen indicador para evaluar los efectos de estrés por calor en los animales, con la ventaja frente a la T°R de que no se necesita el contacto con el animal y no provoca estrés (Yadav et al., 2017).
Aunque se conoce el factor racial en la reacción a los cambios medioambientales no se encontraron diferencias entre las vaquillas criollas y Holstein sobre los signos vitales; lo cual se debería al reducido rango de cambio de las condiciones ambientales y a la limitada cantidad de animales utilizados en el estudio.
La evidencia encontrada que las vaquillas Holstein tienen el pelo más grueso que las criollas se debería al lugar de origen de la raza Holstein (en temperaturas bajas), motivo por el cual desarrollaron pelajes largos y gruesos como mecanismo de aislamiento térmico (Young et al., 1981; Sanin et al., 2016). De otro lado, si bien hay diferencias entre razas con respecto a la densidad de los pelos (Da Silva et al., 2003; Landaeta- Hernández et al., 2011), no hubo diferencias en el presente estudio, lo cual pudo deberse a la reducida variación de las condiciones medioambientales.
Evidencias de relación entre algunos signos vitales con T°A, H°A y características de pelaje han sido reportadas por diversos investigadores (Eigenberg et al., 2000; Collier et al., 2006; Da Cruz et al., 2016), aunque bajo condiciones climáticas de calor y frío más extremas que los del presente estudio. La correlación positiva entre T°A y FR (r=0.56) es similar a las correlaciones entre 0.42 a 0.51 en novillos cruzados (Murray Grey x Hereford y Hereford x Angus x Simmental) reportado por Gaughan et al. (2000). Asimismo, el coeficiente de regresión (1.7 rpm por cada in- cremento de 1 °C de T°A, Figura 1) es similar al reportado por Eigenberg et al. (2000), pero menor al reportado por Gaughan et al. (2000) y Collier et al. (2006), quienes halla ron mayores incrementos de FC por cada grado de incremento de T°A, pero trabajan- do bajo variaciones de T°A entre 24 y 36°C.
Bajo condiciones de estrés térmico, la humedad relativa acentúa la dificultad de pérdida de energía del organismo animal, conllevando a un incremento de la T°R, por lo que existe una relación directa de la T°R con la humedad relativa (Amakiri y Funsho, 1979; Collier et al., 2006; Arias et al., 2008); as- pecto que el presente resultado fue contradictorio, posiblemente debido a la inexistencia de estrés térmico durante el desarrollo del experimento y a la reducida variación de la H°R.
Los cambios de los signos vitales (T°R, T°P, FC, FR y gradiente T°R-T°P) observa- dos entre periodos de la mañana y noche, parecen ser paralelos a las variaciones de la temperatura del aire en condiciones ambientales controladas (Brody, 1956; Amakiri y Funsho, 1979), confirmando que es necesario considerar cambios diurnos en el uso de la temperatura rectal y frecuencia cardiaca para propósito de diagnóstico clínico en ambientes tropicales húmedos, más que considerar solo los valores medios diarios. Sin embargo, estos cambios podrían ser atenuados por las características de pelaje, ya que los mayores cambios de T°R están relacionado directamente con el diámetro de pelo e inversamente con la densidad del pelaje.
CONCLUSIONES
Aún bajo los reducidos cambios de las condiciones medioambientales del estudio, se encontraron efectos significativos de la hora del día, temperatura ambiental y humedad relativa sobre la temperatura rectal, temperatura de piel, frecuencia respiratoria y gradiente temperatura rectal - temperatura de piel; sin embargo, estos cambios pueden ser aminorados cuando el pelaje es menos grueso pero más denso. Asimismo, la frecuencia cardiaca es el signo vital que se mantiene constante ante los cambios ambientales dentro de la zona de confort.












 uBio
uBio 

