INTRODUCCIÓN
El cuy (Cavia porcellus) contribuye a la seguridad alimentaria de la región andina, donde es considerado una fuente proteica rica en vitamina B, ácido linoleico y linolénico, y con bajo contenido de grasas saturadas y colesterol (Lammers et al., 2009; Avilés et al., 2014; Lucas et al., 2018). La crianza y consumo de cuyes en el Perú se ha ido incrementando a través de los años, destacando como el mayor productor y exportador de carne de esta especie (MINAGRI, 2019). La mayor población de cuyes se encuentra en la región andina, especialmente en los departamentos de Cajamarca y Cusco con 2.4 y 1.7 millones de cuyes, respectivamente (INEI, 2012).
En granjas tecnificadas y con elevada densidad poblacional se favorece el intercambio de microbiota comensal y patógena, lo que explica la rápida diseminación de agentes infecciosos, de allí que a menudo requieren el uso de terapia antibiótica (Landers et al., 2012). Sin embargo, el uso de estos fármacos de forma indiscriminada, ya sea de forma terapéutica, preventiva o como promotores de crecimiento, contribuye en la emergente crisis que supone la resistencia a los antibióticos y que amenaza la salud mundial, la seguridad alimentaria y el desarrollo (Landers et al., 2012; WHO, 2020).
Según el «Manual de Buenas Prácticas Pecuarias en la Crianza Comercial de Cuyes» (MINAGRI, 2010), los tratamientos se deben realizar únicamente con autorización de un médico veterinario. Dentro de la gama de antibióticos utilizados en cuyes se encuentra la enrofloxacina (ENR) para el tratamiento de salmonelosis, enfermedad con alta tasa de mortalidad en cuyes (Matsuura et al., 2010). La ENR es una fluoroquinolona de segunda generación considerada como uno de los antimicrobianos sintéticos más exitosos debido a que actúa directamente sobre el ADN bacteriano, posee un amplio espectro antimicrobiano, una buena absorción oral y un bajo coste (Sharma et al., 2009). Sin embargo, su uso rutinario y poco controlado en cuyes ha conducido a la aparición de cepas resistentes a este antibiótico (Salvatierra et al., 2018). Asimismo, la administración de quinolonas en animales como el cuy puede dar lugar a concentraciones de residuos de estos productos en las carnes y vísceras destinadas a consumo humano, los cuales pueden generar reacciones de hipersensibilidad en el hombre, alterar su microbiota, y favorecer el desarrollo de resistencia bacteriana a los antibióticos, entre otros problemas de salud (Kyuchukova, 2020).
En el Perú son escasos los estudios que evalúan la presencia de residuos de antibióticos en carnes destinadas a consumo. No obstante, se ha determinado residuos de ENR en carne de cuy en los departamentos de Lima, Tacna y Cajamarca (SENASA, 2018). Asimismo, en hígados de cuyes en la provincia de Jauja, se reportan concentraciones de 1.11 a 35.1 µg/kg (Leyva-Molina et al., 2020). Sin embargo, la normativa vigente no especifica los límites máximos de residuos (LMR) de la ENR en carne de cuy, pero establece un LMR para la carne de pollo, porcinos, rumiantes y peces de 100 µg/kg (MINSA, 2016). Asimismo, la Unión Euro- pea aplica un LMR de 100 µg/kg para el músculo y grasa de todas las especies destinadas a producción de alimentos (Comisión Europea, 2009) y Canadá (Health Canada, 2021) considera este mismo valor en carne, piel o grasa de cerdo.
Por otro lado, tampoco se ha determinado el periodo que permite que los residuos de la ERN presentes en la carne del cuy estén en una concentración menor o igual a este LMR, lapso denominado como tiempo de re- tiro. Esto es importante pues si se controla el cumplimiento del tiempo de retiro, se confiere una protección a la salud del consumidor. Por tanto, el presente estudio tuvo como objetivo determinar el periodo de retiro de la ENR en el cuy para el consumo seguro de su carne.
MATERIALES Y MÉTODOS
Lugar de Estudio y Animales
El estudio fue realizado en el Fundo San Marcos del Centro de Investigación IVITA, sede Maranganí, perteneciente a la Facultad de Medicina Veterinaria (FMV) de la Universidad Nacional Mayor de San Marcos (UNMSM). El fundo se encuentra ubicado en la provincia de Canchis, región Cusco, Perú. Asimismo, el procesamiento de las muestras se realizó en el Laboratorio de Salud Pública y Salud Ambiental de la FMV- UNMSM, Lima.
Se trabajó durante 10 días con 51 cuyes (26 machos y 25 hembras) de la raza Perú, con pesos entre 650 y 800 g. Los animales fueron distribuidos en dos corrales de 13 cuyes machos cada uno y dos corrales de 12 y 13 cuyes hembras, respectivamente. Todos los animales fueron mantenidos bajo las mismas condiciones de manejo y alimentación. La dieta fue ofrecida ad libitum y estuvo compuesta de concentrado y forraje de alfalfa (Medicago sativa), chala de maíz (Zea mays) y Ray grass (Lolium perenne).
Diseño Experimental
Los cuyes fueron dosificados con una presentación comercial de ENR al 10% (Laboratorio Cuvita, Perú), vía oral, con ayuda de un gotero, y a una dosis de 10 mg/kg/día (0.1 ml/kg PV) cada 24 horas por 10 días; es decir, el doble del tiempo recomendado de administración para esta especie con el afán de simular su uso indiscriminado. La última dosis oral de ENR fue considerada como tiempo cero (0) horas. Tres cuyes, seleccionados en forma aleatoria, fueron sacrificados cada dos horas, iniciando a las 0 horas y terminan- do a las 32 horas. Se tomaron muestras del diafragma según lo descrito por Leyva-Molina et al. (2020), se colocaron en bolsas de polietileno de primer uso y se almacenaron en congelación (-20 °C) hasta el momento de su análisis en el laboratorio.
Análisis de Laboratorio
Las muestras fueron descongeladas, llevadas a temperatura ambiente (20-25 °C), y se eliminó la grasa excesiva. Se tomó 1 g del músculo, el cual se trituró y homogenizó en un mortero. Los niveles de ENR fueron de- terminados mediante el Max Signal® Enrofloxacin ELISA Kit siguiendo las indicaciones del fabricante. Este kit presenta un límite de detección de 1 µg/kg, un límite de cuantificación de 2.5 µg/kg y utiliza estándares que van del 0.1-5 µg/kg (Biooscientific, 2007). Las densidades ópticas de las muestras se determinaron mediante el lector de absorbancia BioTek ELx800 a una longitud de onda de 450 nm.
Se determinaron las concentraciones de ENR de las muestras siguiendo las pautas descritas por Biooscientific (2007). Las concentraciones de ENR de las muestras se pre- sentaron en un gráfico de dispersión y en función de la absorbancia relativa y el tiempo de evaluación. Asimismo, la parte descendiente de la curva de concentración de ENR se representó en función de las horas, usando el programa GraphPad Prism 7.0 (USA). El tiempo de retiro se determinó considerando el LMR de referencia de 100 µg/kg (MINSA, 2016) y las directrices del FDA (2018). Las concentraciones medias de ENR se expresaron en µg/kg ± desviación estándar.
RESULTADOS
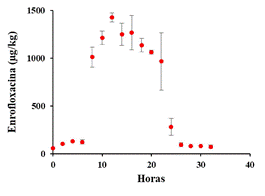
Las concentraciones de ENR incrementaron durante las primeras 12 horas, con va- lores promedio de 61.3 ± 3.9 µg/kg y 1211.2 ± 388.4 µg/kg a las 0 y 10 horas, respectiva- mente. El pico de concentración máxima se observó a las 12 horas del retiro del antibiótico (1425 ± 48.1 µg/kg).
A las 24 h posterior al retiro de la ENR, la concentración muscular de este metabolito fue de 280.7 ± 89 µg/kg, y a las 26 horas de 95.6 ± 21.5 µg/kg, valor que en promedio está por debajo del límite de referencia (100 µg/ kg). Posteriormente, las concentraciones del metabolito se fueron reduciendo hasta llegar a 74.8 ± 9.1 µg/kg a las 32 horas tras el retiro de la ENR. Las concentraciones de ENR más bajas se detectaron tanto a las 0 como a las 32 horas (Figura 1).
DISCUSIÓN
Se determinó que la concentración máxima de ENR se presentó a las 12 horas posteriores a la última administración del antibiótico, a diferencia de otros estudios que describen tiempos entre 0.5 a 6 horas para la aparición del pico máximo de concentración plasmática de ENR en animales de producción (Otero et al., 2001; Paschoal et al., 2013; Atef et al., 2020). Sin embargo, los valores en plasma suelen diferir respecto a los de tejido, especialmente en fármacos muy liposolubles como la ENR que accederán más lentamente a órganos como el músculo, comparado con otros órganos de mayor irrigación (Armijo, 1997). Es probable que el mayor tiempo empleado por los cuyes sea una respuesta propia de esta especie. Asimismo, este hallazgo podría estar relacionado con la alimentación ad libitum que recibieron los cuyes, pues se ha descrito que la interacción de las quinolonas con los alimentos puede prolongar el tiempo necesario para alcanzar la concentración plasmática máxima, pero sin alterar significativamente su biodisponibilidad (Sharma et al., 2009).
Además del mayor tiempo requerido, la concentración máxima alcanzada (1425 ± 48.1 µg/kg) fue inferior a la detectada en otras especies. Por ejemplo, usando la misma dosis, vía y frecuencia de administración, Paschoal et al. (2013) y Atef et al. (2020) describieron valores superiores de concentraciones máximas de ENR en cachama blanca (Piaractus mesopotamicus) (2736 µg/kg) y en pollos (3800 µg/kg), respectivamente. Usando la misma dosis, pero aplicado vía IM durante 3 días se describieron valores de 7947 µg/kg en pollos (San Martin et al., 2007), mientras que Xu et al. (2006) con dosis de 50 mg/kg durante 7 días en tilapias del Nilo (Oreochromis niloticus) y camarones chi- nos (Penaeus chinensis) obtuvieron concentraciones máximas de 3610 ± 1020 µg/kg y 1680 ± 410 µg/kg, respectivamente.
Además de factores relacionados a la respuesta especifica de la especie, la dosis (Liu et al., 2021), la vía de administración (Otero et al., 2001) e incluso las presentaciones comerciales de ENR (Ahmad et al., 2020) podrían producir diferencias en la concentración máxima alcanzada. Asimismo, el método de detección es un factor que también podría explicar las diferencias obtenidas al comparar con los resultados de otros estudios.
La cromatografía de alta precisión acoplada a espectrometría de masas (HPLC- MS) es una técnica considerada como referencia para identificar y cuantificar residuos antimicrobianos en alimentos. Sin embargo, su implementación es costosa en reactivos y equipos, consume mucho tiempo, además re- quiere de personal capacitado y con experiencia (Toldrá y Reig, 2006; San Martín et al., 2007; Cháfer-Pericás et al., 2010). Ramatla et al. (2017) demostraron una correlación significativa entre el nivel de detección de la prueba de ELISA y HPLC, indicando que las pruebas de ELISA pueden mostrar niveles de concentración de ENR diferentes a los obtenidos por HPLC debido a su reactividad cruzada con la cipro-floxacina. De hecho, el kit utilizado en el presente trabajo presenta una especificidad del 100% a ENR y una reacción cruzada con ciprofloxacina del 100% (Biooscientific, 2007). Sin embargo, la ciprofloxacina es el principal metabolito de la ENR tras ser metabolizada en el hígado, y por ello, diversas normas, incluida la peruana, establecen un LMR en conjunto para la suma de ENR y de ciprofloxacina (Comisión Europea 2009; MINSA, 2016; CFR, 2020).
Bajo las condiciones del presente estudio y basado en los resultados observados, el valor promedio (95.6 ± 21.5 µg/kg) de la concentración de ENR a las 26 horas se halla por debajo del LMR de referencia. En este periodo (26 h), los valores obtenidos estuvieron entre 74.8 µg/kg a 117.7 µg/kg, siendo así que a las 28 horas (80.8 ± 6 µg/kg) ninguna muestra superó el LMR. Sin embargo, el FDA (2018) recomienda que si el periodo de retiro calculado es una fracción de día se debe establecer como periodo el día siguiente brin- dando así un mayor grado de protección al consumidor. Por tanto, se sugiere que el periodo de retiro en cuyes puede ser redondea- do a dos días. En el pollo y en especies acuícolas se han establecido periodos de re tiro entre 6 y 45 días (Xu et al., 2006; San Martin et al., 2007, 2009; Paschoal et al., 2013; Phu et al., 2015). Estas diferencias estarían relacionadas a la fisiología de la especie ya que se ha descrito que los roedores presentan un alto metabolismo hepático en comparación a aves y peces (Mitchell, 2006). Sin embargo, se requieren estudios complementarios que permitan confirmar esta hipó- tesis.
CONCLUSIONES
El máximo nivel de concentración de la enrofloxacina se encontró a las 12 horas del retiro del fármaco en cuyes luego de una administración oral de 10 mg/kg/día (0.1 ml/kg PV) cada 24 horas por 10 días.
Se sugiere un tiempo de retiro de la enrofloxacina de 2 días para la aptitud de la carne de cuy.












 uBio
uBio