INTRODUCCIÓN
El uso de anestésicos en la acuicultura es esencial para facilitar el manejo de los peces y reducir los factores que generan estrés, el cual afecta potencialmente la supervivencia, el crecimiento y la reproducción (de Souza et al., 2012; Romaneli et al., 2018). Estos fármacos se utilizan en prácticas de investigación, actividades productivas, trans- porte, análisis patológico, vacunación, manejo reproductivo y eutanasia, entre otros usos (Ross y Ross, 2008; Noga, 2010; de Souza et al., 2012; Uehara et al., 2018).
Los anestésicos en acuicultura se administran generalmente por baños de inmersión y en menor medida, por vía inyectable en peces de alto valor comercial. Dentro de los más utilizados se encuentran el aceite de clavo (eugenol), etomidato, quinaldine y tricaína (MS-222) (Coyle et al., 2004; Ross y Ross, 2008; Neiffer y Stamper, 2009; Priborsky y Velisek, 2018). MS-222 es el único aprobado por la Food and Drug Administ- ration (FDA) para uso en peces destinados a consumo humano en Estados Unidos (FDA, 2006; Priborsky y Velisek, 2018), mientras que propofol, lidocaína e isofluorano, entre otros, han sido únicamente evaluados en forma experimental en varias especies.
Las características ideales de los agentes anestésicos se basan en que la droga debe ser de fácil administración, lograr una inducción rápida, preferiblemente en menos de tres minutos y sin que produzca efectos adversos en los peces (Roubach y Gomes, 2001; Ross y Ross, 2008). Además, debe poder mantenerse a los animales en el estado de sedación elegido, proporcionando una inmovilización adecuada y una analgesia eficaz. Asimismo, la recuperación debe ser rápida y completa en un tiempo inferior a 10 minutos, sin signos de ataxia prolongada u otras características indeseables (Coyle et al., 2004; Priborsky y Velisek, 2018).
La mojarra Cheirodon interruptus se incluye en la familia Characidae. Es una especie de pequeño tamaño que no supera los 6 cm y que presenta una amplia distribución en ambientes lénticos y lóticos de Argentina, Uruguay y Brasil, y ha sido introducida en Chile (Malabarba, 2003; Teixeira de Mello et al., 2014). En Argentina, debido a su marcada demanda como pez cebo para la intensa actividad de pesca deportiva de pejerrey Odontesthes bonariensis, se ha incrementado su captura en numerosos ecosistemas pampeanos (Mancini y Grosman, 2008). Esto conlleva una gran explotación de poblaciones silvestres y el transporte de peces a lar- gas distancias, lo cual ha motivado en los últimos años la realización de experiencias de cultivo. Cheirodon interruptus es una especie tolerante a la manipulación y de rápida adaptación y su producción bajo condiciones de cultivo disminuye la presión de extracción de las poblaciones y evita alterar los ambientes naturales; además, esta mojarra es sencilla de mantener en acuarios, lo cual posibilita su utilización para bioensayos (Ferriz et al., 2011; Teixeira de Mello et al., 2014; Prieto et al., 2017; García, 2018).
Los estudios sobre uso de anestésicos en C. interruptus son casi nulos. Se dispone de algunos antecedentes en la familia Characidae con aceite de clavo (eugenol) y propofol, los cuales han demostrado ser eficaces y seguros para determinadas especies (Silva et al., 2009; Ostrensky et al., 2016; Fernandes et al., 2017; Uehara et al., 2018; Oliveira et al., 2019). Por su parte, isoflurano y lidocaína no presentan estudios previos que verifiquen su eficacia anestésica en carácidos. Ante esto, el objetivo del presente estudio fue evaluar cuatro anestésicos (eugenol, lidocaína, isoflurano y propofol), como alter- nativa para facilitar el manejo de C. interruptus, determinando la eficacia anestésica y la seguridad de los fármacos.
MATERIALES Y MÉTODOS
Peces
Se utilizaron 78 ejemplares adultos de C. interruptus de ambos sexos. Los peces fueron alojados para su aclimatación en el Laboratorio de Farmacología de la Universidad Nacional de Río Cuarto, Argentina, en dos peceras de vidrio de 80 L cada una, pro- vistas de equipos de filtrado y con aireación permanente. Todos los peces fueron sometidos a un ayuno de 24 horas previo a las experiencias.
Para la medición de las características del agua se utilizaron equipos multiparamétricos digitales (pHmetro - conductimétro Milwaukee MI 806 y oxímetro Hanna HI 98103). Los valores de temperatura, pH, oxígeno disuelto y conductividad del agua fue- ron 18.03 ±2.1 °C, 6.87 ±0.18, 6.73 ±0.05 mg L-1 y 3.74 ±4 µS cm. Agua con estas características se utilizó, además, para la preparación del anestésico y para evaluar las res- puestas fisiológicas de los peces.
Agentes Anestésicos
Los agentes anestésicos utilizados en los baños de inmersión fueron eugenol (Lab. Dickinson, Argentina), propofol (Lab. Abbott, Argentina), isofluorano (Lab. Richmond, Argentina) y lidocaína clorhidrato (Denver Farma, Argentina). Las dosis empleadas se presentan en el Cuadro 1.
Propofol e isofluorano se adicionaron di- rectamente en el agua, agitando para fa- vorecer la dispersión de ambos.
Lidocaína: Se agregó al agua bicarbonato de sodio (1 g/l) en forma previa para mejorar la calidad de la anestesia (Ross y Ross, 2008; Ackerman et al., 2005).
- Eugenol: Este fármaco posee escasa solubilidad en agua, por lo que fue disuelto previamente en etanol en una relación de 1:9 (eugenol:etanol). Se estableció una dosis de 50 mg/l como control para los estudios estadísticos, al ser la dosis recomendada para la familia Characidae (Oliveira et al., 2019).
Diseño Experimental
Los peces fueron asignados al azar a seis grupos experimentales (13 por grupo). La evaluación del efecto anestésico se realizó de manera individual para facilitar la observación de las diferentes fases de la anestesia. El tiempo fue medido mediante un cronómetro de precisión. Los peces luego de la recuperación permanecieron en observación durante 72 horas.
Las evaluaciones se hicieron en contenedores de 10 L de capacidad. Los peces fueron colocados, previo al ingreso al contenedor con el anestésico, en un recipiente con agua libre de fármaco para evaluar su conducta natatoria y registrar la frecuencia respiratoria basal (FR basal). Luego se les introdujo en el contenedor evaluándose los tiempos en alcanzar las distintas etapas propuestas por Coyle et al. (2004) y Treves-Brown (2000) (ver Cuadro 2). Se consideró el tiempo en alcanzar las siguientes fases: I) Del ingreso hasta presentar una disminución leve de sus movimientos corporales y la pérdida parcial del equilibrio; II) adopción de una posición lateral en el fondo de contenedor con reacción a estímulos y III) el pez permanece en el fondo del contenedor, sin movimientos y sin reacción a estímulos táctiles.
Se determinó la frecuencia respiratoria en anestesia (FR) luego de alcanzada la fase Luego, los peces fueron retirados del con- tenedor para registrar su peso (balanza digital con precisión de 0.1 g) y longitud total (ictiómetro graduado en mm). Luego se trasladaron al contenedor con agua sin fármaco, donde se determinó el tiempo de recuperación (los peces recuperan la posición vertical y la natación normal).
Análisis Estadístico
En los análisis estadísticos se utilizó el programa Prisma GraphPad 8.0 (Software GraphPad). Según lo expuesto por Martins et al. (2018), inicialmente se determinó si los datos siguieron una distribución Gaussiana, tantos los datos biométricos (peso y longitud) y fisiológicos (frecuencia respiratoria basal y en anestesia) como los tiempos de las fases de anestesia y de recuperación. Para la normalidad se usó la prueba de normalidad D’Agostino-Pearson y posteriormente se aplicaron pruebas paramétricas o no paramétricas, según correspondan.
Se utilizó el análisis de varianza (p<0.05) de una vía, seguida por la prueba de Dunnett’s para la múltiple comparación con el grupo control (E50) con los datos obtenidos de los tratamientos anestésicos, excepto para la frecuencia respiratoria basal y con anestesia en el mismo tratamiento, para evaluar la acción del anestésico sobre la respiración. Se utilizó la prueba no paramétrica de Kruskal-Wallis (p>0.05), seguida de la prueba de Dunn de comparaciones múltiples para comparar el efecto de los protocolos de anestesia. Todos los datos en los gráficos se presentan como promedio (± SD).
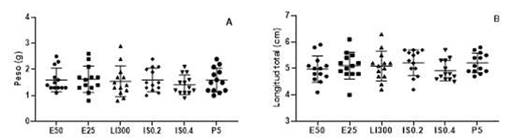
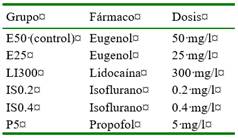
Figura 1 Peso (A) y longitud total (B) de los ejemplares de C. interruptus sometidos a baños anestésicos de Eugenol 50 mg/l (E50), eugenol 25 mg/l (E25), lidocaína 300 mg/l (LI300), isofluorano 0.2 mg/l (IS0.2), isofluorano 0.4 mg/l (IS0.4) y propofol 5 mg/l (P5). Cada punto representa un animal (n=13). Sin diferencias significativas (p>0.05)
RESULTADOS
Todos los peces expuestos a los anestésicos lograron una anestesia quirúrgica (Fase III) y no se registraron muertes durante las experiencias o hasta las 72 horas de la anestesia. Tampoco se observaron conductas anormales durante la inducción o recuperación, a excepción del grupo con lidocaína, donde se observó excitación con comporta- miento errático, caracterizado por natación acelerada en forma circular, antes de alcanzar la fase II.
No hubo diferencia significativa en los datos biométricos de los peces al inicio del estudio (Figura 1), siendo el peso promedio de 1.6±0.4 g y la longitud total de 5.1±0.4 cm. Las fases anestésicas (I, II y III) y de recuperación se observan en la Figura 2. La frecuencia respiratoria basal y en anestesia se presenta en la Figura 3.
En Fase I (Figura 2C), se observa que E50, IS0.2 (p<0.05) y P5 (p<0.001) demandan mayor tiempo para producir la sedación de los peces, mientras que en el caso de IS0.4 (p<0.001), el tiempo es significativamente menor. No hubo diferencias significativas en E25 y LI300. En Fase II (Fig. 2D), los tiempos de los tratamientos E25, IS02 y P5 fueron significativamente mayores en comparación con los animales del grupo con- trol p<0.001), con excepción de IS0.4 (p<0.05) que registra una disminución significativa en el tiempo de anestesia. En Fase III (Figura 2E), todos los peces alcanzaron la anestesia quirúrgica independientemente del anestésico y la dosis. Los tiempos de E25, IS0.2, LI300 y P5 (p<0.001) fueron significativamente mayores, mientras que IS.04 (p<0.05) mantuvo la tendencia a una respuesta a menor tiempo de lograr el plano anestésico. La recuperación (Fig. 2F) tomó más tiempo en los peces expuestos a P5 (p<0.001), seguido a la distancia por LI300, ISO.2 e ISO.4 (p<0.05).
La frecuencia respiratoria basal no pre- sentó diferencias entre grupos (Figura 3); sin embargo, la frecuencia respiratoria durante la anestesia se vio afectada en los peces de los grupos IS0.4 (p<0.001) y P5 (p<0.05), disminuyendo significativamente en relación con la basal.
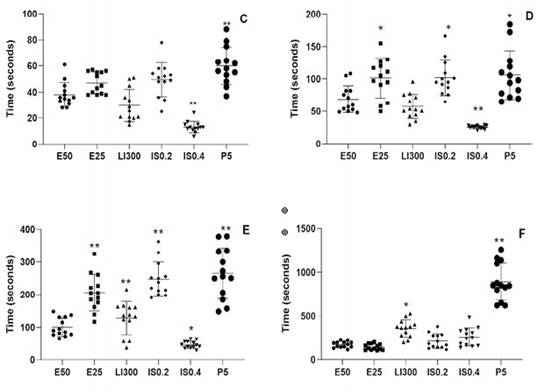
Figura 2 Tiempos de anestesia y recuperación de C. interruptus según fase, anestésico y dosis. C) Tiempo de Fase I (sedación); D) Tiempo de Fase II (anestesia); E) tiempo de Fase III (anestesia quirúrgica); F) Tiempo de recuperación de los anestésicos: eugenol 50 mg/l (E50), eugenol 25 mg/l (E25), lidocaína 300 mg/l (LI300), isofluorano 0.2 mg/l (IS0.2), isofluorano 0.4 mg/l (IS0.4) y propofol 5 mg/l (P5). Cada punto representa un animal (n=13). Los datos se expresan como pro- medio en comparación al grupo E50. * (p<0.05); ** (p<0.001)
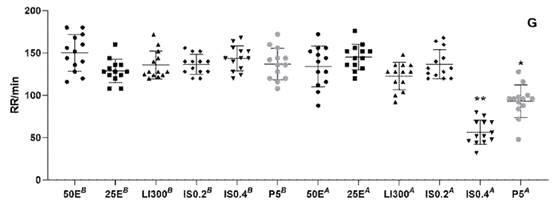
Figura 3 Frecuencia respiratoria (FR) de C. interruptus como respuesta a diferentes anestésicos o dosis. (B) basal y (A) en anestesia. Eugenol 50 mg/l (E50), eugenol 25 mg/l (E25), lidocaína 300 mg/l (LI300), isofluorano 0.2 mg/l (IS0.2), isofluorano 0.4 mg/l (IS0.4) y propofol 5 mg/l (P5). Cada punto representa un animal (n=13). Los datos se expresan como promedio en comparación al grupo E50. * (p<0.05); ** (p<0.001)
DISCUSIÓN
Los tiempos de repuesta a los anestésicos en Fases I y II fueron similares a los expuestos en Oligosarcus argenteus y Astyanax altiparanae (Silva et al., 2009; Uehara et al., 2018), pero en C. interruptus se reporta una disminución del tiempo para lograr la Fase III y la recuperación, que pue- de deberse a la propia tasa metabólica de la especie, la temperatura del agua y el tamaño de los peces, factores que generan variabilidad a la respuesta al anestésico (Coyle et al., 2004; Noga, 2010). Por otro lado, Hyphessobrycon sp y Hemigrammus sp, con la misma dosis de eugenol (50 mg/l) registran un tiempo de inducción de la anestesia (Fase III) más corto de 13 s, pero mayor tiempo de recuperación al de C. interruptus de 6 min. Estas diferencias, si bien son peces de la misma familia, las diferencias pueden explicarse en función que son criados en distintas condiciones ambientales (Fernandes et al., 2017).
Los peces expuestos a eugenol (E25) con relación al grupo control (E50) registran aumentos significativos (p<0.001) en los tiempos de Fase II y III de anestesia, similar a lo expuesto por Oligosarcus argenteus (Uehara et al., 2018), lo cual es consistente con el mayor tiempo que se necesita en alcanzar la anestesia a menor dosis del fármaco (Silva et al., 2009). Por otro lado, en Hyphessobrycon sp y Hemigrammus sp, peces que pertenecen a la misma familia de C. interruptus, se determinó la dosis letal de 200 mg/l, mientras que dosis tolerables fue- ron de 100 mg/l (Fernandes et al., 2017).
Los animales del grupo LI300 no mostraron diferencias significativas con el grupo control con relación a los tiempos de las fases I y II, mientras que en la fase III registraron un aumento significativo (p<0.001), con un tiempo similar al reportado en el pez cebra (Danio rerio) con igual dosis (Collymore et al., 2014). La recuperación de C. interruptus expuesta a LI300 fue <6 min, tiempo mayor a los otros anestésicos en estudio, excepto de P50. Sin embargo, es conocido que existe un margen de seguridad razonable entre las dosis anestésicas y letales de lidocaína (Noga, 2010).
Los peces expuestos a isoflurano pre- sentaron mayor variabilidad interindividual en comparación al grupo control, pero no registraron signos de excitación como fue reportado en D. renio (Collymore et al., 2014). Los peces expuestos a una concentración de 0.2 mg/l (IS0.2) tuvieron un aumento significativo (p<0.05) en los tiempos de las fases II y III, mientras que los peces expuestos a una concentración de isoflurano de 0.4 mg/l (IS0.4) registraron una disminución significativa en todas las fases de la anestesia (p<0.001) en comparación a los animales E50. Sin embargo, no hubo diferencia significativa con el tiempo de recuperación, el cual fue similar al descrito para D. rerio (Collymore et al., 2014).
Propofol (P5) muestra un aumento significativo (p<0.001) en los tiempos de anestesia y recuperación en comparación al grupo control, así como una mayor variabilidad interindividual. Los tiempos registrados fue- ron similares a los reportados para D. rerio a la misma dosis (Valentim et al., 2016). Por otro lado, se determinó una disminución cerca al 32% de la frecuencia respiratoria (p<0.05) en los peces expuestos al propofol, similar a lo descrito en otras especies de pe- ces (Peyghan et al., 2008; Gomu³ka et al., 2015).
Todos los peces llegaron a una anestesia quirúrgica (Fase III) con los fármacos evaluados, independiente de la dosis. Los que registraron una anestesia quirúrgica en me- nos de 3 min fueron los de los grupos E50, LI300 y IS0.4, mientras que todos se recuperan en menos de 6 min, a excepción del grupo P5 que registró un tiempo de recuperación cercano a los 15 min. Esto revela que la utilización de propofol a una dosis de 5 mg/l no representa un buen anestésico para C. interruptus, por su tardía recuperación, según los parámetros expuestos como ideales para un fármaco sedante (Coyle et al 2004; Priborsky y Velisek 2018).
CONCLUSIONES
Eugenol e isoflurano pueden considerar- se aptos para la utilización en C. interruptus al ajustarse a los requerimientos ideales para anestésicos en pe ces.
La excitación inicial provocada por lidocaína, descartando la influencia de factores externos, podría atribuirse a una dosis insuficiente que indujo lenta la anestesia, resultados que sugieren reevaluar la dosificación.
La dosis de porpofol requiere de nuevos estudios, dado el extenso tiempo de recuperación y su interferencia en la frecuencia respiratoria bajo anestesia,
No se registraron muertes hasta las 72 horas pos-aplicación de los fármacos utilizados.












 uBio
uBio