INTRODUCCIÓN
El tratamiento analgésico preventivo tiene por objetivo reducir el dolor trans y posoperatorio, favorecer la recuperación, y disminuir la morbimortalidad perioperatoria.
Los estímulos dolorosos provocan aumento de la presión arterial, midriasis y cambios en la función respiratoria, entre otros cambios fisiológicos y conductuales. La estimulación dolorosa permanente puede conducir a comportamientos anormales en el animal, afectan- do su salud y su bienestar (Keating et al., 2012).
Los conejos son ampliamente utilizados como modelos experimentales para la investigación in vivo debido a los beneficios que ofrece esta especie, toda vez que son muy dóciles, requieren poco espacio para su alojamiento y sus enfermedades son fácilmente controladas. Además, el manejo de estos animales es sencillo debido a su tamaño (Mapara et al., 2012). Sin embargo, la evaluación de las manifestaciones dolorosas en estos animales es difícil y poco estudiada, de allí que protocolos anestésicos que proporcionen analgesia adecuada están descritos de forma limitada en la literatura científica (Keating et al., 2012; Wenger, 2012).
Entre los analgésicos no opioides des- tacan los fármacos antiinflamatorios no esteroides, que se utilizan por su acción antinflamatoria inhibiendo la cicloxigenasa y consecuente producción de prostaglandinas (Barter, 2011; Wenger, 2012). Los opioides actúan al conducir a analgesia neuronal, debido a su ligación y agonismo de receptores endógenos, µ, κ, δ y ε en las neuronas, que inducen efecto antinociceptivo (Spinosa et al., 2011), pero pueden desencadenar efectos secundarios ya que aumentan el tono vagal, deprimen la respuesta del centro respiratorio al CO2, estimulan la liberación de hormona antidiurética, prolactina, somatotropina e histamina, inhiben la liberación de la hormona luteinizante, disminuyen la motilidad gastrointestinal, y afectan el estado de conciencia (Barter, 2011; Wenger, 2012). Sin embargo, se recomienda su administración sistémica durante los procedimientos quirúrgicos por la necesidad ética de mitigar la sensación e intensidad del dolor (Katz et al., 2011).
Entre los opioides, la morfina se destaca como un medicamento modelo, tiene una enorme eficacia en el alivio del dolor en comparación con otras sustancias analgésicas, con un efecto postoperatorio significativo y duradero (Navarrete-Calvo et al., 2014). Sin embargo, en conejos el uso de morfina por vía parenteral no es muy difundido debido a la alta tasa metabólica de estos animales, que impide el mantenimiento de una concentración plasmática efectiva y duradera (Spinosa et al., 2011). Se ha indicado que el uso de morfina en conejos puede conducir a daño oxidativo del sistema nervioso central, disminuyendo las concentraciones de glutatión en la médula espinal y el cerebro y afectando los niveles antioxidantes, lo que puede conducir a daño neuronal (Özmen et al., 2007).
La metadona es un opioide alternativo, tiene propiedades farmacológicas similares a la morfina, ocupando los receptores ya descritos para lograr su efecto analgésico; sin embargo, tiene una duración más larga y se utiliza en cirugías que requieren un tiempo de recuperación mayor (Barter, 2011; Udelsmann et al., 2011; Wenger, 2012). En comparación con la morfina en conejos, la metadona parece promover una analgesia más potente y corta, con un inicio de acción más rápido (Hunter et al., 1968). En animales pequeños, la metadona produce menos sedación y menos emesis en comparación con la morfina, siendo una buena alternativa para los pacientes en los que no se pueden usar otros opioides (Spinosa et al., 2011).
Con estos preceptos, el objetivo de este estudio fue evaluar y comparar la eficacia analgésica del tratamiento preventivo con metadona o morfina en conejos sometidos a cirugía reconstructiva integumentaria y las posibles alteraciones cardiopulmonares que estos fármacos pueden desencadenar.
MATERIALES Y MÉTODOS
Aspectos Éticos y Animales
El estudio fue aprobado por el Comité de Ética de la Universidad Estadual Paulista (Protocolo N.º 11767/14). El modelo experimental animal elegido fue el conejo (Oryctolagus cuniculus). Se seleccionaron 36 machos de raza Nueva Zelanda, blancos, de 4 a 8 meses de edad y un peso de 3 a 5 kg, distribuidos aleatoriamente mediante sorteo en bolsa oscura, en tres grupos experimentales: grupo control (CON, n=12), grupo metadona (MET, n=12) y grupo morfina (MOR, n=12).
Procedimiento Experimental
Los animales no fueron sometidos ayuno como se recomienda (Uscategui et al., 2013) pues el conejo no tiene la capacidad de vomitar. Veinte minutos antes de la inducción anestésica, todos los conejos recibieron medicación preanestésica por vía intramuscular (IM), compuesta por midazolam 1.0 mg/kg. Además, en forma conjunta el grupo CON recibió NaCl 0.9% 0.05 ml/kg como trata- miento placebo, el grupo MET recibió metadona 0.5 mg/kg y el grupo MOR morfina 0.5 mg/kg. El grado de sedación fue evaluado 15 min después utilizando una escala de 0 a 3, donde 0 representa sin signos de sedación, 1 sedación leve (menos alerta, pero todavía activo), 2 sedación moderada (somnoliento, capaz de caminar) y 3 sedación intensa (muy somnoliento, incapaz de caminar). Al mismo tiempo, se monitoreó la frecuencia cardíaca (FC), la frecuencia respiratoria (fR), la saturación periférica de oxígeno (SpO2), la presión arterial media (PAM, a través de un catéter colocado en la arteria auricular caudal), y la temperatura rectal (TR) utilizando un monitor multiparamétrico (Mindray iPM-9800, China).
La inducción anestésica se realizó en todos los animales mediante la vaporización de 5% de isoflurano en oxígeno al 100% (FiO2= 1.0), con un flujo de 1 L/min, utilizando una mascarilla con diafragma de goma y un circuito anestésico abierto sin re-inhalación de gases. El tiempo en segundos transcurridos desde el inicio de la vaporización del isofluorano hasta la pérdida del reflejo palpebral se registró como el tiempo de inducción anestésica. El mantenimiento anestésico se llevó a cabo mediante el reajuste del porcentaje de vaporización de isoflurano a la concentración mínima que permitiera mantener el plano anestésico quirúrgico, evaluado por los parámetros clásicos de Guedel (rotación ventral del globo ocular, pérdida de reflejos protectores y mantenimiento de funciones neurovegetativas).
Una vez estabilizado el plano anestésico, los animales se colocaron en decúbito lateral derecho y se inició el procedimiento quirúrgico experimental como descrito por Pazzini et al. (2018). Diez minutos después de la inducción anestésica y cada 10 min hasta el final del procedimiento se registraron los parámetros indicados anteriormente (FC, fR, SpO2, PAM, TR).
Asimismo, 15 min después de la medicación preanestésica, 30 min después de la inducción anestésica y al final del procedimiento quirúrgico se realizaron exámenes electrocardiográficos. Para esto, se coloca- ron electrodos de tipo clip con gel de contacto (para asegurar el contacto directo con el paciente) en las extremidades torácicas a la altura del codo y en las extremidades pélvicas a la altura de la rodilla y se utilizó un electro- cardiógrafo computarizado (Tenologia Eletrônica Brasileira TEB). Se hicieron re- gistros de 3 min a una velocidad de 50 mm/s y una calibración de 1 cm/mV de las derivaciones bipolares (DI, DII, DIII) y unipolares (aVR, aVL, aVF). El análisis de estas variables se realizó utilizando la derivación DII como derivación isoeléctrica en la especie y fueron medidas las características de ritmo, frecuencia, eje eléctrico cardíaco, duración en milisegundos (ms) y/o amplitud en milivoltios (mV) de la onda P (Pms y PmV), la onda R (RmV) el intervalo PR (PRms), el complejo QRS (QRSms), el intervalo QT (QTms) y la onda T (TmV), como descrito por Lord et al. (2010).
Una vez finalizado el procedimiento quirúrgico, los animales del grupo CON recibieron tramadol 5.0 mg/kg por vía IV y los de los grupos MOR y MET NaCl 0.9% 0.05 ml/kg. Se encerró el suministro de isofluorano y los animales fueron colocados en jaulas apropia- das para su recuperación anestésica, siendo observados y monitoreados hasta que estuvieran en estación cuadrúpeda. El tiempo desde el cierre del isofluorano hasta este momento se registró como tiempo de recuperación anestésica. Transcurridas 2, 8, 12 y 24 horas de la recuperación, el dolor posoperatorio era evaluado por dos árbitros entrenados y ciegos para el tratamiento, mediante la escala analógica visual (VAS) y la respuesta al test de estimulación con filamentos de Von-Frey aplicado a dos centímetros de la herida quirúrgica (Malfait et al., 2013).
Después de la evaluación posoperatoria se administró amoxicilina 22 mg/kg y meloxicam 0.2 mg/kg por vía IM. Posteriormente, los animales fueron llevados a jaulas individuales, recibiendo agua y alimento equilibrado ad libitum. Durante los siguientes 15 días se hicieron inspecciones de estado general y de comportamiento de cada animal para evaluar el estado de salud y garantizar su recuperación satisfactoria. Los conejos recibieron meloxicam 0.2 mg/kg/día y dipirona 25 mg/kg c/8 h vía IM durante 5 días como tratamiento posoperatorio.
Análisis Estadístico
El software R (Foundation for Statistical Computing, Austria) se utilizó para el análisis estadístico en un diseño completamente aleatorizado con medidas repetidas en el tiempo. Inicialmente, se evaluaron la normalidad de los residuos (prueba de Shapiro) y homocedasticidad de las varianzas (prueba de Bartlett) de todas las variables. Los valores de las variables con distribución normal se compararon entre los tratamientos y momentos mediante el análisis de varianza con medidas repetidas, post-hoc de Tukey, y sus resultados se presentan como media ± DE (desviación estándar). Los valores de las variables con distribución no normal se compararon de manera similar mediante la prueba de Friedman, post-hoc de Dunns y sus resultados se presentan como la mediana ± RIC (rango intercuartílico). La necesidad de res- cate analgésico fue comparada entre los grupos por el método de sobrevivencia de Kaplan Meier. La significación se fijó para todas las pruebas en 95% (p<0.05).
RESULTADOS
Los puntajes de sedación fueron mayo- res (p=0.0420) en animales tratados con metadona (1.5±1.0) y morfina (2.0±0.5) que en el grupo control (0±0.5), y el tiempo de inducción fue menor (p=0.0012) en el grupo MET (28.7±4.3 s) y MOR (27.7±6.4 s) en comparación con el grupo CON (34.9±4.0 s).
Los animales tratados con metadona y, en menor grado con morfina mostraron reducción de la FC (p=0.0001) durante los momentos 1 al 4 en comparación con el control. La metadona aumentó la PAM (p=0.0112) en los momentos 2 y 3; y la morfina en el momento 3. La fR se redujo en los momentos 2 y 3 cuando se utilizó metadona (p=0.0035), mientras que en los grupos MOR y CON no hubo cambios en momento alguno. Durante los tiempos 1 al 4 la metadona redujo SpO2 (p=0.0002) en comparación con los otros grupos (Figura 1). La temperatura rectal fue similar entre los tratamientos (p=0.4040), disminuyendo gradualmente (p=0.0250) en todos los animales, los cuales perdieron 1 °C en promedio durante el experimento.
La cirugía se realizó con éxito en todos los pacientes y todos se recuperaron de la anestesia satisfactoriamente y sin señales de estrés. El tiempo de recuperación anestésica (50.2±13.9 min) fue similar (p=0.9221) en todos los grupos. En cuanto al dolor postoperatorio, la respuesta a los filamentos de Von-Frey (p=0.6824) y la evaluación del VAS (p=0.7661) fueron similares entre grupos. Sin embargo, los animales del grupo CON presentaron una mayor proporción (p=0.0412) de requerimiento de rescate analgésico posoperatorio (33%) que los animales de los grupos MOR (19%) y MET (12%) (Figura 2).
En el electrocardiograma (Figura 3), la frecuencia cardíaca [259-301 lat/min (inter- valo de confianza 95%)], la duración de la onda P (23-28 ms), del complejo QRS (39-43 ms), de los intervalos PR (51-62 ms) y QT (59-65 ms), así como la amplitud de la onda P (0.05-0.07 mV), R (0.17-0.21 mV), T (0.02-0.03 mV) y el eje cardíaco eléctrico (57-56º) no presentaron cambios resultantes de los tratamientos (p=0.1454) o momentos (p=0.0871) evaluados.
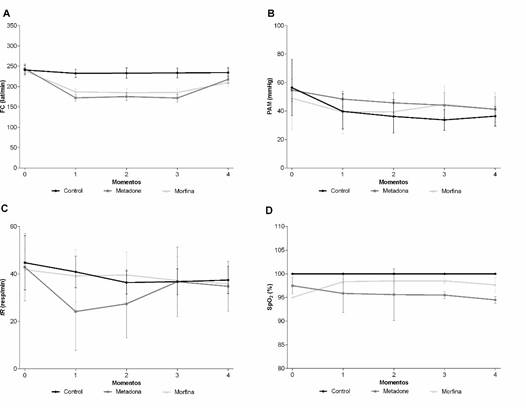
Figura 1 Representación gráfica de la media ± DE de la frecuencia cardíaca (A), presión arterial media (B), frecuencia respiratoria (C) y saturación periférica de oxígeno (D) evaluadas durante la cirugía cutánea en conejos bajo anestesia general pretratados con mor- fina, metadona o placebo (Control)
DISCUSIÓN
El tratamiento analgésico preventivo con metadona o morfina demostró ser eficaz para controlar el dolor trans y posoperatorio en conejos sometidos a cirugía cutánea, en comparación con el tratamiento placebo. La cirugía se realizó con éxito en todos los pacientes, la recuperación fue satisfactoria y ninguno de los animales mostró signos de sufrimiento durante el posoperatorio. El dolor posoperatorio en respuesta a los filamentos de Von-Frey y la evaluación VAS fueron similares entre tratamientos; sin embargo, los animales del grupo de control mostraron una mayor necesidad de rescate analgésico.
Al comparar los hallazgos del estudio con reportes hechos en perros sometidos a mastectomía y procedimientos ortopédicos fueron similares. La metadona resultó en un menor consumo de analgésicos en el posoperatorio y menores puntuaciones de dolor posoperatorio que el placebo y el tramadol (Cardozo et al., 2014; Uscategui et al., 2017). Este efecto se puede atribuir a la extensa acción de la metadona en la vía nociceptiva, asegurando una mayor potencia y duración del efecto analgésico, así como un bloqueo más efectivo de la sensibilización central (Cardozo et al., 2014). La eficacia de la morfina como analgésico preventivo se ha descrito en conejos (Navarrete-Calvo et al., 2014).

Figura 2 Representación gráfica de la Mediana ± RIC de la evaluación del dolor posoperatorio mediante prueba analógica visual VAS (A) y curva de supervivencia de Kaplan-Meier de la necesidad de rescate analgésico posoperatorio (B) posterior a una cirugía cutánea en conejos bajo anestesia general pretratados con morfina, metadona o placebo (control)
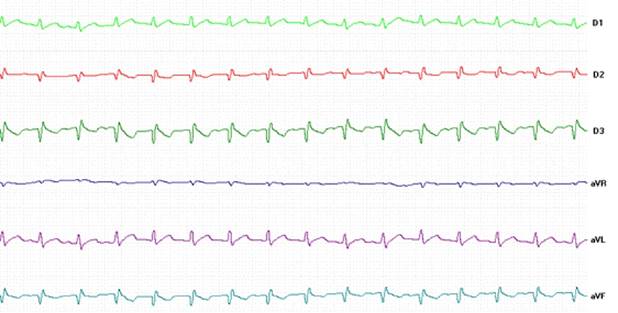
Figura 3 Trazados electrocardiográficos en las derivaciones bipolares (D1, D2 y D3) y aumentadas (aVR, aVL y aVF) en conejos sometidos a cirugía cutánea bajo anestesia general y tratados preventivamente con metadona, morfina o placebo (control) como terapia analgésica
Estudios en perros indican que pocos animales que recibieron metadona mostraron signos de dolor posoperatorio (Cardozo et al., 2014; Uscategui et al., 2017), lo cual corrobora los resultados del presente estudio, en el cual menos del 12% de los conejos tratados con metadona presentaron señales posoperatorias compatibles con dolor. La similar eficacia analgésica encontrada en este estudio entre morfina y metadona ha sido descrita en personas (Udelsmann et al., 2011) y se puede justificar por el mecanismo de acción opioide que comparten ambos fármacos; sin embargo, un estudio en gatos demostró que la metadona tiene mayor efecto antinociceptivo que la morfina (Pypendop et al., 2016), lo que podría justificar la tendencia observada a mejorar el control del dolor posoperatorio mediante metadona.
El uso de filamentos de Von-Frey como técnica eficaz para la evaluación del dolor neuropático en el conejo ha sido validado (Aksu et al., 2010). En el presente estudio, esta prueba exhibió respuesta nociceptiva en el 33% de los conejos CON, 19% en MOR y 13% en MET, por lo que es un método interesante para evaluar el dolor en esta especie.
Los conejos tratados previamente con morfina y metadona presentaron un efecto sedativo. Esta sedación se ha reportado de manera similar en perros (Cardoso et al., 2014), donde la metadona parece intensificar la depresión del sistema nervioso central (Monteiro et al., 2016); sin embargo, estos efectos sedantes no se presentan en el gato (Pypendop et al., 2016), de allí que los resultados pueden estar influenciados por el comportamiento y la respuesta fisiológica de esta especie a los opioides (Spinosa et al., 2011). No obstante, no se encontraron estudios que describan efectos sedantes o estimulantes de opioides en conejos, por lo que este resultado es una descripción inicial.
El tiempo de inducción inhalatoria fue más corto en los grupos tratados con opioides. En este sentido, varios estudios indicaron que el uso de opioides previene respuestas autónomas a estímulos dolorosos, reduciendo los requerimientos de medicamentos anestésicos por vía intravenosa o inhalatoria y, además, disminuyen el dolor y las molestias postoperatorias (Spinosa et al., 2011; Cardozo et al., 2014; Navarrete-Calvo et al., 2014; Monteiro et al., 2016; Pypendop et al., 2016; Uscategui et al., 2017). La metadona y la morfina, en menor medida, reducen los requerimientos de isoflurano para anestesia (Monteiro et al., 2016). Este efecto de economía anestésica puede explicar el menor tiempo de inducción por inhalación identificado en este estudio.
La metadona y la morfina, en menor medida, provocan un aumento de la presión arterial y una reducción de la frecuencia cardíaca durante el periodo anestésico. Estos efectos pueden estar relacionados con la dosis más alta de isoflurano necesaria para mantener el plano anestésico en el grupo CON, ya que el isoflurano en esta especie tiene un efecto hipotensor dependiente de la dosis (Marano et al., 1996). Debido a restricciones técnicas, no fue posible medir la fracción expirada de isoflurano; sin embargo, estudios previos realizados por este grupo de investigación, mostraron que los conejos que no reciben tratamiento analgésico opioide preoperatorio presentan un mayor consumo de anestesia que los animales tratados previamente con opioides (Uscategui et al., 2013), correlacionando este efecto con la hipotensión arterial y el consecuente aumento de la frecuencia cardíaca por baro- reflejo. Además, los valores de PAM más al- tos observados en el grupo de la metadona, también se pueden correlacionar con el aumento de las concentraciones en sangre de arginina-vasopresina, como descrito en perros tratados con metadona (Ingvast-Larsson et al., 2010) y que conduce a aumento de la resistencia vascular periférica y consecuente aumento de la PAM.
La metadona causó depresión respiratoria significativa, evidenciada por reducción en la frecuencia respiratoria y saturación periférica de oxígeno. Esta depresión respiratoria ya ha sido reportada en conejos trata- dos con morfina y correlacionada con el efecto de fármacos agonistas de los receptores opioides µ en el centro respiratorio que pro- duce un aumento del umbral de respuesta al CO2 (Hunter et al., 1968). Este estudio también demostró que la metadona se considera un depresor respiratorio mucho más potente que la morfina al determinar que con una dosis mínima de 0.236 mg/kg de metadona puede conducir a un efecto depresor respiratorio similar a 1 mg/kg de morfina. Estos resultados corroboran las alteraciones evidenciadas en este estudio, ya que a la dosis de 0.5 mg/kg de metadona fue identificada una depresión respiratoria importante, mientras que la misma dosis de morfina no causa esta alteración.
El tiempo y la calidad de la recuperación anestésica entre tratamientos fueron similares. En este sentido, los resultados de estudios previos son controversiales, y estos efectos parecen depender de la especie (Spinosa et al., 2011). En conejos y roedores, aparentemente el uso de opioides aumenta la profundidad y la calidad de la anestesia, reduce los requerimientos de anestesia, el tiempo de recuperación y el retorno a la alimentación normal (Barter, 2011; Wenger, 2012), mientras que en perros y gatos se pueden observar signos de excitación, jadeo, vómito y estreñimiento (Pypendop et al., 2016; Uscategui et al., 2017). Estas alteraciones no fueron evidenciadas en este estudio, lo que puede estar relacionado con una mayor tasa metabólica y baja solubilidad de la anestesia inhalatoria, lo que aumenta la velocidad de eliminación de los opioides (Spinosa et al., 2011).
El examen electrocardiográfico no pre- sentó variaciones con el tratamiento analgésico ni con los momentos analizados (Figura 3). En este sentido, un estudio realizado en conejos bajo anestesia isofluorano encontró que el bloqueo analgésico neuronal no afecta las variables electrocardiográficas, frecuencia cardíaca, duración de la onda P, intervalo P-R, complejo QRS, intervalo Q-T ni amplitud de las ondas P y R (Farkas et al., 2004).
Lord et al. (2010) describieron en conejos despiertos los parámetros electrocardiográficos normales: frecuencia cardíaca (198-330 lat/min), duración de la onda P (20- 40 ms) e intervalo QT (80-160 ms). Los resultados de la frecuencia cardíaca y de la duración de la onda P fueron similares a esta referencia, sin embargo, el QT fue menor y puede estar relacionado con el aumento del tono vagal por anestesia general (Wenger, 2012). Por otro lado, estudios en conejos de- mostraron que la medición del intervalo QT no es confiable debido a la difícil demarcación del punto final de la onda T, aunque este evento es más común en conejos sometidos a cirugía, debido al aumento de la frecuencia y el ciclo cardíaco corto (Farkas et al., 2004), lo cual corrobora los hallazgos del estudio.
Las amplitudes de las ondas R (0.75 mV) y T (0.40 mV) en conejos presentadas por Levine (1942) fueron mayores en comparación con las amplitudes encontradas en el presente estudio, demostrando una repolarización ventricular reducida. El eje eléctrico promedio en conejos despiertos varía de -43 a 88° (Lord et al., 2010), en tanto que en este estudio varió de 56 a 57°, considerado dentro del rango normal. Una explicación para esta variación de intervalo podría estar relacionada con la anatomía torácica de las diferentes razas de conejos (Lord et al., 2010).
CONCLUSIONES
En las condiciones experimentales estudiadas, el tratamiento analgésico preventivo con morfina o metadona fue eficaz para controlar el dolor trans y posoperatorio en conejos sometidos a cirugía cutánea y los efectos cardiovasculares fueron limitados; sin embargo, la metadona conduce a una importante depresión respiratoria y consecuente- mente su uso debe ser cuidadoso.












 uBio
uBio 

