INTRODUCCIÓN
Los quirópteros o murciélagos pueden encontrarse alrededor de todo el mundo, ocupando un papel fundamental en el ecosistema debido a su capacidad de polinizar, dispersar semillas y controlar plagas (Fenton y Simmons, 2015). El Perú cuenta con más de 185 especies registradas (Medina et al., 2016; Velazco, 2021), como parte de ocho de las nueve familias registradas en Sudamérica (Quintana y Pacheco, 2007). Se les considera reservorios ideales de diversos microorganismos patógenos debido a la gran diversidad de especies, amplia distribución geográfica y características especiales dentro de los mamíferos (Cicuttin et al., 2014).
Las bacterias del género Bartonella son gramnegativas, intracelulares facultativas, afectando al humano y a los animales (Vayssier-Taussat et al., 2016). Se han aislado más de 30 especies y dentro de ellas, cerca de 20 son causantes de enfermedades como la enfermedad de Carrión (B. bacilliformis), enfermedad por arañazo de gato o angiomatosis bacilar (B. henselae) y la fiebre de las trincheras (B. quintana) de importancia a nivel nacional. Además, pueden generar endocarditis severas (B. mayotimonensis) con alta mortalidad en países como los Estados Unidos (Regier et al., 2016). Estas enfermedades se transmiten mediante vectores como garrapatas, pulgas, mosquitos y moscas (Blanco y Raoult, 2005). Mamíferos como pumas, alces, marsopas, murciélagos y varios tipos de roedores son reservorios capaces de transmitir las enfermedades a hospederos susceptibles (Angelakis y Raoult, 2014; Regier et al., 2016).
Los murciélagos vienen siendo estudiados como importantes reservorios de Bartonella spp a nivel mundial, poniendo especial énfasis en países como Estados Unidos (Hayman et al., 2013), Francia, España (Stuckey et al., 2017b), China (Han et al., 2017), México (Stuckey et al., 2017a) y Perú (Bai et al., 2012; Del Valle-Mendoza et al., 2018). El conocer su comportamiento y características genéticas, funcionales y taxonómicas podría facilitar el diagnóstico temprano y el control de potenciales emergencias globales como el COVID-19, así como la posible reemergencia de enfermedades (Andersen et al., 2020).
En el Perú se conoce muy poco sobre la ecología de bacterias del género Bartonella en murciélagos, así como una deficiente caracterización de la bartonelosis en la clínica diaria de humanos, dificultándose el diagnóstico adecuado; de allí que se requiere considerar que no se trata de brotes esporádicos, sino que está presente tanto en la población humana como en animal. El departamento de Madre de Dios es una de las regiones con gran presencia de enfermedades metaxénicas y zoonóticas como bartonelosis (MINSA, 2019). La población local se dedica a la producción agropecuaria, turismo y minería, teniendo contacto indirecto con diversas especies animales, incluyendo los murciélagos. Lamentablemente, dada la baja disponibilidad de métodos de diagnóstico específicos no se puede determinar una prevalencia cercana a la real (Romaní-Romaní, 2008; Diaz y Ricapa, 2018), ni de la frecuencia de posibles contagios por contacto con murciélagos (Bai et al., 2018). Ante esto, el presente estudio tuvo como objetivo determinar la presencia de Bartonella spp en grupos de murciélagos no hematófagos en la Reserva Ecológica Taricaya en Puerto Maldonado, Madre de Dios.
MATERIALES Y MÉTODOS
Lugar del Estudio
Estudio descriptivo, transversal y prospectivo realizado en la reserva ecológica Taricaya, ubicada en el sureste de la selva amazónica, provincia de Tambopata, departamento de Madre de Dios, Perú. Esta reserva abarca 476 ha de selva tropical, y se encuentra a 28 km de la ciudad, sin acceso por carretera, a una hora surcando el río Madre de Dios (UTM 19L 50071 - 8615420 y 8615824 DATUM WGS84). Es una zona de bosque húmedo estacionalmente inundable subtropical con densa vegetación, temperatura entre 14 y 32 °C y una alta pluviosidad (Ministerio del Ambiente, 2015b). Los análisis de laboratorio se realizaron en el Laboratorio de Microbiología de la Universidad Nacional Mayor de San Marcos, en Lima, Perú.
Población y Muestras
Se trabajó con varias especies de murciélagos cuyas dietas varían entre frutos, insectos, peces, y otros. Se excluyeron a hembras preñadas y ejemplares menores de 20 g, llegándose a capturar a 62 individuos.
Para la captura de emplearon 34 redes de neblina (6, 9 y 12 m), haciendo un total de 396 m, que fueron instaladas en lugares de posible vuelo o forrajeo. Las colectas se hicieron en 13 noches no consecutivas, especialmente en noches de luna nueva para evitar el efecto lunar sobre la actividad de los murciélagos (Karlsson et al., 2002; Coria, 2014). La disposición de las redes se determinó siguiendo lo propuesto por Kalko (1998), quien menciona una distribución espacial de los murciélagos en los bosques tropicales asociada a su dieta (frugívoros, omnívoros y otros), considerando, además, redes en sotobosque y dosel. Las redes estuvieron activas durante 4 horas (18:00-22:00 h) y fueron revisadas cada 30 minutos.
Los individuos fueron tomados de las redes con guantes de nitrilo-nylon anticorte y fueron depositados en bolsas codificadas de tela individuales para su posterior toma de datos morfométricos (longitud de antebrazo, oreja, pata), registro de peso, edad, sexo y condición reproductiva (Tirira, 1998). La identificación de las especies se realizó en campo siguiendo bibliografía especializada (Gregorin y Taddei, 2007; Diaz et al., 2016). La metodología de campo se realizó tomando en cuenta lo propuesto por el Ministerio del Ambiente (2015a).
Se recolectó hasta 30 µl de sangre mediante punción de la vena cefálica con aguja estéril 25G (Rizo-Aguilar et al., 2015). La sangre fue colocada en tubos capilares y de allí a tarjetas Whatman FTA mantenidas a temperatura ambiente en bolsas herméticas Zyploc 5x7 cm. Los murciélagos fueron liberados en el sitio de la captura.
Extracción de ADN
La extracción de ADN de las muestras de sangre untadas en las tarjetas Whatman FTA hizo con el kit comercial QIAamp DNA Blood Mini Kit (QIAGEN, USA), siguiendo las instrucciones del fabricante. El ADN extraído se almacenó a -20 oC hasta su procesamiento.
Diagnóstico Molecular de Bartonella spp
El gen citrato sintasa (gltA) se encarga de codificar el citrato sintasa, una enzima necesaria para completar el ciclo de Krebs, el cual es altamente conservado en el género Bartonella. Un fragmento de aproximadamente 380 pares de bases (pb) del gen gltA fue amplificado utilizando un protocolo de PCR utilizando los cebadores Bhcs.781p (GGG GAC CAG CTC ATG GTG G) y Bhcs.1137n (AAT GCA AAA AGA ACA GTA AAC A). Se consideraron las siguientes condiciones del termociclador: 95 oC durante 10 min y luego 40 ciclos de 94 oC durante 30 s, 57 oC durante 1 min y 72 oC durante 2 min, seguido de un paso final a 72 oC durante 5 min (Norman et al., 1995).
Los productos amplificados fueron revelados en una cámara de electroforesis usando un gel de agarosa al 1.5%. La fotodocumentación se realizó utilizando un transiluminador UV (Cleaver Scientific) y una cámara digital (Cleaver Scientific). Los tamaños de los productos de PCR fueron analizados mediante comparación con el marcador de peso molecular Tri Dye TM 100pb DNA Ladder (Bio Labs).
Aspectos Éticos
Este proyecto de investigación fue aprobado por el Comité de Ética de la Comisión de Grados y Títulos de la Carrera de Medicina Veterinaria y Zootecnia de la Universidad Científica del Sur, Lima, Perú, con Resolución Directoral Académica de Carrera N . ° 1 1 3 - D A C M V Z - D A F C V B - U.CIENTÍFICA-2020, así como el Informe Técnico N°D000411-2020-MINAGRI- SERFOR-DGSPFS y la Resolución de Dirección General N.° D000223-2020- MINAGRI-SERFOR-DGGSPFFS que brinda la autorización con fines de investigación científica de flora y/o fauna silvestre de par- te del Servicio Nacional Forestal y de Fauna Silvestre - SERFOR, miembro del Ministerio de Agricultura y Riego, con el código de Autorización N°AUT-IFS-2020-040.
Análisis de Datos
Los datos fueron tabulados utilizando el programa Microsoft Excel 2016. Se realizó un análisis descriptivo, univariado y bivariado. Para los análisis descriptivos se reportó la frecuencia porcentual de animales con presencia Bartonella spp y se utilizaron distribuciones de frecuencias absolutas y porcentajes de las variables: especies, grupos de clasificación y presencia de Bartonella spp. Se estimaron los intervalos de confianza de una proporción al 95% IC.
RESULTADOS
Los 62 murciélagos capturados pertenecían a 16 especies no hematófagos, siendo 51.6% (32/62) hembras y 48.4% (30/62) machos. El 79% (49/62) de los individuos había alcanzado la madurez sexual. La especie más abundante fue Carollia perspicillata (n=13), seguida de Artibeus planirostris (n=9) y Carollia brevicauda (n=7), representando en conjunto el 46.8% (29/62) de los individuos muestreados. El grupo de clasificación más abundante fue el frugívoro (77.4%; 48/62), seguido del omnívoro (12.9%; 8/62).
Seis muestras fueron positivas a Bartonella spp, resultando en una prevalencia de 9.68% (6/62). La mayor frecuencia de la bacteria se observó en el murciélago C. perspicillata (Cuadro 1). Según el grupo de clasificación por el tipo de alimentación, las especies frugívoras evidenciaron el 83.3% (5/ 6) con resultados positivos (Cuadro 2). No existe asociación significativa entre la presencia de Bartonella spp y el grupo de clasificación por tipo de alimentación de los murciélagos.
Cuadro 1. Frecuencia de muestras positivas a Bartonella spp mediante PCR en sangre de murciélagos en la Reserva Ecológica Taricaya, Madre de Dios, Perú (2020)

Cuatro de las seis muestras positivas fueron hembras. No se detectó Bartonella spp en murciélagos juveniles. Las hembras positivas presentaron una condición reproductiva igual similar con vagina cerrada y pezón desarrollado no turgente, en tanto que los machos presentaron testículos no escrotales (Cuadro 3). La Figura 1 muestra los resultados positivos de PCR a Bartonella spp, revelados en la cámara de electroforesis.
Cuadro 2 Frecuencia de muestras positivas a Bartonella spp mediante PCR según el tipo de dieta alimenticia en murciélagos de la reserva ecológica Taricaya, Madre de Dios, Perú (2020)

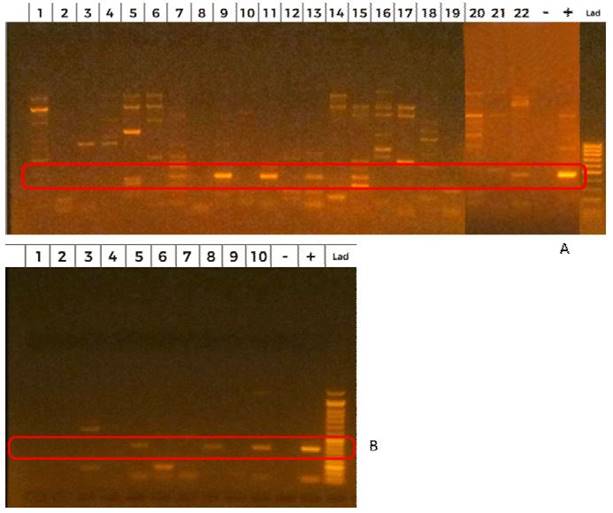
Figura 1.Prueba de PCR para a Bartonella spp a muestras de ADN de sangre de murciélagos de la Reserva Ecológica Taricaya, Madre de Dios. (A) Carriles 1-22: resultado positivo en carriles 9 y 11. (B) Carriles del 1 al 10: resultado positivo en carriles 5, 8 y 10. Lad= Ladder; + = resultado positivo; - = resultado negativo
Cuadro 3. Sexo, edad, peso, largo de antebrazo y condición reproductiva de especies de murciélagos positivos a Bartonella spp muestreados en la reserva ecológica Taricaya, Madre de Dios, Perú (2020)

1 TNE: testículo no escrotal, VCPDNT: vagina cerrada pezón desarrollado no turgente (Vela y Pérez- Torres, 2013)
DISCUSIÓN
El estudio evidenció la presencia de Bartonella spp en poblaciones de murciélagos en el sureste amazónico del Perú. Los murciélagos vienen siendo un importante reservorio de la bacteria en el Perú, aunque la prevalencia general (9.68%; Cuadro 1) es menor en comparación con reportes previos, como el de Bai et al. (2012) quienes reportan una prevalencia de 24.1%, posiblemente debido a que en el presente estudio no hubo especies de murciélagos hematófagas como Desmodus rotundus, el cual evidencia una alta prevalencia de infección (Bai et al., 2011, Becker et al., 2018a; André et al., 2019). Es posible que la línea de infección de parte de las poblaciones hematófagas a las no hematófagas sea a través de la contaminación de la piel con heces de artrópodos infectados, aglutinación u otra ruta desconocida (Ikeda et al., 2020), aunque hay opiniones divergentes que indican que la propagación de Bartonella a murciélagos ocurre a través de un vector hematófago contaminado indistintamente de la especie de murciélago (Mckee et al., 2020).
Este es el primer reporte de la presencia de Bartonella spp. en murciélagos A. lituratus, P. elongatus y P. infuscus en el Perú (Cuadro 1); incrementando el número de especies que cumplen el rol de reservorio de esta bacteria a nivel nacional. La presencia de Bartonella spp en C. perspicilata a nivel nacional fue previamente identificada por Bai et al. (2012).
A diferencia de Stuckey et al. (2017a) que evidencia una mayor probabilidad de infección por Bartonella spp en especies hematófagas, seguido de insectívoras y fitófagas, aduciendo una correlación entre el hábito alimenticio y el sistema inmunológico, dado que el recuento total de glóbulos blancos es mayor en hematófagos debido a un mayor riesgo de contraer enfermedades infecciosas. En el presente estudio no se encontró una asociación entre la presencia de Bartonella spp y el tipo de hábito alimenticio posiblemente debido a la organización social y la amplia distribución de especies de murciélagos en un mismo dormidero (Kunz y Femton, 2006; Mering y Chambers, 2014), así como la alta presencia de Bartonella spp en sus ectoparásitos (Billeter et al., 2012; Morse et al., 2012), pudiendo generarse una eficiente trasmisión entre especies, como se da con la transmisión del virus de la rabia entre murciélagos hematófagos o no hematófagos (Streicker et al., 2010; Allendorf et al., 2012, Becker et al., 2018b).
A pesar de las limitaciones del estudio, los resultados ofrecen un avance en la comprensión de Bartonella spp y una potencial aproximación a la problemática de enfermedades metaxénicas altamente presentes en el departamento de Madre de Dios. Se considera que existe una subestimación de la pre- valencia de bartonelosis en la clínica diaria de Madre de Dios, debido a la falta de sensibilidad y especificidad en los métodos de diagnóstico de los programas nacionales de vigilancia (Pachas, 2001; Diaz y Ricapa, 2018), como frotis sanguíneo, cultivo en agar, pruebas serológicas (Ventura y Padilla, 2006; Sander et al., 2001) que son inespecíficos para todo el grupo de Bartonella y presentan un crecimiento lento en cultivo, por los que resultan poco útiles para una rápida identificación; mientras que el análisis por PCR, como el usado en el presente estudio, es útil para la detección e identificación general o específica del género Bartonella spp, presentando una alta especificidad y sensibilidad (100%) (Norman et al., 1995; La Scola et al., 2003; Kosoy et al., 2018).
En la actualidad, en medio de una emergencia sanitaria mundial debido al COVID- 19, es importante considerar todos los alcances en salud pública y comprender detalladamente el comportamiento de los agentes patógenos como el estudiado en el presente trabajo, para enfrentar de mejor forma nuevas cepas emergentes o posibles re-emergencias (Andersen et al., 2020). No solo se trataría de cepas conocidas (B. bacilliformis, B. henselae, B. quintana), sino de cepas nuevas que pueden ser altamente mortales como la reciente cepa B. mayotimonensis identificada en Estados Unidos (Veikkolainen et al., 2014; Han et al., 2017; Lilley et al., 2017; Stuckey et al., 2017b).
CONCLUSIONES
Se identificó la presencia de Bartonella spp en 6 de 62 (9.68%) individuos de cuatro especies de murciélagos no hematófagos (Artibeus lituratus, Carollia perspicillata, Phyllostomus elongatus, Platyrrhinus infuscus) en la provincia de Madre de Dios, Perú.
Bartonella spp en Artibeus lituratus, Phyllostomus elongatus y Platyrr- hinus infuscus no habían sido registradas a nivel nacional.












 uBio
uBio 

