INTRODUCCIÓN
A nivel mundial, los ecosistemas marinos se han visto afectados por la contaminación de metales pesados (MP), debido a fuentes naturales o antropogénicas (Perumal et al., 2021). Estos contaminantes representan un importante problema ambiental y de salud pública debido a su persistencia, abundancia y toxicidad (Pérez y Azcona, 2012; López- Bellido y López, 2013; Feoktistova y Clark, 2018; Medina-Pizzali et al., 2018; Naggar et al., 2018; Cadavid-Muñoz y Arango-Ruiz, 2020; El-Amier et al., 2021). Además, el incremento de MP en el sedimento marino aumenta las posibilidades de bioacumulación en organismos bentónicos, generando efectos adversos negativos (García et al., 2008; Fuentes et al., 2010; Yunus et al., 2020). Los efectos letales, subletales y la bioacumulación de MP influyen en la disrupción endocrina de la fauna (Sierra-Marquez et al., 2018).
Por otro lado, el estaño presente en los tintes antiincrustantes se manifiesta a través del imposex (IMP), definido como la presencia de características sexuales masculinas en los especímenes femeninos de gasterópodos prosobranquios (Otegui et al., 2019). Este fenómeno se expresa en el individuo con relación a la biodisponibilidad del TBT (Tributilo de estaño), compuesto organometálico (França et al., 2021; Lee et al., 2022). El TBT ingresa en gran medida al ecosistema marino por la presencia de tintes antiincrustantes en embarcaciones (Valkirs et al., 1991; Schøyen et al., 2019). Los puertos con alta circulación de embarcaciones y áreas aledañas a los astilleros son donde, principal- mente, se presentan los más altos niveles de esta sustancia estañosa (Rivas et al., 2017).
En el Perú existen escasas investigaciones sobre la presencia de esta alteración reproductiva denominada IMP en sus costas marinas (Castro y Fillmann, 2012; Guabloche et al., 2013; Chumbimune y Ponce, 2017; Rivas et al., 2017; Enrique et al., 2019). En los puertos de Callao y Chimbote se han de- terminado altas concentraciones de TBT re- lacionadas al fenómeno de IMP en Thaisella chocolata. Por otro lado, Enrique et al. (2019) sugieren que T. chocolata posee alta sensibilidad al TBT, lo que la convierte en una especie centinela, en comparación a Xanthochorus buxeus. Existen varias hipótesis que proponen como se produce el imposex en los caracoles por acción del TBT, el que es inducido por (1) la inhibición de la aromatasa, (2) modulación de testosterona o (3) inhibición de la excreción de testosterona, aumentando los niveles de testosterona libre, (4) alteración del factor morfogenético del pene y, finalmente, (5) modulación anormal de la vía de señalización de los receptores X de retinoides (RXR) (Ragagnin y Turra, 2022).
Thaisella chocolata, conocido también como «caracol negro» se distribuye desde Paita (Perú) hasta Valparaíso (Chile). Es un gasterópodo de interés comercial por su con- sumo local y de exportación (Alfaro, 2020). Además, estos organismos bentónicos se distribuyen sobre superficies de conchuela molida, rocosa y arena gruesa, entre 5 y 40 m de profundidad; y no presenta dimorfismo sexual (Cantillánez et al., 2011; Guzmán, 2021; Iannacone et al., 2022).
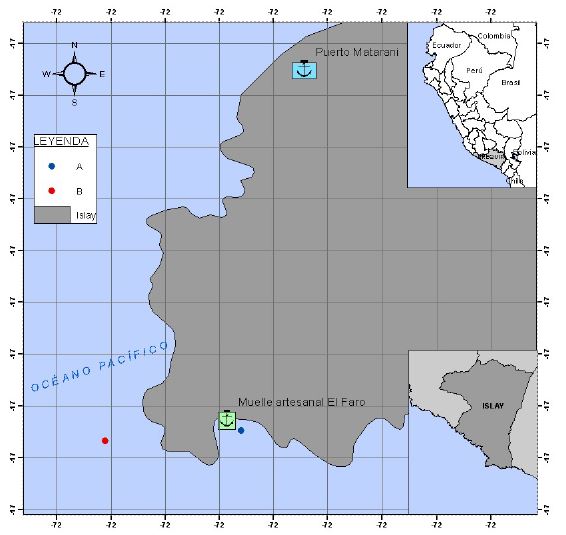
El desembarcadero pesquero artesanal (DPA) «El Faro», en Matarani, Arequipa, Perú, provee distintos recursos hidrobiológicos a la pesca industrial y artesanal (PRO- DUCE, 2016; IMARPE, 2017). En esta investigación se evaluó la presencia de MP e IMP en T. chocolata en el DPA «El Faro» así como en una zona distante 2 km de dicho muelle, durante el invierno y la primavera de 2021. Además, se evaluaron los MP en el agua y en el sedimento marino.
MATERIALES Y MÉTODOS
Área de Estudio
La zona de muestreo «A» (17°0’53.92" S 72°6’31.89" LO) se encuentra ubicada el DPA «El Faro», en el cual se realizan actividades de descarga de especies hidrobiológicas para consumo nacional e internacional, por lo cual hay gran afluencia de embarcaciones en la zona. La zona de muestreo «B» se localizó aproximadamente a 2 km del DPA (17°0’55.52" S y 72°6’52.61" O), donde se encuentran islotes y lobos marinos, y se desarrollan además actividades turísticas como paseos en botes para observar la fauna marina. Ambas zonas se encuentran localizadas en el distrito de Matarani, provincia de Islay, Arequipa, Perú (Figura 1).
Muestreos
Se extrajeron muestras de agua, sedi- mento e individuos del caracol marino T. chocolata provenientes de las zonas A y B durante dos estaciones (invierno y primave- ra) de 2021. Las zonas se denominaron Ainv (zona A en invierno), Apri (zona A en prima- vera), Binv (zona B en invierno) y Bpri (zona B en primavera) para los fines del presente estudio.
Parámetros Fisicoquímicos del Agua
Se extrajeron muestras de agua, determinándose in situ la temperatura (T°), pH, conductividad eléctrica (mS/cm), salinidad (g/ L), sólidos disueltos totales (g/L), oxígeno di- suelto (mg/L) y transparencia (m) (Exo 2 multiparameter, YSI ®, USA). La transparencia se midió sumergiendo el disco Secchi hasta no tener visibilidad de este, para lo cual se colocó una marca en la cuerda, midiendo la altura. Se determinó la ficocianina (µg/L) y clorofila (µg/L) por el método fluorométrico (Eijkelkamp®, Países Bajos). Los nitratos (mg/L), amonio (mg/L) y amoniaco (mg/L) fueron evaluados únicamente en el invierno (Rice et al., 2017).
Granulometría del Sedimento
Se extrajeron 500 g de sedimento de cada zona y estación para la granulometría. Las muestras fueron secadas al ambiente, analizándose 100 g de cada zona por el mé- todo de sedimentación (Gibbs et al., 1971).
Metales Pesados
Se analizaron 42 MP en total: Plata (Ag), Aluminio (Al), Arsénico (As), Antimonio (Sb), Azufre (S), Boro (B), Bario (Ba), Berilio (Be), Bismuto (Bi), Calcio (Ca), Cadmio (Cd), Cerio (Ce), Cobalto (Co), Cromo (Cr), Cobre (Cu), Hierro (Fe), Galio (Ga), Mercurio (Hg), In- dio (In), Potasio (K), Lantano (La), Litio (Li), Magnesio (Mg), Manganeso (Mn), Molibdeno (Mo), Sodio (Na), Níquel (Ni), Fósforo (P), Plomo (Pb), Selenio (Se), Silicio (Si), Estaño (Sn), Estroncio (Sr), Tantalio (Ta), Teluro (Te), Titanio (Ti), Talio (Tl), Uranio (U), Vanadio (V), Wolframio (W), Zinc (Zn) y Zirconio (Zr). En total fueron 37 en agua de mar, 39 en sedimentos marinos y 37 MP en el tejido muscular de T. chocolata.
- Agua: Se extrajo 500 ml de agua de mar en frascos de polietileno siguiendo el Protocolo Nacional para el Monitoreo de la Calidad de los Recursos Hídricos Superficiales (ANA, 2016). Se añadieron 25 gotas de ácido nítrico en cada frasco para ser sellados y refrigerados para su correcta preservación. Para la determinación de la concentración de MP se empleó el método de espectrometría de masas de plasma de acoplamiento inductivo (ICP-MS) (ICP-Masa: ISO 17294-2.2016, UNE-EN ISO, 2017). Posteriormente, las muestras fueron comparadas con normativa nacional e internacional para la calidad de aguas marino-costeras.
- Sedimento: Se extrajo 500 g de sedimentos de cada zona y estación mediante el uso de la draga Van Veen de 0.04 m2. Para la determinación de MP se empleó el mé- todo de espectrometría de emisión óptica de plasma acoplado inductiva-mente (ICP- OES: EPA Method 6010C.-2007, EPA, 2007). Posteriormente, debido a que el Perú no cuenta con estándares de calidad ambiental para sedimentos marinos, las muestras fueron comparadas con el ECA canadiense y el ECA australiano- neozelandés para sedimentos marinos.
- Thaisella chocolata: Para el análisis de MP se extrajeron 15 individuos de T. chocolata de cada zona y estación aplicándose el método de ICP-OES (EPA Method 6010C.2007, EPA, 2007). Laos resultados fueron comparados con estándares nacionales e internacionales, entre ellos SANIPES (2016), CE (2016), FAO-WHO (2018), ANZFSC (2015), MS (2013), DHO (2004), Villanueva-Fragoso y Paez-Osuna (1996), FDA (2001) y DOH-RSA (2016).
Riesgos en la Salud por el Consumo de Moluscos
Se determinó el riesgo en la salud por el consumo de moluscos.
Ingesta diaria estimada (IDE). La IDE de MPs de T. chocolata se calculó mediante la ecuación: IDE = (C x TICM)/ PC, donde C es la concentración de MP en los tejidos de caracol marino (mg/kg de peso seco); TICM es la tasa de ingestión de caracoles marinos, que es de 0.11 g/día (consumo de alimentos del área de estudio). La determinación del TICM fue cal- culada a partir del consumo humano di- recto global de productos hidrobiológicos (caracol marino de 2020: 38.42 g/año) (PRODUCE, 2021); PC es el peso corporal: 70 kg para adultos y 15 kg para niños.
Riego no carcinogénico. Los cocientes de riesgo objetivo (THQ) se estimaron mediante la proporción de IDE y la dosis de referencia oral (DRf). Si el THQ es superior a 1, es posible que la población expuesta experimente efectos adversos para la salud. La fórmula THQ se expresa de la siguiente manera: THQ = [(FrE * DE * TICM * C) / (DRf * PCP * TM)] x 10-3, donde DE es la duración de la expo- sición (30 años); FrE es la frecuencia de exposición (365 días/año); TICM es la tasa de ingestión de alimentos (g/persona/día); C es la concentración de metales en el caracol (mg/kg); DRf es la dosis de referencia oral (mg/kg/día); PCP es el peso corporal promedio; TM es el tiempo medio para los no cancerígenos (365 días/año, número de años de exposición, suponiendo 30 años). Las dosis de referencia oral (DrF) (mg/kg) de los elementos fueron 0.0003, 0.001, 0.04 y 0.005 para As, Cd, Cu y Se, respectivamente (Qu et al., 2012).
- Índice de peligro (HI). Se calculó en HI para los MP encontrados en las muestras del caracol marino, mediante la siguiente ecuación (Qu et al., 2012): HI=ΣTHQ, donde, THQ es el valor de riesgo estimado para cada metal individual. Cuando el valor de HI es superior a 1, el efecto de riesgo no cancerígeno se considera alto para los consumidores expuestos (Qu et al., 2012).
Imposex
En la estación de invierno se recolecta- ron 85 individuos de T. chocolata en la zona B (Binv) y ninguno en la zona A (Ainv). En la estación de primavera se obtuvieron 68 in- dividuos en la zona A (Apri) y 60 en zona B (Bpri). Los caracoles fueron colocados en coolers para su traslado al Laboratorio de Ecología y Biodiversidad Animal (LEBA), Facultad de Ciencias Naturales y Matemática, Universidad Nacional Federico Villarreal, Lima, Perú. Se determinó la longitud (mm) y el ancho de la conchilla (mm) de los caracoles con un vernier de 0.02 mm de precisión. Luego, se determinó el peso con conchilla y sin conchilla (g), con una balanza analítica digital GR-200, Serie Gemini, Marca A&D de 0.0001 mg de precisión; por último, se extrajeron los tejidos blandos. La caracterización del sexo se realizó bajo microscopio óptico y estereoscopio, mediante el criterio de presencia de glándula de la cápsula y ovarios para los caracoles femeninos; mientras que para los caracoles masculinos se observó la vesícula seminal. Asimismo, se midió la longitud del pene (LP) para machos y para hembras con imposex (Castro y Fillman, 2012, Braga et al., 2018).
El grado de imposex se determinó por medio de los índices de porcentaje de cara- coles femeninos (I%), índice de LP en cara- coles femeninos (FPL), el índice relativo de LP (RPLI), y el índice de secuencia del con- ducto deferente (VDSI). Además, se realizó un ajuste con la longitud de la conchilla (Collado et al., 2010; Castro y Fillman, 2012, Braga et al., 2018). Se establecieron las siguientes cuatro categorías de niveles de IMP usando los resultados del % IMP: ausente (% IMP = cero), bajo (% IMP = 0.1-33%), medio (% IMP =33.1-66%) y alto (% IMP = 66.1-100%) (Ragagnin y Turra, 2022). Se emplearon estadígrafos descriptivos e inferenciales para determinar la significancia comparativa entre las Binv, Apri y Bpri para MLC (media de longitud de la conchilla [mm] de machos), HLC (media de longitud de la conchilla [mm] de hembras), HiLC (media de longitud de la conchilla [mm] de hembras con IMP), MLP (media de longitud del pene [mm] de machos) y HiLP (media de longitud del pene [mm] de hembras con IMP), previo cumplimiento de la normalidad de Shapiro- Wilk, y de la homogeneidad de varianzas con la prueba de Levene.
Se usó el análisis de varianza (ANOVA F) al cumplir con estos dos requerimientos para pruebas paramétricas, y la prueba de Kruskall-Wallis en caso de incumplimiento. Además, la prueba de Tukey para ambos casos. De igual forma, se comparó entre MLC vs HLC, y entre MLP vs HiLP usando la prueba de t de Student. Se realizaron correlaciones de Pearson (rp) y ecuaciones de regresión lineal con su respectivo coeficiente de determinación (R2) entre MLC y MLP, y entre HiLC y HiLP. La prueba de X2 fue empleada para determinar si existían diferencias entre los porcentajes de IMP y las zonas evaluadas. Para el cálculo de los estadísticos se empleó el software PAST v. 4.03 a un nivel de significancia de 0.05.
RESULTADOS
Parámetros fisicoquímicos del agua de mar y granulometría del sedimento
El Cuadro 1 nos muestra los resultados obtenidos en las zonas Ainv y Apri y Binv y Bpri, en función a los parámetros fisicoquímicos del agua de mar, y los porcentajes de granulometría en el sedimento marino, para las mismas zonas y estaciones.
Los parámetros comparables con el ECA-Perú agua Categoría 2, Subcategoría C1; T°, pH, OD, amoniaco y nitratos, cumplen con los valores establecidos en la normativa. Los valores de temperatura presen- tan variaciones menores a 3 °C. De igual manera, el pH oscila entre 7.14 y 7.50, el OD fluctúa entre 8.36 y 9.30, en tanto que el amoniaco y los nitratos mostraron valores bajos en los dos parámetros. Por otro lado, se registraron valores de parámetros no comparables con la normativa vigente como: CE, SAL, SDT, TRANS y amonio. Los valores de estos parámetros denotan pequeñas variaciones y resultados similares entre las zonas A y B, incluso entre estaciones, a excepción de la transparencia del agua, presentan- do una mayor profundidad en Binv y a menor profundidad en Apri. Los resultados para los pigmentos de fitoplancton indican que, la concentración de clorofila-a y ficoeritrina fueron sumamente bajos. El mayor valor para clorofila-a fue en la zona Binv y para ficoeritrina en Bpri.
Los porcentajes de granulometría en el sedimento en la zona A varían entre limo y arena, según estación, primando el limo en invierno; sin embargo, en primavera aumenta el porcentaje de arena y el limo se reduce. Por otro lado, tanto para Binv y Bpri, predominan las estructuras calcáreas (Cuadro 1).
Metales pesados en agua, sedimento y te- jidos de T. chocolata
En el Cuadro 2 se muestran los resulta- dos de los 37 MPs en agua de mar, provenientes de las zonas A y B en las estaciones de invierno y primavera de 2021. Al compa- rar con estándares de calidad ambiental y normativa nacional e internacional para determinar el grado de contaminación del agua marina (Cuadro 3), los MP no sobrepasaron ninguno de los valores de comparación a excepción del B que sobrepasó para Apri y Bpri.
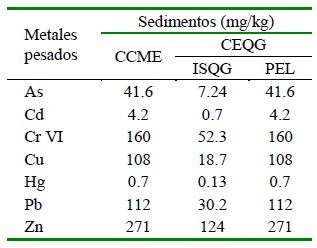
Los 39 MPs (mg/L) en los sedimentos de la zona A y B en las dos estaciones no sobrepasaron los estándares internacionales de la CCME (2022) y de la CEQG (2022) (Cuadros 4 y 5).
El Cuadro 6 muestra 37 MPs en los tejidos de T. chocolata de Binv, Apri y Bpri. Al contrastar con ocho normas internacionales, el As, Cd y Cu y Se presentaron al menos una de las estaciones con valores de MPs por encima de alguna de estas normas. El As en las tres estaciones presentó valores sobre las guías ANZFSC y MS, el Cd sobre las ocho guías internacionales, el Cu para las tres estaciones según lo recomendado por la FAO-WHO, y Se para la guía MS en Bpri (Cuadro 7).
Riesgos en la salud por el consumo de moluscos
La IDE y el riego no carcinogénico en base a THQ y al HI de cuatro metales pesa- dos (As, Cd, Cu y Se) para T. chocolata señalan ausencia de efectos adversos en la salud humana, al ser THQ y HI <1 (Cuadro 8).
Cuadro 1 Parámetros fisicoquímicos del agua de mar y granulometría del sedimento marino de la zona A (Desembarcadero Pesquero Artesanal “El Faro”) y B (a aproximadamente a dos km del DPA) en las estaciones invierno y primavera, distrito de Matarani, provincia de Islay, Región Arequipa, Perú
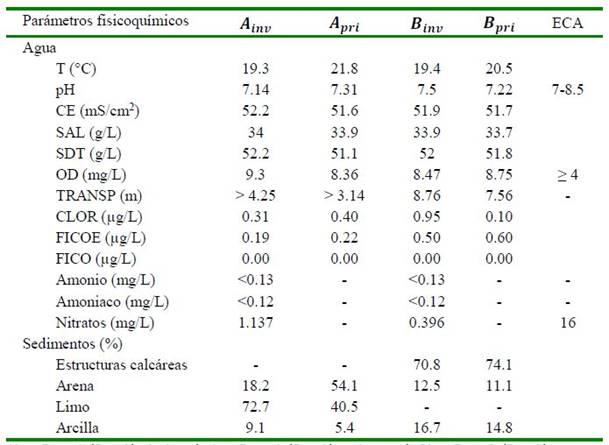
Ainv: Zona A (Estación invierno); Apr: Zona A (Estación primavera); Binv: Zona B (Estación invierno); Bpri: Zona B (Estación primavera); T°: Temperatura superficial del mar; CE: Conductividad eléctrica; SAL: Salinidad; SDT: Sólidos disueltos totales; OD: Oxígeno disuelto; TRANS: Transparencia del agua de mar; CLOR: Clorofila; FICOE: Ficoeritrina; FICO: Ficocianina; ECAagua: Estándar de Calidad Ambiental para Agua en el Perú, Categoría 2: Extracción, cultivo y otras actividades marino-costeras y continentales. Subcategoría C1: Extracción y cultivo de moluscos, equinodermos y tunicados en aguas marino-costeras
Imposex
Los indicadores de IMP en T. chocolata se presentan en el Cuadro 9. La MCL en Binv fue mayor que en Apri y Bpri (H‘=17.62, p<0.05). La HCL en Binv y Bpri fueron mayores que en Apri (H‘=14.28, p<0.05). No se observaron diferencias entre HiLC para Binv, Apri y Bpri (F=0.14, p=0.86; Prueba de Levene, p=0.39). La MLP pre- sentó el siguiente orden: Binv > Bpri > Apri (H‘=52.4, p<0.05). No hubo diferencias entre HiLP para Binv, Apri y Bpri (F=2.05, p=0.18; Prueba de Levene, p=0.06).
Se observaron diferencias entre el MLC y el HCL para toda la muestra de caracoles, siendo HCL más grandes que los MLC (t=2.26, p=0.02). Sin embargo, no hubo diferen- cias entre el MLC y el HCL para Binv (t= 1.27, p=0.21). Tampoco entre el MLC y el HCL para Apri (t=0.62, p=0.53), pero sí entre el MLC y el HCL para Bpri (t=4.05, p=0.0001), siendo mayor en HCL (Cuadro 9). De igual manera, se notaron diferencias entre el MLP y el HiLP (t=8.04, p<0.05). Se encontraron diferencias entre el MLP y el HiLP para Binv (t=15.09, p<0.05), entre el MLP y el HiLP para Apri (t=3.67, p<0.05), y entre el MLP y el HiLP para Bpri (t=6.37, p<0.05) (Cuadro 9).
Cuadro 2 Metales pesados en agua de mar de la zona A (Desembarcadero Pesquero Artesanal “El Faro”) y B (a aproximadamente a dos km del DPA) en las estaciones invierno y primavera, distrito de Matarani, provincia de Islay, Región Arequipa, Perú
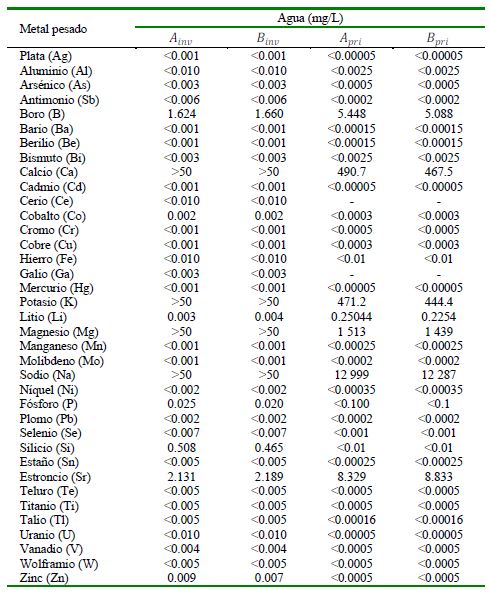
Ainv: Zona A (Estación invierno); Apri: Zona A (Estación primavera); Binv: Zona B (Estación invierno); Bpri: Zona B (Estación primavera)
Cuadro 3 Estándares de calidad ambiental y normativa nacional e internacional para la calidad de agua de mar de la zona A (Desembarcadero Pesquero Artesanal “El Faro”) y B (aproximadamente a dos km del DPA) en las estaciones invierno y primavera, distrito de Matarani, provincia de Islay, Región Arequipa, Perú
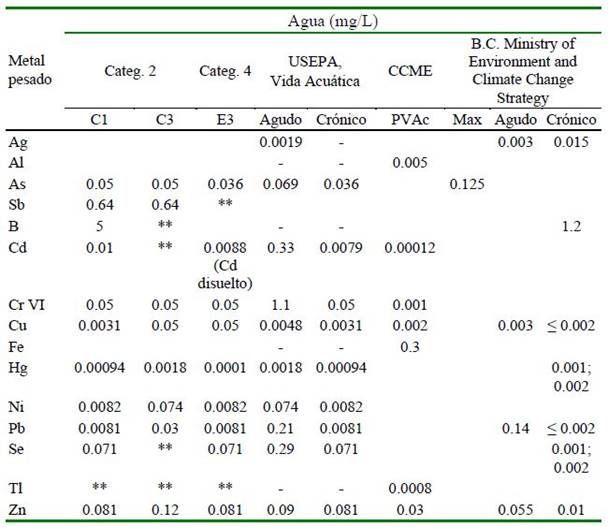
El símbolo ** dentro de la tabla significa que el parámetro no aplica para esta Subcategoría. Agua: Categoría 2: Extracción, cultivo y otras actividades marino-costeras y continentales (Subcategorías: C1: Extracción y cultivo de moluscos, equinodermos y tunicados en aguas marino-costeras; C3: Actividades marino portuarias, industriales o de saneamiento en aguas marino-costeras); Categoría 4: Conservación del ambiente acuático (Subcategoría: E3: Ecosistemas marinos) (El Peruano, 2017); USEPA (2022); CCME (2022); PVac. Protección de la Vida Acuática; B.C. Ministry of Environment and Climate Change Strategy (2021); Max: Máximo WQG (Water Quality Guidelines), Aguda: Aguda a corto plazo, Crónica: crónica a largo plazo)
Cuadro 4 Metales pesados en sedimentos marinos de la zona A (Desembarcadero Pesquero Artesanal “El Faro”) y B (a aproximadamente a dos km del DPA) en las estaciones invierno y primavera, distrito de Matarani, provincia de Islay, Región Arequipa, Perú
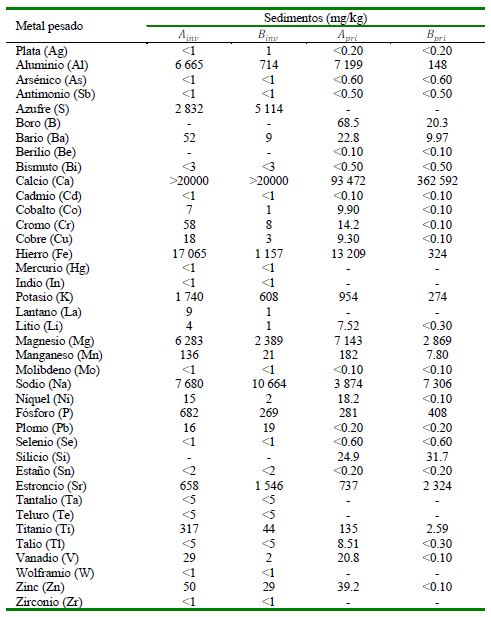
Ainv: Zona A (Estación invierno); Apri: Zona A (Estación primavera); Binv: Zona B (Estación invierno); Bpri: Zona B (Estación primavera)
Cuadro 5 Estándares de calidad ambiental y normativa internacional para metales pesados en sedimentos de la zona A (Desembarcadero Pesquero Artesanal “El Faro”) y B (aproximadamente a dos km del DPA) en las estaciones invierno y primavera, distrito de Matarani, provincia de Islay, Región Arequipa, Perú
Cuadro 6 Metales pesados en tejidos de Thaisella chocolata de la zona A (Desembarcadero Pesquero Artesanal “El Faro”) y B (aproximadamente a dos km del DPA) en las estaciones invierno y primavera, distrito de Matarani, provincia de Islay, Región Arequipa, Perú
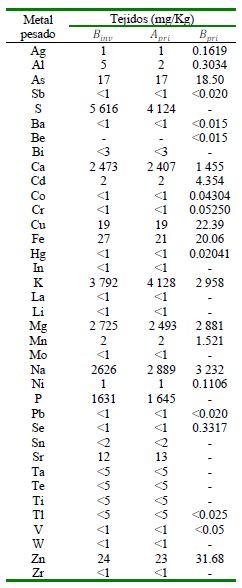
Apri: Zona A (Estación primavera); Binv: Zona B (Estación invierno); Bpri: Zona B (Estación primavera)
Cuadro 7 Estándares de calidad ambiental y normativa nacional e internacional para metales pesados en tejidos de Thaisella chocolata de la zona A (Desembarcadero Pesquero Artesanal “El Faro”) y B (aproximadamente a dos km del DPA) en las estaciones invierno y primavera, distrito de Matarani, provincia de Islay, Región Arequipa, Perú
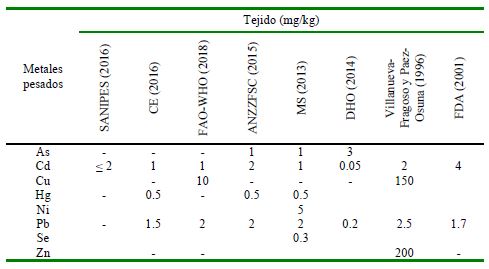
Cuadro 8 Ingesta diaria estimada (IDE) y riego no carcinogénico en base a cocientes de riesgo objetivo (THQs) y al Índice de Peligro (HI) de cuatro metales pesados para Thaisella chocolata de la zona A (Desembarcadero Pesquero Artesanal “El Faro”) y B (aproximadamente a dos km del DPA) en las estaciones invierno y primavera, distrito de Matarani, provincia de Islay, Región Arequipa, Perú
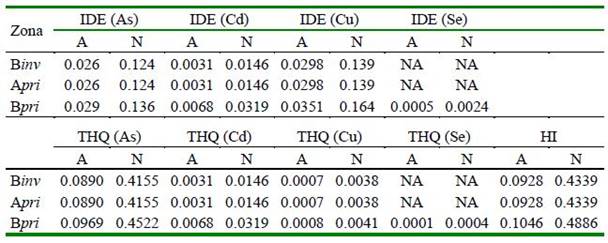
A= Adulto. N= Niño
Cuadro 9 Indicadores de Imposex en Thaisella chocolata de la zona A (Desembarcadero Pesquero Artesanal “El Faro”) y B (aproximadamente a dos km del DPA) en las estaciones invierno y primavera, distrito de Matarani, provincia de Islay, Región Arequipa, Perú
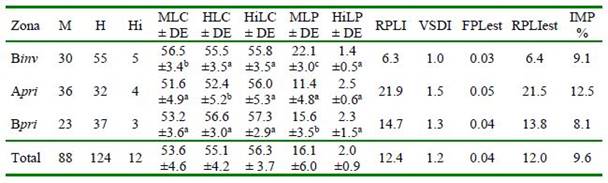
M: machos; H: hembras; Hi: hembras con IMP; LC: media de longitud de la conchilla (mm); LP: media de longitud del pene (mm); DE: desviación estándar; RPLI: índice de la longitud relativa del pene; VDSI: índice de secuencia del conducto deferente; FPLest: índice de la longitud del pene de las hembras estandarizado; RPLI estándar: RPLI estandarizado; IMP %: porcentaje de Imposex.
a,b Letras minúsculas iguales dentro de columnas indican promedios estadísticamente similares (p>0.05)
Los porcentajes de IMP en T. chocolata no fluctuaron significativamente entre Binv, Apri y Bpri (X2=0.33, p=0.84) y fueron catalogados como bajos. El RPLI y el RPLIest presentaron el siguiente orden: Apri > Bpri > Binv (Cuadro 9). El índice de VSDI presentó valores bajos.
MLC y MLP en T. chocolata se encontraron correlacionados en el total de las muestras (rp=0.61, p<0.001), y la ecuación de regresión lineal obtenida no fue significativa (MLP = 0.8067*MLC-27.219; R²=0.38).
MLC y MLP no se encontraron correlacionados en Binv (rp=0.34, p=0.06), y la ecuación de regresión lineal no fue significativa (MLP = 0.3045*MLC+4.852; R²=0.11). La MLC y MLP se encontró relacionada en Apri (rp=0.52, p=0.001), siendo significativa la ecuación de regresión (MLP = 0.5097*MLC-14.905; R²=0.27). Finalmen- te, MLC y MLP también se encontraron re- lacionadas para Bpri (rp=0.42, p=0.049), sien- do significativa la ecuación de regresión, pero con un bajo coeficiente de determinación (MLP = 0.96*MLC+4.852; R²=0.16). HiLC y HiLP no se encontraron relacionados (rp=0.12, p=0.69), y la ecuación de regresión lineal no fue significativa (MLP = 0.0324*MLC+0.1766; R²=0.01).
DISCUSIÓN
Metales pesados en agua y sedimento
Los MP en el agua marina no sobre- pasaron los valores guías de comparación nacional e internacional, a excepción de B que sobrepasó para Apri (5.448 mg/L) y Bpri (5.088 mg/L) según la Categoría 2, C1 (5 mg/L). Se sabe que B es abundante en el océano y es un micronutriente esencial para la biota, en especial para las algas marinas (Carrano et al., 2009; Miller et al., 2016). El B se presenta principalmente en la forma de borato y juega un papel importante en la estabilización de las paredes celulares de las plantas y de las algas marinas mediante el entrecruzamiento con los carbohidratos (Carrano et al., 2009). Sin embargo, es tóxico en altas concentraciones en el ambiente marino, pero no parece que se biomagnifique a través de la cadena trófica (Miller et al., 2016). Valores sobre 1-2 mg/L podrían estar afectando a las comunidades bentónicas acuáticas (Howe, 1998). Las CL50 aguda para los invertebrados acuáticos más sensibles son cercanos a 100 mg B/L con valores a 48 h de exposición que oscila entre 95 y 226 mg/L (Howe, 1998).
Los MPs en los sedimentos de la zona A y B en invierno y primavera no sobrepasaron los estándares internacionales de comparación. Los sedimentos marinos de Matarani mostraron un riesgo ecológico potencial muy bajo para los MPs estudiados (Jolly et al., 2021). Solo el Cu, aunque no sobrepasó los valores guía internacionales para Ainv (18 mg/L) se encontró muy cercano a la ISGQ según la norma canadiense (18.7 mg/L). El Cu es un metal esencial de preocupación ecotoxicológica, pero también es tóxico en altas concentraciones en las zonas costeras marinas contaminadas (Sánchez-Marín, 2020). La contaminación por Cu puede estar asociada a los cambios en la temperatura, salinidad y materia orgánica, y ser un motivo de especial preocupación debido a su presencia en los sitios contaminados; y a su mayor uso como biocida en los cascos de las embarcaciones desde la prohibición a nivel mundial del tributilestaño (TBT), con el aumento de la pesca, el turismo y las visitas de embarcaciones de investigación a la región (Holan et al., 2019).
Metales pesados en T. chocolata
T. chocolata en Binv, Apri y Bpri, acumuló As, Cd y Cu y Se en sus tejidos, los que se presentaron en al menos una de las estaciones con valores de MPs sobre alguna de las ocho normas internacionales de comparación. Las concentraciones de MPs en Binv, Apri y Bpri fueron Cu> As> Cd> Se. En consecuencia, este caracol marino puede acumular diversas cantidades de MPs según su tasa de filtración, tasa de ingestión y calidad del fluido intestinal y pueden adoptar diversos mecanismos de desintoxicación (p. ej., almacenamiento en forma no tóxica o eliminación) (Jolly et al., 2021). La acumulación de MPs en los tejidos musculares de estos caracoles podría tener un efecto directo sobre la salud ecosistémica en la cadena trófica (Jolly et al., 2021).
La presencia de altos niveles de algunos MP como As, Cd y Cu y Se en los tejidos blandos de T. chocolata podría deberse a las funciones centrales del Cu y Se como componentes de biomoléculas metabólicamente importantes, incluidas algunas enzimas, metaloenzimas y pigmentos respiratorios. Específicamente, se sugiere que los tejidos blandos de los caracoles podrían ser estructuras objetivo para Cd y Cu, debido a que sus concentraciones superaron los valores guías internacionales, lo que permite la ocurrencia de procesos de bioacumulación de estos metales pesados. Estos gasterópodos acuáticos generalmente acumulan y almacenan algunos MP y los utilizan en la síntesis de pigmentos como se ha observado en Bellamya bengalensis y en Physella acuta (Al-Warid et al., 2020).
Se ha señalado a esta especie de cara- col como modelo de biaocumulación para siete MP (As, Cd, Cu, Cr, Hg, Pb y Se) en la bahía del Callao, Perú, minerales que sobrepasaron los límites permisibles para MPs según guías internacionales al acumularlos en los tejidos musculares blandos (Iannacone et al., 2022). De igual forma, Condori et al. (2021) encontraron que, en Punta Meca y Santa Rosa e Ite (Perú), que T. chocolata en estadios de juvenil y adulto, superaron los valores guías de As y Cd, con rangos que oscilaron entre 5.39 a 21.14 mg/kg y 0.42 a 1.02 mg/kg, respectivamente. El Cd y As son usados en distintos productos agrícolas, pigmentos, pinturas, entre otros (Londoño-Franco et al., 2016).
El As en los tejidos musculares de T. chocolata presentó valores de 17, 17 y 18.50 mg/kg en las zonas de Binv, Apri y Bpri, respectivamente. Las guías internacionales de ANZFSC y MS señalan que no debe superar a 1 mg/kg. El As es uno de los elementos más tóxicos para los humanos. Se presenta de forma natural en los ecosistemas marinos y debido a la acción antropogénica, este semietal se transfiere a la biota a través de la cadena alimentaria. El factor abiótico clave que influye en la presencia de As en los invertebrados es la contaminación antropogénica, seguido de la ubicación geo- gráfica. Entre los factores biótico-cruciales está la genética de cada especie, incluidos su comportamiento trófico, el hábitat cercano a los sedimentos, las habilidades metabólicas, las actividades fisiológicas de los organismos y los niveles de metales en su hábitat y alimento (Kato et al., 2020). Los resultados sugieren que el potencial de transferencia, bioacumulación y biomagnificación de As en el ambiente marino puede ser favorecido por los hábitos bentónicos, como es el caso de T. chocolata y de diversos factores ambientales (Córdoba-Tovar et al., 2022). Otras especies de gasterópodos marinos como Alviniconcha hessleri, Ifremeria nautilei y Bathymodiolus manusensis pueden acumular a nivel muscular valores similares de As (4.5-43.3 mg/kg) a lo observado en este trabajo (Kato et al., 2020).
El Cu en los tejidos de T. chocolata obtuvo valores de 19, 19 y 22.39 mg/kg en las zonas de Binv, Apri y Bpri, respectiva- mente. Las guías internacionales de la FAO- OMS indican que no se debe superar el valor de 10 mg/kg. Cárdenas et al. (2015) encontraron que T. chocolata sobrepasó los límites del Cu en los bancos naturales en Tancona, y Punta Coles en Moquegua, y en Meca-Lozas en Tacna, Perú, con valores entre 26.02 y 80.4 mg/kg, siendo este último ocho veces más de lo sugerido por FAO- OMS. En los organismos vivos como los caracoles, el Cu actúa como una parte esencial de varias enzimas y es requerido para la síntesis de la hemoglobina. La mayoría de los organismos acuáticos han desarrollado mecanismos para regular las concentraciones de Cu en sus tejidos en presencia de concentraciones variables de Cu en el agua, los sedimentos y los alimentos en el ambiente (Jolly et al., 2021).
El Se sobrepasó el valor guía MS en los tejidos de T. chocolata solamente en la zona Bpri. A pesar de ser un elemento esencial, su exceso puede causar efectos adversos en la biota. La literatura indica que la bioacumulación del Se en los sistemas acuáticos está influenciada en gran medida por factores ambientales, ecológicos y biológicos (Córdoba-Tovar et al., 2022).
Riesgos en la salud por el consumo de moluscos
Los valores de THQ y de HI en base a cuatro metales pesados (As, Cd, Cu y Se) indican que no hay efectos adversos en la salud humana al consumir T. chocolata, dado que THQ y HI fue <1. El valor de HI indica que no hay ningún riesgo potencial no cancerígeno para los consumidores del área de estudio en la zona sur del Perú (Jolly et al., 2021). Los resultados sugieren que este caracol podría estar libre de contaminación y, por ende, se puede consumir sin riesgo de la salud.
Imposex
Los hallazgos demostraron la distribución espacial-temporal en las dos zonas y en las dos estaciones en Matarani, así como la intensidad de IMP en el área de estudio, incluso después de las prohibiciones globales del TBT de 12 años atrás.
Se notaron diferencias significativas entre el MLP y el HiLP en T. chocolata en todos los caracoles. Los porcentajes de IMP fueron catalogados como bajos según Ragagnin y Turra (2022), así como los índices VSDI y RPLIest. Otras investigaciones en este caracol en tres puntos del puerto del Callao obtuvieron LC muy similares para el caso de los puntos cercanos al puerto, a diferencia del LC en el punto más alejado. Con respecto al LP en los machos, se encontró un valor promedio de 10.4 y 11.2 mm para los puntos cercanos y 17.8 mm para el punto más distante (Enrique et al., 2019).
Chumbimune y Ponce (2015) obtuvieron en Ica un porcentaje de IMP mayor (33%) en el otoño en la Isla de San Gayán, ubicada cerca al litoral. No obstante, se han encontrado valores cercanos al 100% en puntos más cercanos a la zona litoral en el Callao y en Miraflores (Lima), con índices de VDSI entre I-IV; sin embargo, en el punto más alejado no se identificaron hembras con imposex (Braga et al., 2018).
Debido a los efectos severos del TBT sobre la vida marina, la legislación internacional ha ido imponiendo gradualmente la prohibición del uso de TBT en las pinturas antiincrustantes. La Organización Marítima Internacional (OMI) en 2001 adoptó la Convención Internacional sobre el Control de Sistemas Antiincrustantes dañinos en las embarcaciones, que entró en vigor en septiembre de 2008 (Rumampuk et al., 2018). Después de esta fecha, ha habido una prohibición mundial sobre el uso de TBT como agente antiincrustante. Los niveles bajos del porcentaje de IMP, los índices VSDI y RPLIest para T. chocolata en Matarani sugieren que, en el caso del sur del Perú, se está aplicando muy recientemente esta normatividad inter- nacional, empleándose al parecer menor cantidad de estas pinturas, ocasionando que los indicadores de imposex sean bajos.
La zona A presenta actividades de des- carga de especies marinas para el consumo, por lo cual hay presencia de embarcaciones pequeñas relacionadas con la pesquería artesanal, en tanto que en la zona B se desarrolla el turismo con recorridos en pequeñas embarcaciones para observar los vertebrados marinos (Ribeiro-Brasil et al., 2021; Uc- Peraza et al., 2022). Estas embarcaciones usualmente no pasan por inspecciones, lo que hace más complejo controlar cualquier uso ilegal de pinturas a base de TBT; a diferencia de la mayoría de grandes embarcaciones que están sujetos a inspecciones periódicas (Ribeiro-Brasil et al., 2021), por lo que se encontraron valores bajos para el porcentaje de IMP (8.11-12.5), VSDI (I y II) y RPLIest (6.46-21.58) y sin diferencias significativas entra las dos zonas. Es así que el fenómeno de IMP parece representar un riesgo limitado para T. chocolata. Además, porque esta especie presenta un desarrollo larvario planctónico y, por lo tanto, la larva migra a sitios menos contaminados para asegurar el reclutamiento de nuevas cohortes poblacionales en los lugares menos contaminados, como sucede con el caracol Nassarius reticulatus (Sousa et al., 2009).
Mattos y Romero (2016) recomiendan el índice de severidad VSDI para T. chocolata; pues proporciona una medida rea- lista de la masculinización y el potencial reproductivo de las hembras de los gasterópodos afectados. Además, representa una estimación de las concentraciones de TBT en el medio marino.
CONCLUSIONES
El boro en el agua marina fue mayor a lo indicado en las normas en las dos zonas en primavera. Los metales pesados no sobrepasaron la normativa en el sedimento.
Los valores de As, Cd y Cu en los tejidos de T. chocolata en todas las zonas evaluadas estuvieron por encima de las normas internacionales de comparación. Se solo fue mayor en una zona.
Se observó una carencia de riesgo no carcinogénico por el consumo de moluscos marinos en base al cociente de riesgo objetivo (THQ) y al índice de peligro (HI) por MP en el caracol marino, sugiriendo ausencia de efectos adversos en la salud.
Los porcentajes de IMP fueron considerados bajos. El RPLI (índice de la longitud relativa del pene), el RPLIest (RPLI estandarizado), y el índice de VSDI (índice de secuencia del conducto deferente) en T. chocolata presentaron una baja severidad.












 uBio
uBio