INTRODUCCIÓN
El color de peces, crustáceos y moluscos juega un papel fundamental en su calidad visual, siendo el rojo el más importante en acuicultura (Costa y Miranda-Filho, 2020). En los crustáceos, el cuerpo rojo después de la cocción es por los carotenoides (Santos- Sanchez et al., 2021), pero estos no los sintetizan y deben ingerirlos con las dietas (Carvalho y Caramujo, 2017; Fuentes et al., 2021) u obtenerlos de la productividad primaria del ambiente natural o los que se generan en los estanques de cultivo (Quintana- López et al., 2019).
Los crustáceos convierten el β-caroteno en astaxantina y lo acumulan en el integumento, el hepatopáncreas, el ovario y el exoesqueleto (Quintana-López et al., 2019; Maoka, 2020). La astaxantina en los crustáceos existe en forma libre, esterificada con ácidos grasos y se combina con proteínas para formar las carotenoproteínas (Costa y Miranda-Filho, 2020), que amplían el rango de colores a verde, azul o púrpura (Maoka, 2020). Sin embargo, el rojo anaranjado característico de la astaxantina se observa después del tratamiento térmico o con solventes (Santos-Sanchez et al., 2021). Además, los pigmentos que dan color al cuerpo de los crustáceos se encuentran en los cromatóforos epidérmicos y en la capa pigmentada del exoesqueleto (Jittivadhna et al., 2010), cuya dispersión dependen de las hormonas del pedúnculo ocular, del tejido nervioso extra peduncular (Katayama et al., 2013) y muchas veces del color del sustrato (Aréchiga- Palomera et al., 2018).
Los genes de crustacianina localizados en la capa externa de la hipodermis regulan la mayor diversidad de colores observados en los crustáceos malacostráceos (Wade et al., 2012). Los carotenoides en los crustáceos son antioxidantes, potenciadores inmunológicos, contribuyen con la reproducción (Maoka, 2020), protegen contra los rayos UV, participan en las señales y en la resistencia al estrés termal (Tizkar et al., 2014; Stevens, 2016; Bernal et al., 2017). En cambio, la decoloración del cuerpo de los crustáceos es un signo de enfermedad (Pillai y Bonami, 2012).
La muda en todo crustáceo afecta la reproducción, el crecimiento, el comportamiento y la composición de nutrientes (Lemos y Weissman, 2021). En algunos crustáceos, el patrón del color del cuerpo no varía durante el ciclo de muda, como en Rhynchocinetes typus (Gallardo-Escárate et al., 2007). Sin embargo, el color de la hipodermis en Carcinus maenas es intenso en la intermuda y premuda debido al incremento de carotenoides (McGaw et al., 1992; Lee y Vespoli, 2015; Stevens, 2016). Asimismo, en Panulirus homarus, la concentración de carotenoides en el exoesqueleto, el hepatopáncreas y el músculo es más alta en la intermuda y la premuda, pero es baja en la postmuda (Asha, 2003), en tanto que en el camarón adulto Cryphiops caementarius Molina, 1782, no está claro si el color del cuerpo varía con el ciclo de muda, aunque observaciones previas parecen indicar dicha relación. Se sabe que hay pérdida del color del cuerpo por la ablación de ambos pedúnculos oculares (Reyes-Avalos et al., 2010), por la regeneración de quelípodos (Reyes et al., 2017) y debido a deficiencias de carotenoides en la dieta artificial, pero puede suplirse con pigmentos naturales (Reyes-Avalos, 2016; Fuentes et al., 2021).
El color del cuerpo de C. caementarius adulto es verde-amarillento con manchas marrón-amarillento en el torso (Moscoso, 2012), también es café-verdoso oscuro, en la porción anterior como posterior, pero es más clara en las regiones laterales (Meruane et al., 2006). Esta variación en el color del cuerpo se observa en camarones de las capturas comerciales y no se conoce si difiere entre sexos. Además, el color proporciona estándares de calidad para la comercialización, el precio y la demanda del consumidor (Lim et al., 2018), la que se establece al hervir camarones y observar el cambio de color del cuerpo (Angell et al., 2018).
El camarón C. caementarius tiene importancia económica (Pinazo et al., 2021), dado a que abunda en los ríos de la costa sur del Perú (Wasiw y Yépez, 2015). La extracción de esta especie alcanzó en 2019 las 1122 t (PRODUCE, 2020) que permitió atender la demanda en la gastronomía peruana. Actualmente, hay interés por el cultivo comercial de esta especie de camarón, por lo que conocer las causas de la variación del color del cuerpo permitirá hacer un buen uso de los pigmentos naturales en la dieta para crecimiento y reproducción. Por consiguiente, el objetivo fue evaluar la variación del color del cuerpo del camarón C. caementarius durante el ciclo de muda.
MATERIALES Y MÉTODOS
Colecta, Sexado y Biometría
Los camarones fueron colectados al azar de las capturas comerciales que se realizan en el río Pativilca (Lima, Perú) a la altura del Centro Poblado Huayto (10º39’ S, 77º40’ W), e inmediatamente se colocaron dentro de cajas térmicas conteniendo hielo triturado. El transporte terrestre hasta el laboratorio duró 4 h.
Los camarones fueron reconocidos con clave taxonómica (Méndez, 1981). El sexo se verificó por la presencia de un gonóporo en cada coxa del tercer (hembras) y quinto (machos) par de periópodos. Los camarones fueron pesados (4.10 a 18.28 g) en balanza digital (Adam AQT600 ± 0.1 g) y la longitud total (desde la escotadura postorbital hasta el extremo posterior del telson) fue medida (5.25 a 8.52 cm) con vernier digital (Truper ± 0.01 mm) con los animales posicionados ventralmente.
Estados de Muda y Procesado
Los estados de muda fueron determinados examinando el borde interno del exopodito de los urópodos, con microscopio óptico (Silva et al., 2019). La consistencia del cefalotórax de camarones crudos fue evaluada al tacto, considerándose los siguientes grados: muy blando (flácido), blando, ligeramente duro y duro (rígido en todos sus lados). Los camarones machos (n = 50) y hembras (n = 37) fueron clasificados por estados de muda, siendo evaluados inicialmente en crudo y después hervidos en agua a 100 °C por 2 min (Wade et al., 2012).
Sistema de Captura de Imágenes Digitales
El sistema de iluminación y fotografiado consta de una caja de cartón (60 x 45 x 40 cm), cuyo interior fue forrada con cartulina negra y reforzada con un marco de madera.
En la parte superior de la caja, a una altura de 30 cm, se colocó una lámpara fluorescente (Phillips TL40W/54RS) en un ángulo de 70° con respecto a la superficie blanca opaca, sobre la que se colocó al camarón para obtener una intensidad luminosa de 1420 lux (Luxómetro Extech Light Meter ± 5%). Además, una cámara digital (Nikon 10X con resolución de 1600 x 1200 pixeles) se ubicó en el centro de la parte superior de la caja para capturar una imagen en color (JPEG) del camarón. Estas condiciones permanecieron sin cambio durante el proceso de recolección de datos.
Análisis de Imágenes Digitales
El análisis de la imagen digital del cuerpo del camarón se realizó en dos áreas (~2 mm2) donde el color es uniforme: 1) la zona dorsal y central del segundo segmento abdominal y 2) la zona dorsal y central del extremo posterior del cefalotórax. La imagen digital se analizó con el modo de color RGB (rojo, verde y azul, por sus siglas en inglés) del programa Adobe Photoshop CS6. El valor del RGB varía entre 0 y 255. El valor de 255 en RGB representa al blanco y el valor de 0 en RGB al negro. El color puro (rojo, verde o azul) es 255 para ese color en particular y 0 para los otros dos, así, 255-0-0 es rojo, 0-255-0 es verde y 0-0-255 es azul. Los valores del RGB se introdujeron en un convertidor de colores disponible en la web (https://www.nixsensor.com/free-color-converter/), cuya combinación permitió asignar un tono de color del camarón.
Análisis Estadístico
Los datos del valor RGB de camarones en diferentes estados de muda se sometieron a la prueba de Shapiro-Wilk para determinar la normalidad, y luego se realizó un análisis de varianza de una vía y se aplicó la prueba de Tukey (p<0.05). Los análisis estadísticos se efectuaron con el software SPSS v. 25 para Windows.
RESULTADOS
Camarones Machos
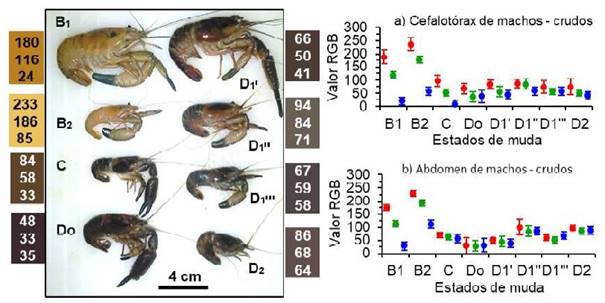
En el camarón macho crudo (Figura 1), los valores RGB del cuerpo (cefalotórax y abdomen) en la postmuda B1 fueron diferentes (p<0.05) de aquellos en la postmuda B2, siendo alta en el rojo (175 - 236), intermedio en el verde (113 - 193) y baja en el azul (19- 112), donde la combinación de valores pro- dujo un tono amarillento. En la intermuda, así como en la premuda (Do - D2) los bajos valores del RGB fueron similares e indicaron un tono marrón oscuro (Figura 1a, b). En la postmuda, los valores del rojo y verde fueron más altos (p<0.05) que en la intermuda y premuda. Los quelípodos fueron largos, grue- sos y tuvieron los mismos colores que el del cuerpo, aunque el dáctilo y el dedo fijo fueron azul. El cefalotórax de los camarones machos crudos fue de consistencia dura desde intermuda hasta la premuda D2, en cambio, en la postmuda B1 fue ligeramente blando y en B2 ligeramente duro.
En el camarón macho, luego de la cocción (Figura 2), los valores RGB del cuerpo en la postmuda B1 fueron diferentes (p<0.05) a aquellos en la postmuda B2 y solo el valor del rojo fue alto (196 - 252), en tanto que los valores del verde fueron bajos (75 - 127) y más aún el azul (9 - 19), lo que produjo un tono anaranjado. En cambio, en la intermuda y en la premuda (Do - D2), el valor del rojo también fue alto (p<0.05) y los valores del verde y azul (21 - 53) fueron bajos y similares (p>0.05), lo que produjo un tono rojizo (Figura 2a, b).
Camarones Hembras
En el camarón hembra crudo (Figura 3), los valores RGB del cuerpo en la postmuda (A2 - B2) fueron intermedios en el rojo (62- 139) y diferentes (p<0.05) que el verde, que fue bajo (15 - 45) y muy bajo en el azul (6 -23), lo que produjo un tono marrón claro. En la intermuda y en la premuda (Do - D3) los valores RGB fueron bajos y similares, lo que produjeron un tono marrón oscuro, con excepción del subestado D2, cuyo RGB (68 - 37 - 17) produjo un tono marrón claro (Figura 3a, b). Los quelípodos fueron cortos, delgados y tuvieron los mismos colores que el del cuerpo, aunque el dáctilo y el dedo fijo fueron azules. El cefalotórax de los camarones crudos fue de consistencia dura desde intermuda hasta la premuda D2 y en D3 fue ligeramente blando, mientras que en postmuda A2 fue blando, en B1 fue ligeramente blando y en B2 ligeramente duro.
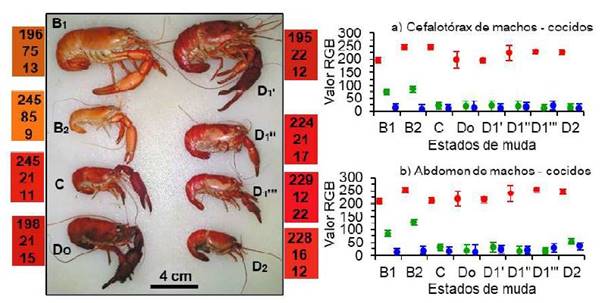
Figura 2 Izquierda: Color del cuerpo de Cryphiops caementarius machos después de la cocción, según estados de muda. Los. números de los rectángulos de colores son el RGB promedio entre el cefalotórax y abdomen. Derecha: Valor RGB (promedio ± desviación estándar) del cefalotórax (a) y del abdomen (b)
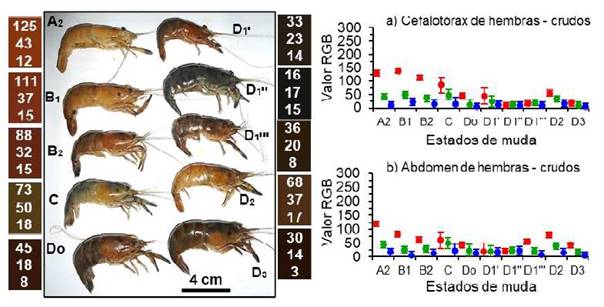
Figura 3 Izquierda: Color del cuerpo de Cryphiops caementarius hembras crudos, según estados de muda. Los números de los rectángulos de colores son el RGB promedio entre el cefalotórax y abdomen. Derecha: Valor RGB (promedio ± desviación estándar) del cefalotórax (a) y del abdomen (b)
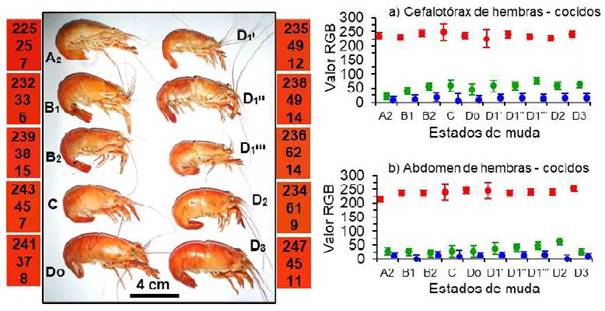
Figura 4 Izquierda: Color del cuerpo de Cryphiops caementarius hembras después de la cocción, según estados de muda. Los números de los rectángulos de colores son el RGB promedio entre el cefalotórax y abdomen. Derecha: Valor RGB (promedio ± desviación estándar) del cefalotórax (a) y del abdomen (b)
En los camarones hembras, después de la cocción (Figura 4), los valores RGB del cuerpo en todos los estados de muda (Figura 4a, b) fueron altos en el rojo (215 - 252) y diferentes (p<0.05) al del verde (21 - 76) y azul (2 - 17) que fueron similares, lo que produjo un tono anaranjado intenso.
DISCUSIÓN
El modo de color RGB se utiliza para determinar el color natural de la langosta Homarus americanus, porque en la medición del color, el valor RGB rastrea el color como es percibido por el humano (Tlusty, 2005). En consecuencia, el sistema de medición del color del cuerpo de C. caementarius, crudo y cocido, muestra el color como fue percibido en las condiciones de la investigación.
El color del camarón C. caementarius procedente del río es café-verdoso oscuro (Meruane et al., 2006) o verde-amarillento (Moscoso, 2012), que puede ser causado por el tipo de alimento predominante en el hábitat. En los ríos, esta especie de camarón se alimenta de detritus, microalgas y de restos de vegetales, así como de larvas de insectos y partes de invertebrados, cuya abundancia y disponibilidad varía con el rango altitudinal (Viacava et al., 1978). Los alimentos vegetales aportan los carotenoides (Valduga et al., 2009) que mantienen la pigmentación del cuerpo (Fuentes et al., 2021). Sin embargo, en este estudio, el color del camarón varió con los estados del ciclo de muda, lo que explica lo observado en las capturas comerciales. Además, es indicativo de que la dieta natural no es determinante para el color del cuerpo.
En C. caementarius machos crudos en intermuda y en premuda, el tono marrón oscuro del cuerpo sugiere acumulación de carotenoides, como ocurre en los machos de
C. maenas, donde el color de la epidermis es más intenso en la intermuda y premuda, debido al aumento de carotenoides (McGaw et al., 1992). Además, el color de C. caementarius en la intermuda y premuda es similar con lo informado por Rojas et al. (2012) para machos de la misma especie, aunque no se informa del estado de muda, pero lo utilizan para definir morfotipos. La presente investigación evidencia de que el color del cuerpo del camarón macho crudo no se debe a los morfotipos, sino que varía según los estados de muda. Esto se suma a lo reportado de que el color de los quelípodos regenerados después de una muda es más tenue que el color original (Reyes et al., 2017).
En cambio, el tono amarillento o marrón claro del cuerpo de C. caementarius macho crudo en la postmuda indica pérdida de carotenoides, debido probablemente a la movilización previa para almacenarse en algún tejido, aunque parte de estos pigmentos se pierden con la exuvia. El cuerpo rojo de C. maenas cambia a verde después de la muda (Lee y Vespoli, 2015). En P. homarus, la concentración de carotenoides del cuerpo se reduce después de la muda y que, sumado al cese de la alimentación, a la pérdida de pigmentos con la exuvia y a la movilización a otros tejidos, ocasionan valores más bajos de carotenoides y se atenúa el color del animal (Asha, 2003). Esto explica el color tenue del cuerpo de C. caementarius durante la postmuda, pues la especie deja de alimentarse en la premuda tardía, la ecdisis y la postmuda temprana (Reyes, 2014), como sucede en todo crustáceo (Lemos y Weissman, 2021).
El color del cuerpo de C. caementarius macho después de la cocción permitió observar los tonos anaranjado (postmuda) y rojizo (intermuda y premuda), característicos de la astaxantina. En la postmuda tardía (B1 y B2), el tono anaranjado es evidencia de la disminución de pigmentos en la hipodermis y que no hubo reposición inmediata después de la ecdisis, pues con el exoesqueleto liberado también se pierden pigmentos. En Clibanarius erythropus los carotenoides de la hipodermis disminuyen en la postmuda temprana (A1 y A2) y aún más en la postmuda tardía (B1 y B2), debido a la transferencia al hepatopáncreas (Castillo et al., 1988). Así mismo, en P. homarus, Asha (2003) determinó que el reordenamiento del tegumento después de la ecdisis afecta el patrón de pigmentación, lo que provoca movilización de carotenoides para la formación del nuevo tegumento. Sin embargo, el tono rojizo del cuerpo de C. caementarius en la intermuda y premuda indica que hubo restablecimiento de los carotenoides provenientes de los lugares de almacenamiento y también por la ingestión de pigmentos naturales contenidos en el alimento. En esta especie de camarón la ingesta de alimentos se reanuda en la postmuda tardía (Reyes, 2014) y los pigmentos naturales de la dieta se acumulan en el cuerpo del animal (Fuentes et al., 2021). Además, en C. erythropus hay transferencia de pigmentos del hepatopáncreas hasta el integumento, desde la postmuda B2 hasta la premuda D2 (Castillo et al., 1988). Así mismo, P. homarus mantiene alta concentración de carotenoides en el exoesqueleto y en el músculo en la intermuda y premuda, seguido de disminución en la postmuda (Asha, 2003).
La variación del color del cuerpo durante el ciclo de muda de los camarones machos de C. caementarius indica que esta no es una característica permanente del dimorfismo sexual, pero puede ser parte del comportamiento reproductivo de la especie. El color de las quelas de Neohelice granulata reduce la necesidad de luchar con competidores (Casariego et al., 2011), debido a que el color es importante en las interacciones competitivas entre machos (Dyson et al., 2020). En este sentido, el color más intenso del cuerpo y de los quelípodos de los camarones machos de C. caementarius en la intermuda y premuda podría ser una ventaja para competir durante la búsqueda de hembras maduras y lograr apareamientos, como ha sido sugerido en esta especie (Rojas et al., 2012) y en Dilocarcinus pagei (Pontes et al., 2020). Sin embargo, no se conoce si la especie en estudio es capaz de percibir el color de sus congéneres, como en Uca mjoebergi (Detto, 2007; Dyson et al., 2020) y U. capricornis (Detto et al., 2008).
La pérdida de color del cuerpo de los camarones machos de C. caementarius en la postmuda sería indicador de una nula o débil capacidad para la interacción y el cortejo, situación que asegura que sus congéneres, de igual o diferente tamaño, puedan tener la oportunidad de aparearse. Los machos Macrobrachium rosenbergii en postmuda son incapaces de proporcionar protección a las hembras tras la muda pre-apareamiento (Karplus y Barki, 2018). Así mismo, el tenue color del cuerpo del macho C. caementarius después de la ecdisis indica limitaciones para el camuflaje, la interacción y el apareamiento, pero es probable que la acumulación de carotenoides en determinados órganos o tejidos se realiza para mantener funciones vitales en etapas críticas; por ejemplo, al final de la premuda, durante la ecdisis y el inicio de la postmuda, donde el exoesqueleto es muy frágil y el movimiento es dificultoso (Reyes, 2020; Lemos y Weissman, 2021). Se conoce que los carotenoides, en P. monodon, mantienen la salud del animal (Wade et al., 2015a) y en M. nipponense otorga resistencia al estrés físico y químico del ambiente (Tizkar et al., 2014).
La tonalidad oscura del color del cuerpo de los machos de C. caementarius crudos es lo que produce coloración rojiza más intensa después de la cocción, lo que es evidencia de que el color del camarón crudo es indicador del contenido de carotenoides, como se demostró previamente en la misma especie (Fuentes et al., 2021) y también en Litopenaeus. vannamei, Penaeus monodon, Exopalaemon carinicauda y Fennero- penaeus chinensis (Aguirre-Hinojosa et al., 2012; Jantakoson et al., 2012; Su et al., 2018). Además, según los resultados obtenidos, es posible clasificar o seleccionar camarones crudos por el color del cuerpo con fines comerciales, pues desde una perspectiva empresarial, el color juega un papel decisivo en la evaluación y determinación de la calidad del producto (Lim et al., 2018). Sin embargo, esto no sucedió con los camarones hembras que fueron sometidos a cocción, lo que debe ser característica de esta especie. En L. vannamei, el color del cuerpo es similar en machos y hembras, crudos o cocidos (Parisenti et al., 2011); en cambio, en las hembras de C. maenas la fase roja del cuerpo cambia a la verde con la muda (Lee y Vespoli, 2015).
La acumulación de carotenoides en los tejidos de los crustáceos no solo indica que estos animales pueden interconvertir un carotenoide en otro, sino también implica que ciertos carotenoides tienen funciones específicas en algunos tejidos (Wade et al., 2015b). En el hepatopáncreas, el estómago, corazón, hipodermis, pedúnculo ocular y en el cordón nervioso existe información genética sobre el metabolismo de los carotenoides (Jin et al., 2020). El color del cuerpo de C. caementarius, tanto crudo como cocido, varía con el ciclo de muda, y es más intenso en los machos que en las hembras. Estos resultados indican que los carotenoides de la hipodermis y de la cutícula del exoesqueleto de los camarones machos son, respectivamente, metabolizados y perdidos durante el proceso de muda, como sucede en P. homarus (Asha, 2003).
Por otro lado, el color del cuerpo de las hembras de C. caementarius cocidas, a diferencia de los machos, mantuvieron solo el tono anaranjado en todos los estados de muda, lo que indica que la hipodermis y la cutícula del exoesqueleto no son lugares de almacenamiento de carotenoides para uso posterior, pero por el tenue tono de color del cuerpo deben cumplir otras funciones, como evitar la fotoxidación en el hepatopáncreas y el ovario (Flores y Chien, 2011). El hepatopáncreas de las hembras es el principal órgano de almacenamiento de carotenoides desde donde se transfiere hacia el ovario para almacenarse en los ovocitos y mejorar la calidad y viabilidad de los huevos desovados, como sucede en P. homarus (Asha, 2003), P. vannamei (Quintana-López et al., 2019; Maoka, 2020), Lysmata wurdemanni (Díaz-Jiménez et al., 2019), Emerita asiatica (Persia et al., 2019), entre otros crustáceos. Esto puede explicar la uniformidad del color del cuerpo de las hembras de C. caementarius, crudo o cocido, durante el ciclo de muda.
CONCLUSIONES
El color del cuerpo del camarón Cryp- hiops caementarius macho varía con el ciclo de muda. En el camarón crudo, el tono amarillento o marrón claro se observó en la postmuda y el marrón oscuro en la intermuda y premuda; en cambio, después de la cocción, el tono anaranjado se observó en la postmuda y el rojizo en la intermuda y premuda.
En el camarón C. caementarius hembra, el color del cuerpo es similar durante el ciclo de muda. En el camarón crudo, el tono marrón claro se observó en la postmuda y el marrón oscuro en la intermuda y premuda; sin embargo, una vez cocido el tono anaranjado se observó en todos los estados del ciclo de muda.












 uBio
uBio