INTRODUCCIÓN
La calidad de un alimento es un concepto complejo que integra diversos factores como inocuidad, propiedades nutricionales, disponibilidad, frescura, características físicas como tamaño, peso, etc. Inclusive hay relaciones entre la calidad de nutrientes presentes en estos recursos y el cambio climático evidenciando lo dinámico de este concepto (Abbas et al., 2008, Shalders et al., 2022). En el caso de los recursos hidrobiológicos, la frescura es el principal indicador de calidad para su comercio (Prabhakar et al., 2020). Esta frescura en los recursos marinos depende de los cambios físicos, químicos, microbiológicos y bioquímicos que ocurren post mortem durante el almacenamiento, reflejándose en una pérdida progresiva de las características sensoriales como el sabor (Nielsen et al., 2002; Prabhakar et al., 2020).
En diversos métodos de análisis como el IQM, se busca obtener relaciones lineales de la calidad y el tiempo de almacenamiento de los recursos pesqueros, calidad que se encuentra basada en descriptores sensoriales, fisicoquímicos, etc. (Bernardo et al., 2020).
La pesquería de calamar gigante (Dosidicus gigas) es la segunda más importante después de la anchoveta, en términos de volumen así como en ingresos de divisas. Entre los años 2010 y 2019, el desembarque promedio ha sido de casi 430 000 toneladas (t) anuales, llegando a un máximo de 556 000 en 2014 (Produce, 2020). Además, el Perú ha producido más del 50% de los desembarques mundiales de este recurso; sin embargo, en las últimas temporadas, este porcentaje ha ido disminuyendo (FAO, 2020; Rovegno, 2021).
En el caso del calamar gigante o «pota» (Dosidicus gigas) no se dispone de un parámetro químico o microbiológico que pueda utilizarse como indicador de frescura durante el almacenamiento. El reglamento CE 1022/2008 (EUR-Lex, 2008) establece valores límites de nitrógeno básico volátil total (N- BVT) para especies frescas, refrigeradas o congeladas en pescados, los cuales se encuentran entre 20 y 35 mg de nitrógeno/100 g como indicador de aceptación. No obstante, en especies de calamares pequeños como Illex illecebrosus, Loligo vulgaris, Sepia officinalis y Todarodes pacificus, se ha evidenciado que indicadores como el N-BVT son bajos al inicio y podrían evidenciar deterioro del manto de calamar a diferentes temperaturas (Vaz-Pires et al., 2008; Sykes et al., 2009; Parlapani et al., 2018).
Los valores de N-BVT reportados por la industria mexicana en calamar gigante recién capturado corresponden a cifras mayores a 100 mg/100 g (Carrizoza, 2002; Zaragozá et al., 2015), lo cual excede el límite máximo del reglamento CE 1022/2008. Asimismo, Márquez-Ríos et al. (2007) determinaron un valor de 243.7 mg/100 g en calamar gigante fresco, llegando a 278.8 mg/100 g después de 15 días en almacenamiento a 0 °C, generando confusión durante el comercio.
Albrecht et al. (2005) y Ordoñez y Plácido (2004) evaluaron otros análisis químicos y físicos en filetes de manto de calamar gigante, determinando nitrógeno de trimetilamina (N-TMA), olor crudo y aspecto de la piel. Asimismo, Ohashi et al. (1991) y Márquez-Ríos et al. (2007) desarrollaron una serie de análisis en busca de un indicador de deterioro en calamar (Loligo gayi) y calamar gigante, respectivamente, refiriéndose a la relación de hipoxantina/adenosin monofosfato (Hx/AMP) como posible respuesta en cualquier tipo de calamar. Ante esto, el objetivo de este trabajo fue evaluar, comparar y relacionar los cambios sensoriales, químicos y microbiológicos la calidad en manto de calamar gigante en almacenamiento a 0 y 5 ºC.
MATERIALES Y MÉTODOS
Procedencia de muestra, medidas biométricas y condiciones de almacenamiento
Los especímenes del estudio de calamar gigante (Dosidicus gigas) fueron capturados en Piura (norte del Perú) en septiembre de 2014. Los especímenes fueron transportados por vía aérea en cajas isotérmicas en contacto directo con hielo. La temperatura de recepción fue de 0 °C en la planta piloto del Instituto Tecnológico de la Producción (Callao, Perú) después de 29 h de captura (Figura 1). Cada manto fue pesado (balanza electrónica de 50 kg, sensibilidad 0.005 kg) y se le tomó la longitud mediante una wincha Karson (alcance 5 m) en el área de recepción.
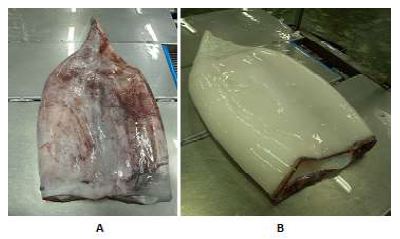
Figura 1 Mantos de calamar gigante Dosidicus gigas con piel (a) y sin piel (b) en la Planta Piloto del Instituto Tecnológico de la Producción - ITP (Callao, Perú)
Las áreas de trabajo fueron lavadas y desinfectadas. El proceso de retiro de la piel se realizó de forma manual por operarios experimentados en el trabajo con calamar gigante. Ocho especímenes eviscerados fueron seleccionados al azar, quedando cuatro con piel (CP) y a los otros cuatro se les retiró la piel (SP). Los mantos de calamar gigante fueron envasados en bolsas de polietileno de 20x30" y de alta densidad (90 µm) en forma individual. Cuatro unidades, 2 CP y 2 SP fueron almacenados a 0 ± 1 ºC en cajas isotérmicas con hielo durante 19 días, y los otros 2 CP y 2 SP se mantuvieron en refrigeración a 5 ± 1 °C durante 8 días.
El tiempo desde la captura, transporte y recepción en el ITP (29 h) no fue tomado en cuenta, ya que sería el tiempo promedio máximo que se realiza al llegar a planta desde la zona de captura, por lo que se asumió como un tiempo basal para todas las unidades de manto en estudio. Tampoco se desarrolló un plan de muestreo de mantos de calamar gigante por las dificultades de acceso a la captura así como las condiciones ideales de trabajo. Para la toma de muestra, en cada fecha estipulada, se tomó una porción de manto en cada tipo de almacenamiento mediante condiciones estériles.
Para los análisis químicos, microbiológicos y sensoriales se tomaron 100 g en condiciones estériles, utilizándose 20 g (10 g/análisis) para los análisis microbiológicos, 20 g (10 g/análisis) para los análisis químicos y 60 g (10 g/análisis) para el análisis sensorial.
Análisis Sensorial
Seis jueces capacitados según los lineamientos de Codex (1999) evaluaron el olor de la muestra cruda, y sabor/olor de la muestra cocida. El desarrollo de la cocción fue en filetes de 10 g de manto colocados en bolsas para sellado al vacío. Las bolsas fueron selladas y colocadas en baño de vapor por 10 minutos. Los días evaluados en la condición a 0 °C fueron 0, 5, 7, 9, 12, 14, 16 y 19 y a 5 °C a los 0, 2, 4, 6 y 8 días. Se utilizó una escala descriptiva de cinco (Cuadro 1).
Análisis Químicos
Análisis proximal
La composición química proximal (CQP) fue determinada con técnicas analíticas adaptadas por Albrecht et al. (2017). El contenido de humedad se obtuvo mediante secado al horno de muestras a 102 ± 1 ºC y el contenido de cenizas en un horno de mufla a 600 °C, ambos hasta llegar a un peso constante. Para determinar el contenido de grasa, se usó el equipo Soxtherm® (C. Gerhardt, Alemania), usando hexano. La proteína se determinó a través de la metodología Kjeldahl, multiplicando el contenido total de nitrógeno por 6.25. Este análisis solo se desarrolló el día de recepción de los mantos.
Cuadro 1: Descripción de la escala de evaluación sensorial del manto de calamar gigante (Dosidicus gigas)4,5
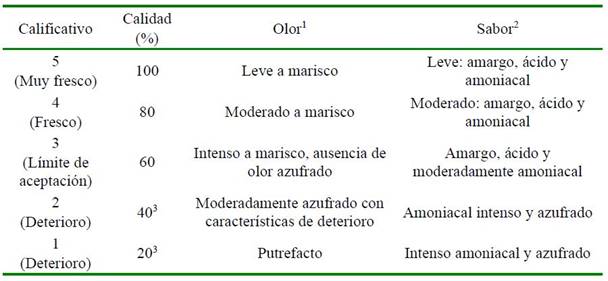
1 Muestras cruda y cocida. Los registros se desarrollaron por separado. 2 Muestra cocida. 3 La muestra en estado de deterioro presentó mucosidad en la superficie del músculo. 4 Para el valor de aceptabilidad total se utilizó la mediana del valor de todos los atributos sensoriales. 5 Fuente propia
Cuadro 2. Análisis sensorial de manto de calamar gigante (Dosidicus gigas) con piel (CP) y sin piel (SP) almacenados a 0 y 5 °C durante diversos periodos de tiempo
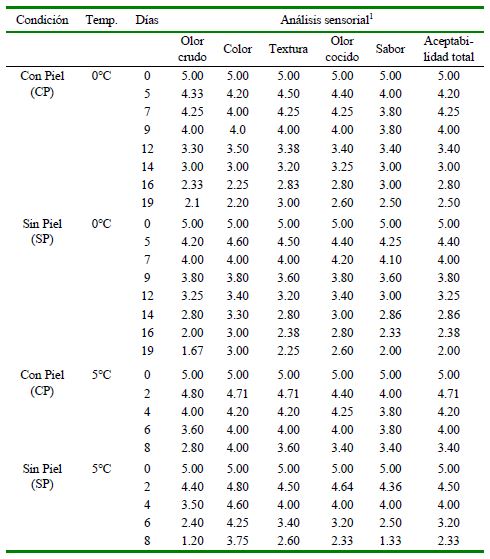
1 Calificación de 1 a 5, donde 1= Muy fresco y 5= deteriorado
Se pesaron 5 g del músculo homogeneizado y se agregó 45 ml de agua desionizada. El pH fue determinado con un electrodo Sensorex (SENX-PM1000, USA) para muestras semisólidas acoplado a un potenciómetro Mettler Toledo Seven Easy S20K (Schwerzenbach, Suiza).
Extracto desproteinizado
Se tomaron 10 g a partir de la muestra del músculo de calamar gigante de zonas aleatorias del manto según cada condición, y se agregó ácido tricloroacético al 5% (1:4), dejando en reposo durante 2 h en refrigeración. Se filtró en papel Whatman #1 y se aforó en fiola de 50 ml con ácido tricloroacético al 5% (las condiciones ácidas, alrededor de pH 2 generan precipitación de las proteínas, pero no de los compuestos nitrogenados de bajo peso molecular como el nitrógeno de TMA, BVT, aminas biogénicas y nucleótidos). Se almacenó en frascos herméticos de plástico a -20 °C hasta el análisis de N-TMA, N-BVT, nucleótidos y aminas biogénicas. Todos los análisis se realizaron por duplicado N-BVT y N-TMA fueron determinados mediante el método de microdifusión de Conway, adaptado por Vigo et al. (2013) en cámaras Conway. Se tomó 1 ml del extracto desproteinizado, 1 ml de carbonato de potasio al 50% p/v en cada extremo de la cámara, y en la zona central se dispuso un pequeña placa de aluminio con 1 ml de la solución de ácido bórico. Antes de cerrar la cámara Conway se adicionó 500 µl de formaldehído al 20% para determinar N-TMA, mientras que para N-BVT se obvió el formaldehído. Se incubó la placa por 2.5 h / 37 °C. Se tituló con HCl 0.01 o 0.05N al ácido bórico presente en el centro de la cámara con el uso de una microbureta automática (Metrohm). Se expresó en mg de N-TMA/100 g de muestra o mg de N-BVT/100 g de muestra.
Cuadro 3. Análisis microbiológico de calamar gigante (Dosidicus gigas) con piel (CP) y sin piel (SP) almacenados a 0 y 5 °C durante diversos periodos de tiempo
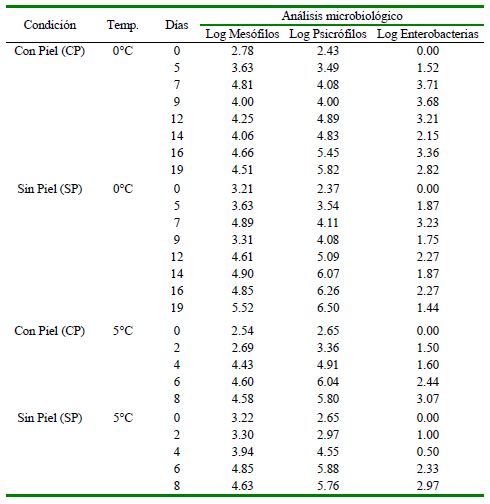
Nitrógeno de bases volátiles (N-BVT) y trimetilamina (N-TMA)
Nucleótidos
Se cuantificaron dos nucleótidos: Hipoxantina (Hx) y adenosinmonofosfato (AMP) (Ryder, 1985). Se empleó un HPLC serie 200 (Perkin Elmer). Los extractos fueron inyectados y separados en una columna SUPELCOSIL LC-18 de 25 cm x 4.6 mm, µm (Supelco, USA), a una longitud de onda de 254 nm. La fase móvil incluyó metanol grado HPLC y una solución tampón (ortofosfato dipotásico 0.06M y ortofosfato potásico 0.04 M). La solución tampón fue preparada diariamente y pasada a través de un filtro acuoso de 0.45 µm. El tiempo de corrida total fue de 17 min. El volumen de inyección de la muestra fue de 20 µl y el flujo de 1 ml/min. Los compuestos fueron cuantificados por medio del programa TotalChrom Navigator v. 6.2.0 (PerkinElmer). Para este trabajo se determinó la relación Hx /AMP.
Aminas biogénicas
Seis aminas biogénicas fueron cuantificadas: agmatina, putrescina (Putr), cadaverina (Cad), histamina, tiramina y espermina (Chilean Standard 2637, 2001). Se empleó un Agilent HPLC System w/DAD (Agilent Technologies, Alemania). Los extractos se inyectaron en una columna LC 18 de 15 cm x 4.6 mm, 5 µm (SunFire, USA). El espectro de absorción se obtuvo a 254 nm para todos los picos. La fase móvil isocrática fue metanol: agua en proporción de 80:20 (metanol de grado HPLC 99.9%). El tiempo de corrida total fue de 14 min. El volumen de inyección de la muestra fue de 20 µl con un flujo de 1 ml/min. Los compuestos fueron cuantificados por medio del programa Agilent ChemStation Rev B.03.02.SR2.
Análisis Microbiológico
Los análisis microbiológicos se desarrollaron en las muestras de manto de calamar gigante tomadas en condiciones de esterilidad (uso de guantes y de material esterilizado). Las porciones cárnicas se homogenizaron en un stomacher 400 circulator lab blender en una proporción al 10% (p/v) en solución salina peptonada. A partir de esta dilución, se tomaron alícuotas con diferentes niveles de diluciones seriadas, las cuales sirvieron para los análisis microbiológicos.
Se determinó el recuento total de bacterias psicrófilas, por extensión en superficie en agar Plate Count (PCA) en el músculo homogéneo con y sin piel e incubados a 7 °C por 10 días (Lapa-Guimaraes et al. 2005). Además, se determinó el recuento total de aerobios mesófilos viables mediante la siembra en profundidad también en PCA e incubada a 35 °C, así como el recuento de enterobacterias en medio VRBG (ICMSF, 1980). Estos tres análisis se realizaron por duplicado de cada manto en cada condición según los días establecidos.
Análisis Estadístico
De los promedios de los análisis químicos, microbiológicos y sensoriales se procedió a realizar el análisis de correlación de Pearson con el periodo de almacenamiento en la data total sin diferenciación de las condiciones de almacenamiento. Se presentan solo los resultados significativos en un diagrama de correlación (p<0.05). También se realizó el Análisis de Componentes Principales (ACP) y se identificaron las tendencias entre estos y el tiempo de deterioro (Eigen-value=1) usando el programa R (R Core Team, 2008) (p<0.05).
Cuadro 4. Análisis químico de manto de calamar gigante (Dosidicus gigas) con piel (CP) y sin piel (SP) almacenados a 0 y 5 °C durante diversos periodos de tiempo
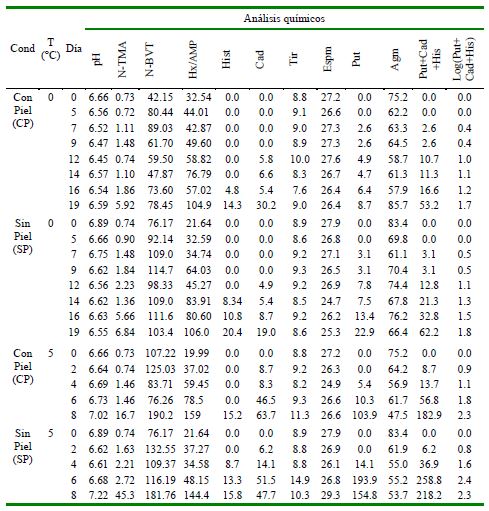
N-TMA; Trimetilamina; N-BVT; Nitrógeno de bases volátiles totales; Hx/AMP: hypoxantina/ adenosin monofosfato ratio; Hist: histamina; Cad: cadaverine; Tir: tiramina; Espm: espermina; Put: putrescina; Agm: agmatine N-TMA & N-BVT (mg/100 g) Hist, Cad, Tir, Espm, Put, Agm (mg/kg)
RESULTADOS Y DISCUSIÓN
Análisis Biométrico
Los pesos y longitudes del manto de calamar gigante fueron de 8.3 ± 1.8 kg y 74.6 ± 4.8 cm, respectivamente.
Análisis Proximal
Se determinó 83.7% de humedad, 10.7% de proteína cruda, 2.0% de grasa y 1.1% de cenizas en base húmeda.
Análisis Sensorial
Las muestras CP presentaron cambios menores en sus características sensoriales durante el tiempo de almacenamiento respecto a las muestras SP (Cuadro 2), apreciándose el efecto de protección de la piel que disminuyó el ingreso de bacterias. Por otro lado, las muestras CP y SP almacenadas a 0 ºC se encontraron en el límite de aceptación el día 14 y 12 y aquellas almacenadas a 5 °C el día 6 y 4, respectivamente. Albrecht et al. (2005) reportaron niveles aceptables en filetes de calamar gigante sin piel a 0, 5 y 10 °C solo hasta los días 7, 5 y 3, respectivamente, en tanto que Márquez et al. (2007) en manto entero sin piel indicó aceptabilidad hasta 15 días a 0 °C. Se evidencia que el troceado genera contaminación bacteriana y limita el tiempo de almacenamiento.
Análisis Microbiológico
Inicialmente, todos los mantos cumplían con los criterios microbiológicos en mesófilos y enterobacterias (MINSA, 2008) (Cuadro 3); no obstante, las bacterias psicrófilas aumentaron de manera exponencial durante el almacenamiento, existiendo correlación negativa significativa (p<0.05) (Figura 2) entre el crecimiento de psicrófilos y el análisis sensorial en las muestras CP y SP 0 °C (Figura 2) y en CP y SP 5 °C (Figura 2). Asimismo, los mesófilos no presentaron correlación negativa significativa con todos los atributos sensoriales a 0 °C con las muestras de CP, pero en el caso de SP a 0 °C se relacionó con todos los atributos. Por otro lado, en CP a 5 °C no hubo correlación significativa con el sabor y olor cocido, pero en SP se encontró correlación con los atributos. Estos resultados podrían indicar que los mesófilos están más involucrados en los cambios sensoriales en las muestras sin piel.
Zaragozá et al. (2015) reportaron en calamar gigante el crecimiento lineal de microorganismos psicrotroficos, mesófilos y bacterias productoras de sulfuro de hidrógeno, a partir de 4-5 Log (ufc/g) hasta 8 log(ufc/g). Por otro lado, ICMSF (1986) limita a las especies marinas como aptas para consumo humano con el conteo de 7 log (ufc/ g). Parlapani et al. (2018) manifiesta que en Sepia officinalis (cuttlefish) almacenada a 2 °C los microorganismos mesófilos crecieron desde 4 a 6.8 Log (ufc/g), similar a lo reportado por Bouletis et al. (2016) para la misma especie desde 3-4 de 7-8 log(ufc/g) entre mesófilos y psicrófilos al ser almacenados en refrigeración a 4 °C.
Las enterobacterias presentaron correlación negativa significativa (p<0.05) (Figura 2) con el análisis sensorial excepto para el olor, sea crudo o cocido en CP 0 °C y en SP 0 °C. En CP y SP a 5 °C correlacionó con todos los atributos, reflejándose que las condiciones del almacenamiento generan diferentes perfiles de deterioro en el manto. Por otro lado, hasta el límite de aceptación sensorial (Valor de 3 en el análisis sensorial, siendo los días 14 y 12 para CP0 y SP0 y 8 y 6 días a CP5 y SP5) se cumplían los límites de inocuidad para los mesófilos y enterobacterias.
Análisis Químicos
pH
Los valores iniciales promedio de pH fueron 6.71 ± 0.15. Las muestras CP y SP en almacenamiento a 0 °C presentaron una disminución del pH, llegando el valor más bajo el día 12 (Cuadro 4), similar a lo observado en Sepioteuthis lessosiana (Okamoto et al., 2008). Esto podría ser debido al efecto del ácido láctico, octopina y aminoácidos libres generados por los procesos metabólicos post mortem (Márquez-Ríos et al., 2007). Zaragozá et al. (2015) reportaron en calamar gigante una disminución progresiva y luego crecimiento del pH similar al presente estudio, siendo un valor inicial de 6.45, disminuyendo a 6.37 para luego elevarse a 6.56.
De manera general, los valores de pH no mostraron correlación significativa con las calificaciones del análisis sensorial a CP 0 °C. Por el contrario, se encontró una correlación positiva significativa con SP a 0 °C (Figura 2). Las muestras almacenadas a 5 °C incrementaron el pH desde el día 6, llegando a valores de pH cercanos a 7.2 en muestras SP, coincidiendo con el incremento de N- TMA. En las muestras CP a 5 °C no hubo relación significativa con el color y textura, pero la hubo con los demás atributos; en tanto que en muestras SP a 5 °C no hubo relación con atributo alguno. Los resultados demuestran, al igual que en el análisis bacteriano, diferentes perfiles de deterioro a la presencia de piel e interacción con la temperatura.
Nitrógeno de bases volátiles totales (N- BVT)
La determinación del nitrógeno de base volátil es un indicador de deterioro en pescados y en cefalópodos. El nivel inicial del N- BVT en el manto de calamar gigante se presenta en proporción de 1 a 20 en comparación con los niveles encontrados en cefalópodos pequeños de 42.15 a 107.2 mg/ 100 g en estado fresco (Woyewoda y Ke, 1980; Yamamanaka et al., 1989, 1995; Ohashi et al., 1991; Calvo, 2001; Vaz-Pires et al., 2008), superando los valores reportados por la norma europea (25 mg/100 g) (EUR-Lex, 2008).
Los valores de N-BVT no presentaron correlación significativa con los atributos sensoriales durante el almacenamiento a 0 o 5 °C (Figura 2), semejante a Márquez-Ríos et al. (2007), quienes no encontraron incremento significativo en 15 días de almacenamiento a 0 °C sin piel. Por otro lado, la comparación entre el desarrollo de N-TMA y el N-BVT presentó una correlación significativa positiva en condiciones de almacenamiento a 5 °C con y sin piel, pero no a 0 °C; lo cual indica que las bacterias que producen N-BVT que actuaron en mantos SP no necesariamente estaban presentes o no pudieron actuar de manera semejante en los mantos CP.
Durante el almacenamiento de calamar gigante (D. gigas), Zaragozá et al. (2015) reportaron 91.93 mg-N/100 g en muestras frescas evidenciando su elevado valor ante el límite comercial similar al del presente trabajo, donde al tercer día se elevó a 111 mgN/ 100 g, quinto día a 75 mgN/100 g y décimo día a 110 mgN/100 g, en forma oscilatoria, sin presentar incremento progresivo lineal o exponencial. Como indicador, el nivel de N- BVT encontrado inicialmente es muy alto (42.15-107.2 mg/100 g) y oscilante debido a su fisiología (a mayor tamaño necesita mayor contenido de cloruro de amonio que produce niveles más altos de N-BVT (Yamanaka et al., 1995), por lo que el nivel recomendado por la Norma Europea N.° 95/ 149/EEC de 25 mg/100 g para pescados no se podría aplicar.
Nitrógeno de trimetilamina (N-TMA)
El valor inicial promedio de N-TMA fue de 0.74 mg/100 g, similar al reportado por Calvo (2001) en manto fresco de calamar gigante (0.22-0.86 mg/100 g). No obstante, valores entre 1.3 y 2.2 mg/100 g han sido reportados en muestras de manto de calamar gigante (Yamanaka et al., 1995; Márquez-Ríos et al., 2007). Otros autores determinaron valores menores (0.4 mg/100 g) en especies frescas de cefalópodos, tales como Sepia officinalis (Vaz-Pires et al., 2008), Illex coindetii (Yamanaka et al., 1995) y Ommastrephes bartrami (Lapa-Guimaraes et al., 2005), pero Gou et al. (2010) reportaron 4.3 mg/100 g en Todarodes pacificus al inicio del periodo de almacenamiento.
Los valores de N-TMA durante la primera semana de almacenamiento a 0 °C fueron de aproximadamente 1 mg/100 g, similares a los reportados por otros autores (Calvo, 2001; Ordóñez y Plácido, 2004; Lapa-Guimaraes et al., 2005). Por otro lado, los valores de N-TMA de muestras SP y CP almacenadas a 5 °C mantuvieron valores menores a 2.5 mg/100 g durante los primeros cinco días, siendo mayores a los encontrados en las muestras almacenadas a 0 °C. A partir del día 6, el contenido de N-TMA inició un incremento exponencial coincidiendo otros reportes (Albrecht et al., 2005; Vaz-Pires et al., 2008).
Solo los valores de N-TMA para SP almacenados a 0 °C presentaron una correlación significativa con los atributos sensoriales (Figura 2), en tanto que con almacenamiento a 5 °C solo se presentó con el sabor. No obstante, al linealizar los datos mediante el Log(N-TMA) se mejoró la correlación con todos los atributos sensoriales, indicando que no solo se correlacionan las variables, sino que sus transformaciones o linealizaciones son adecuadas para desarrollar la correlación de Pearson. Zaragozá et al. (2015) reportaron valores para N-TMA de 27.43 mg N/100g en muestras frescas evidenciando su elevado valor ante el límite comercial similar al del presente trabajo, donde al tercer día se elevó a 28.57 mg N/100 g, séptimo día a 32.88 mg N/100 g y al día 12 a 53.11 mg N/100 g, indicando que pese al elevado valor el incremento fue lineal progresivo.
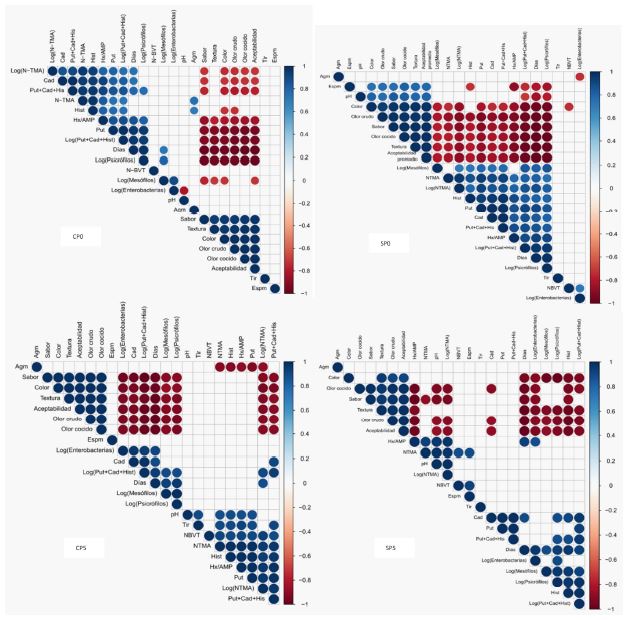
Figura 2 Análisis de correlación entre los análisis sensoriales, químicos y microbiológicos. Se representaron sólo las correlaciones significativas (p<0.05)
Cuadro 5 Porcentaje de varianza individual y acumulado de los análisis químicos en las diferentes condiciones de almacenamiento del manto de calamar gigante (Dosidicus gigas)
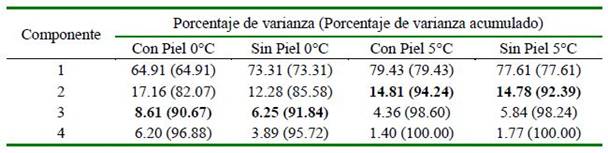
Se presentan los componentes hasta que se obtiene Eigenvalue menores a 1
Ordoñez y Plácido (2004) señalaron que la descripción «olor ácido y levemente abombado, no amoniacal» corresponde a un valor de 6.17 mg/100 g en manto que fue sugerido como límite de aceptación en calamar gigante. En el presente estudio, el valor correspondiente de N-TMA en los días límites de aceptación sensorial fue de 1.75 mg/100 g en promedio, siendo inferior al encontrado en calamar gigante (Albrecht et al., 2005) y en Illex illecebrosus (Woyewoda y Ke, 1980).
Relación Hx/AMP
La relación Hx/AMP es un indicador de frescura en cefalópodos que no está muy difundida, a diferencia del valor K [relación entre nucleósidos/nucleótidos*100= (ATP+- A D P + A M P ) / ( AT P + A D P + - A M P + - IMP+Hx+Ino) * 100 presentes en el músculo], siendo este último inadecuado para calamares por su elevación rápida durante las primeras horas de almacenamiento (Ando et al., 2005; Sykes et al., 2009).
Zaragozá et al. (2015) reportaron que el valor K en esta especie fue de 87 a 82% durante el periodo de almacenamiento; e indicando que la hipoxantina tuvo un incremento lineal desde 2.35 a 6.01 µmol/g. Valores de Hx/AMP entre 19.99 a 34.52 fueron reportados al inicio del almacenamiento en Todarodes pacificus (Ohashi et al., 1991). En el presente trabajo el valor inicial fue de 19.99-32.54 con 29 horas de captura, similar al valor de 15.30 reportado por Calvo (2001), mientras que Yamanaka et al. (1995) reportaron 11.3.
Los valores de Hx/AMP en calamar se incrementaron progresivamente durante el almacenamiento debido a que el nucleótido más abundante en invertebrados es el AMP y la base más abundante en cefalópodos es la hipoxantina (Márquez, 2006; Márquez-Ríos et al., 2007). El Hx/AMP se incrementó en las muestras almacenadas a 0 °C desde 20 a 100 desde el inicio hasta el final del estudio, además de presentar una correlación con todos los atributos sensoriales (Figura 2). Ohashi et al. (1991) determinaron que Hx/ AMP también se incrementó durante el almacenamiento de Todarodes pacificus y en Doryteuthis bleekeri a 0 °C. Por otro lado, en las muestras almacenadas a 5 °C, los valores de Hx/AMP se incrementaron en función del tiempo.
Aminas biogénicas
Al inicio del almacenamiento solo se detectó tiramina, espermidina y agmatina en manto a niveles de 8-9; 25-27 y 50-70 mg/kg, respectivamente. Solo putrescina, cadaverina e histamina mostraron un aumento en el almacenamiento a bajo las dos temperaturas del estudio.
Una de las principales aminas biogénicas es la histamina, que produce envenenamiento por trombosis (Yi-Chen et al., 2015). En Europa, el límite de histamina es de 100 mg/kg y para la FDA es de 50 mg kg (FAO/WHO, 2013). En el presente estudio se encontró la histamina en el almacenamiento a 0 °C en el día 16 (4.8-8 mg/kg); sin embargo, la putrescina se presentó en el día 7 y la cadaverina en el día 12, aunque todas con valores por debajo de 6 mg/kg. En el almacenamiento a 5 °C se detectó histamina en el día 8 (15.2 mg/kg) y 4 (8.7 mg/kg) en manto CP y SP, respectivamente. Los niveles bajos de histamina se deberían a la baja cantidad de histidina libre presente en el manto. Así, si se compara el manto del calamar gigante (6.5- 68.5 mg/kg) con un pescado formador de histamina como el Mahi Mahi (Coryphaena hippurus) (290-330 mg/kg), la diferencia es de aproximadamente 5 veces (Yamanaka et al., 1995; Antoine et al., 2001).
Yamanaka et al. (1989) indican que la agmatina podría ser utilizada como un indicador de frescura en Todarodes pacificus, donde el límite era de 30 mg/100 g en la etapa de descomposición inicial y más de 40 mg/100 g en la etapa de descomposición avanzada; sin embargo, en el manto de calamar gigante la agmatina está presente de manera constante durante el almacenamiento en cualquier condición (50-70 mg/kg).
La relación de cambio de putrescina y cadaverina fue superior a la histidina. Prester et al. (2011) recomendó el uso de estas aminas, así como el índice de aminas biogénicas (la sumatoria) como indicadores de deterioro. No obstante, en el presente estudio, el manto almacenado a 0 y 5 °C mostró perfiles de formación de aminas biogénicas opuestas, habiendo mayor formación de putrescina en SP y de cadaverina en CP durante el almacenamiento. La suma de las aminas putrescina y cadaverina en relación con el tiempo de almacenamiento presentó un desarrollo exponencial en todas las condiciones. La correlación obtenida con la puntuación sensorial sugiere que esta suma se puede utilizar como un indicador de calidad; asimismo, al linealizar la sumatoria (Log [Put+Cad+Hist]) se mejora la significancia de la correlación (Figura 2).
Análisis de Correlación
El análisis de correlación de Pearson se desarrolló en base a los promedios. En este documento solo se presentan los resultados significativos. La intensidad del color indicaría que la correlación es más alta (azul correlación positiva y rojo correlación negativa). Todos los resultados del análisis sensorial resultaron significativos y se correlacionaron negativamente con el tiempo de almacenamiento, indicando el proceso de deterioro normal de los mantos de calamar gigante, tanto a 0 como a 5 °C, pero por las diferencias de temperatura, los tiempos de almacenamiento se redujeron por el incremento de la temperatura. Por el contrario, los análisis químicos en cada tipo de almacenamiento, o dicho de otro modo, cada microambiente diferenciado por la temperatura y la presencia de diferentes sustratos a partir de la presencia de piel o no generaron diferentes efectos en los microorganismos y capacidad de diferentes metabolitos que se reflejaron en diferentes valores, proporciones y tipos de análisis químicos que correlacionaron en diferentes valores.
En las muestras con piel a 0°C (CP0), el tiempo de almacenamiento correlacionó con el Log(N-TMA), Cad, Put+Cad+Hist, N- TMA, Hx/AMP, Log(Put+Cad+Hist), Log(Psicrófilos), Log(Mesófilos), y a 0°C sin piel (SP0) con log(Mesófilos), N-TMA, Log(N-TMA), Hist, Put, Cad, Put+Cad+His, Hx/AMP,Log(Put+Cad+Hist), Log(Psicrófilos).Se puede resumir que en la condición a 0 °C es importante el deterioro por enzimas endógenas debido a que es progresivo y el crecimiento bacteriano está limitado por la baja temperatura. Asimismo, también se aprecia la generación de nitrógeno volátil como N-TMA y la descarboxilización de los aminoácidos libres produciendo aminas biogénicas como putrescina, cadaverina e histamina por microorganismos.
En las muestras con piel a 5 °C (CP5) el tiempo de almacenamiento correlacionó con el Log(N-TMA), Cad, Log(Put+Cad+- Hist), Log(Psicrófilos), Log(Mesófilos), Log(Enterobacterias), en tanto que a 5 °C sin piel (SP5) con Hx/AMP, Cad, Log(Psicrófilos), Log(Mesófilos), Log(Enterobacterias), Hist, Log(Put+Cad+Hist). Aquí se puede resumir en que la condición a 5 °C es más importante el deterioro por microorganismos que por enzimas endógenas a consecuencia del crecimiento bacteriano que estaría favorecido el incremento de la temperatura. Por la temperatura, se suma otro grupo bacteriano, las enterobacterias, que no crecieron a 0 °C pero lo hicieron a 5 ºC. También se aprecia la generación de nitrógeno volátil como N- TMA y la descarboxilización de los aminoácidos libres produciendo aminas biogénicas como putrescina e histamina.
Estos microambientes generados en el sistema modelo de almacenamiento brindan luces acerca del deterioro de estos recursos hidrobiológicos; no obstante, con este trabajo no se busca una generalización de todos los posibles deterioros de los mantos a nivel nacional, sino una pauta de reflexión y análisis de cómo mejorar los análisis químicos y microbiológicos existentes y como se podrían complementar con nuevos análisis y relacionarse entre estos.
Análisis de Componentes Principales (ACP)
Este análisis se realizó con el fin de reducir las variables respuesta (análisis químicos, microbiológicos y sensoriales) de las condiciones de almacenamiento del manto de calamar con y sin piel. Las 21 variables respuesta analizadas en cada condición quedaron reducidas a tres componentes (Cuadro 5) para el almacenamiento a 0 °C y solo a dos componentes a 5 °C, donde se obtuvieron valores eigen menores a 1. Estos componentes en conjunto explican el 90.0-91.8% de la variabilidad en los datos originales a 0 °C y el 98.2-98.8 a 5 °C.
Con base al análisis de ACP, se puede apreciar de 2 a 3 grupos según la condición de almacenamiento al graficar la componente 1 y 2 (Figura 3), ponderándose en el grupo que contenga a la variable Días debido a que el deterioro del manto de calamar se desarrolló durante el almacenamiento de manera lineal (datos sensoriales vs tiempo, Figura 2), por lo que los análisis relacionados a los cambios sensoriales serían análisis informativos del cambio durante el almacenamiento.
Con base al análisis de ACP, se puede apreciar de 2 a 3 grupos según la condición de almacenamiento al graficar los componentes 1 y 2 (Figura 3). Los análisis que presentan la misma tendencia del vector días (periodo de almacenamiento) indicarían que los valores de los análisis se incrementaron progresivamente (cambios lineales) con el periodo de tiempo. Si fuese contrario, la dirección estuviese en sentido opuesto al vector tiempo implica que disminuyeron progresiva- mente.
Los análisis sensoriales se encuentran en sentido opuesto al vector de almacenamiento, lo cual indicaría que los valores sensoriales disminuyen durante el almacenamiento. Esto se corrobora mediante el Cuadro 2. Estos cambios ocurren en todas las condiciones de almacenamiento (Figura 3).
Algunos de análisis químicos no presentaron una tendencia lineal, por lo que fueron linealizados, como el N-TMA, N-BVT, @!(Put+Cad+His), microorganismos. A pesar de estos cambios, no se presentó un gran consenso en los análisis que estaban en el sentido del vector de días de almacenamiento. Para la condición de 0 °C se aprecia a Log (Put+Cad+Hist), Putrescina, Log(Psicró-filos), N-BVT, Log(Mesófilos), Log(Entero-bacterias) en mantos con piel e Histidina, Cadaverina, Putrescina, N-TMA, Hipoxan-tina/AMP, Put+Cad+Hist, Log- (Put+Cad+Hist),Log(N-TMA), Log(Psicrófilos), Log(Mesófilos) para mantos sin piel. A 5°C, en mantos con piel se obtuvo Log-(Enterobacterias), Hist, Cad, Put+Cad+His, Put, Log(Put+Cad+Hist), Log(Mesófilos), Log(Psicrófilos) y en mantos sin piel Log(Psicrófilos), Log(Mesófilos), Log- (Enterobacterias), Log(Put+Cad+Hist) y Cad (Figura 3).
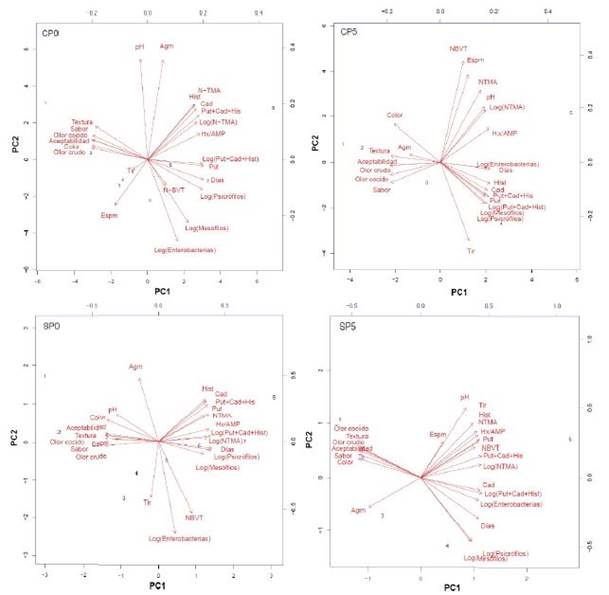
Figura 3 Biplot de análisis de componentes principales PC1 vs. PC2 entre los análisis sensoria- les, químicos, microbiológicos (PC1 y PC2 representan el 82%-CP0, 95%-SP0, 94.2%- CP5, 92.31%-SP5 de la variabilidad). CP0: manto con piel almacenada a 0 °C, SP0: manto sin piel almacenada a 0 °C, CP5: manto con piel almacenada a 5 °C, SP5: manto sin piel almacenada a 5 °C
Cuadro 6 Resumen de los análisis según correlación o análisis de componentes principales más informativos del deterioro del manto de calamar gigante (Dosidicus gigas) almacenado con y sin piel a 0 y 5 °C (CP0, SP0, CP5, SP5 respectivamente)
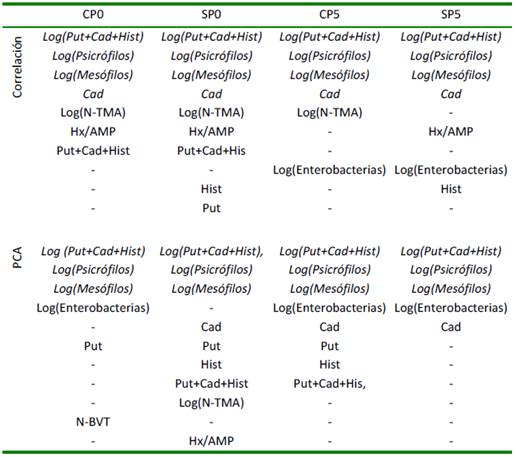
Los microorganismos evaluados son grupos generales que se encontraban en el manto y en al ambiente donde fueron procesados y almacenados. Estos, al encontrar un sustrato y desarrollarse produjeron metabolitos como aminas biogénicas y N- TMA, como se aprecia a 0 °C, pero a 5°C, una temperatura más elevada solo se produjeron aminas biogénicas. En todos los casos se aprecian los microorganismos mesófilos y psicrófilos, y si bien hay cambios enzimáticos como Hx/AMP, lo metabolitos de las bacterias son determinantes para el deterioro del manto de calamar, pues influenciaran más en los atributos sensoriales.
El Cuadro 6 resume los análisis informativos del deterioro del manto en cada condición. Se aprecia que la putrescina está presente a 0 °C y la cadaverina a 5 °C, pudiendo tomarse como un indicador de la pérdida de la cadena de frío si la cadaverina está presente en mantos de calamar almacenados a 0 °C; en tanto que las bacterias mesófilas y enterobacterias a 5 °C toman importancia por la relativa facilidad de crecimiento ante los 0 °C.
Los análisis con mayor frecuencia según los dos análisis estadísticos resultaron en Log(Put+Cad+Hist), Log(Psicrófilos) y Log(Mesófilos) con el deterioro sensorial en las cuatro condiciones (con piel y sin piel a 0 y 5 °C), indicando que el deterioro en las condiciones de almacenamiento evaluadas se debería a la presencia y desarrollo de psicrófilos y mesófilos, los cuales producen metabolitos como aminas biogénicas en base a los aminoácidos libres presentes en el manto, resaltando la putrescina a 0 °C y cadaverina a 5 °C, pero al ser tomadas en su conjunto y adicionándoles la histamina (la cual se incrementa días cercanos al límite de la aceptación sensorial, valor de 3, según el Cuadro 3), esta sumatoria resulta útil para describir los cambios del manto de calamar sea a 0 °C como a 5 °C en las condiciones del presente estudio, no siendo la intención de una generalización , pues para generalizar este trabajo tendría que estar asociado a un plan de muestreo (lo cual implicaría mayor onerosidad sea por el transporte, almacenamiento y análisis). Sin embargo, al ser condiciones ideales de almacenamiento, permite analizar con mayor confianza los resultados obtenidos de los futuros planes de muestreo que se desarrollarían en plantas de procesamiento o durante el comercio de los mantos de calamar gigante.
El tamaño de la unidad de manto es realmente grande para su almacenamiento, lo cual condicionó a una cantidad reducida de muestra, por lo que sería recomendable ampliar el número de las unidades de estudio, además de profundizar los análisis microbiológicos, sea en bacterias cultivables como Pseudomona o bacterias no cultivables mediante técnicas moleculares.












 uBio
uBio 

