INTRODUCCIÓN
El Caballo Peruano de Paso (CPP) es una raza originaria del Perú, y desde su formación en 1531 a partir de los caballos que llegaron a Sudamérica durante la invasión española, contribuyó al desarrollo de las actividades económicas del Perú (Montenegro et al., 2018). La crianza de animales de esta raza ha tomado gran interés en el transcurso del tiempo, no solo en Perú, sino también a nivel internacional (Barrantes et al., 2009). En el caso de Ecuador, la información genealógica reposa en el Libro Genealógico de la Asociación Nacional Ecuatoriana de Criadores y Propietarios de Caballo de Paso (ANECPCP), donde constan inscritos 5687 animales nacidos en Ecuador e importados (hasta diciembre de 2020). Asimismo, los ejemplares fundadores de la raza y exportados a Ecuador se encuentran registrados en el Libro Genealógico de la Asociación Nacional de Criadores y Propietarios de Caballos Peruano de Paso (ANCPCPP) en Perú.
Los caballos de ambladura, definidos como aquellos que pueden trabajar en aires intermedios de dos movimientos laterales, en el cual las dos extremidades del mismo lado del caballo se desplazan hacia adelante a la vez (González, 2018). El CPP realiza un paso llamado «paso llano», que es un paso lateral de cuatro tiempos entre el paso y el galope (Axling, 2015), donde el CPP tiene la particularidad de realizar un movimiento de balanceo hacia afuera de las extremidades anteriores que se conoce como «termino» (Nicodemus y Clayton, 2003). Promerová et al. (2014) hicieron un estudio comparativo de las secuencias genéticas del gen DMRT3 responsable de la ambladura en razas que demuestran este andar, indicando que el CPP tiene el 100% de alelos homocigotos para dicho gen; asimismo, Wutke et al. (2016) mencionan que este alelo se distribuye en todo el mundo con una frecuencia especialmente alta en los caballos con marcha y en razas utilizadas para carreras de arneses.
No se han realizado estudios referentes a los niveles de consanguinidad en el CPP registrado en Ecuador; sin embargo, el conocimiento del nivel del coeficiente de endogamia promedio de la población es de enorme importancia porque permite obtener una imagen de la estructura interna de una población y su evolución en el tiempo (Gómez et al., 2011a). La caracterización y el manejo eficiente de los niveles de consanguinidad ha sido y seguirá siendo un objetivo importante en los programas de cría animal para asegurar que las poblaciones puedan adaptarse a los objetivos de cría (Howard et al., 2017), los cuales pueden conducir a un rápido progreso genético; sin embargo, también podría conducir a un alto nivel de endogamia y, en consecuencia, a una deriva genética (Giontella et al., 2020).
El apareamiento entre parientes es uno de los métodos de reproducción más importantes que se utilizan para consolidar las cualidades hereditarias de los animales (Kalashnikov et al., 2020). Sin embargo, los efectos negativos de la consanguinidad dan como resultado una reducción en el valor medio de un rasgo (depresión endogámica) (Doekes et al., 2019; Kasarda et al., 2019; Kalashnikov et al., 2020), situación que puede ocasionar la pérdida de la variabilidad genética (Müller-Unterberg et al., 2017; Bussiman et al., 2018), afectando principalmente los aspectos de supervivencia, producción, reproducción, morfología y resistencia a las enfermedades (Howard et al., 2017; Kasarda et al., 2019).
La importancia de la estrategia de mejoramiento genético y de la reproducción es preservar el más alto nivel de las fuentes de biodiversidad genética en las razas, representado por la variabilidad genética y el nivel mínimo de endogamia (Kasarda et al., 2019), por lo que requiere del desarrollo de parámetros óptimos para el uso de la endogamia en los programas de cría de caballos, lo que implica que la comprensión de la distribución de la carga genética es importante para mejorar el valor fenotípico de una población en el futuro (Todd et al., 2018). Es importante considerar, además, que la consanguinidad por arriba de cierto umbral se asocia con efectos negativos e indeseables (Domínguez et al., 2014). Por otro lado, no se consideran animales endogámicos si no hay un ancestro común en las últimas cinco generaciones (Ocampo y Cardona, 2013).
El objetivo de este trabajo fue determinar la evolución de la tasa media de consanguinidad y variabilidad genética en el CPP registrado en Ecuador y en una población de referencia de estos caballos nacidos entre 2008 y 2018.
MATERIALES Y MÉTODOS
Animales y Registros
La información genealógica se obtuvo de los registros de la Asociación Nacional Ecuatoriana de Criadores y Propietarios de Caballo de Paso (ANECPCP). Se analizaron 4968 registros de animales nacidos en Ecuador desde 1985 hasta diciembre de 2020. Se complementó con 3457 registros de los ancestros de estos animales (caballos y yeguas) importados desde Perú e inscritos en el libro genealógico de la Asociación Nacional de Criadores y Propietarios de Caballo Peruano de Paso (ANCPCPP) en Perú, para un total de 8425 animales desde año 1932 hasta 2020; sin embargo, se descartó la población que nació en 2019 y 2020 por haber pocos animales registrados, reduciendo el análisis a 8330 registros (animales nacidos y registrados en Ecuador y sus ancestros registrados en Perú y otros países), a la cual se le denominó población total (PT).
Se consideraron como poblaciones de referencia a la población de animales nacidos y registrados en el pedigrí de la ANECPCP (PE) hasta diciembre de 2018 (n= 4870 registros) y otra población donde solo se consideró los animales nacidos entre 2008 y 2018 (PR) (n=1950 animales inscritos) que se asume que serán los padres de la siguiente generación. Se utilizó el software Endog v 4.8 para el análisis de los datos (Gutiérrez y Goyache, 2005).
Completitud del Pedigrí
La integridad de la información del pedigrí para cada individuo se basó en: (a) el número máximo de generaciones completas (GC), definido como el número de generaciones que separan al individuo de la generación más lejana donde se conocen todos los ancestros; (b) el número máximo de generaciones trazadas (GT), entendido como el número de generaciones que separan al individuo de su antepasado más lejano; (c) el número de generaciones completas equivalentes (GE), calculadas como la suma de (1/2)n donde n es el número de generaciones que separan al individuo de cada ancestro conocido (Perdomo-González et al., 2020; Poyato- Bonilla et al., 2020; Sieklicki et al., 2020), y (d) el porcentaje de ancestros conocidos, expresado como una medida importante de la calidad de las estimaciones de consanguinidad del pedigrí, ya que representa una media armónica de las contribuciones genéticas de los padres y es igual a cero si se desconoce alguno de los padres, independientemente de cuán profundo y completo sea el pedigrí del otro padre (Núñez-Domínguez et al., 2020).
Intervalo Generacional
El intervalo generacional, definido como la edad promedio de los padres al nacimiento de su progenie reproductora, se calcula para las cuatro vías (padre-hijo, padre-hija, madre- hijo y madre-hija) (Ramírez-Valverde et al., 2018; Giontella et al., 2019; Perdomo-González et al., 2020).
Parámetros Genealógicos
Los parámetros genealógicos estudiados fueron:
La consanguinidad individual (Fi) de Wright, definida como la probabilidad de que un individuo tenga dos alelos idénticos por descendencia, calculado por método tabular (Comparini et al., 2019; Giontella et al., 2019; Perdomo-González et al., 2020);
El coeficiente de parentesco promedio (AR), definido como la probabilidad de que un alelo elegido aleatoriamente de toda la población pertenezca a un animal dado (Sheikhlou y Abbasi, 2016; Ramírez-Valverde et al., 2018; Giontella et al., 2019). Este parámetro expresa cómo un individuo o un grupo de individuos representa a la población (Gómez, 2016). En los fundadores los valores de AR muestran su contribución genética a todo el pedigrí (Giontella et al., 2019);
El incremento de consanguinidad, definido como el cambio en el coeficiente de consanguinidad de una generación a otra (Vostrá-Vydrová et al., 2016). Se puede considerar el uso del incremento de consanguinidad como una medida alternativa de consanguinidad ajustada a la profundidad del pedigrí del individuo, permitiendo distinguir entre dos animales con el mismo coeficiente de consanguinidad, pero con diferencias en el número de generaciones en las que ha aparecido este nivel de consanguinidad (Gómez et al., 2009). Dentro de este parámetro se calculó:
El incremento de consanguinidad individual (ΔFi) computado como
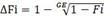 donde Fi es el coeficiente individual de consanguinidad y GE el número de generaciones completas equivalentes (Kasarda et al., 2019; Núñez-Domínguez et al., 2020; Sieklicki et al., 2020),
donde Fi es el coeficiente individual de consanguinidad y GE el número de generaciones completas equivalentes (Kasarda et al., 2019; Núñez-Domínguez et al., 2020; Sieklicki et al., 2020),Incremento de consanguinidad por año (ΔF/año) obtenido mediante la regresión de Fi con el año de nacimiento (Gómez et al., 2011a, 2013), y incremento de consanguinidad por generación (ΔF/generación) calculado a partir del (ΔF/año) multiplicado por el intervalo generacional (Gómez et al., 2011a,b);
El tamaño efectivo de la población (Ne), que se define como el número de individuos que tendría una población real para mantener las tasas de consanguinidad que le corresponderían si tuviera la condición ideal desde el punto de vista reproductivo y contribuir de la misma manera a la siguiente generación que daría lugar a la misma tasa de consanguinidad (Ocampo y Cardona, 2013; Giontella et al., 2019; Moura-Baena et al., 2020). Se puede calcular como el inverso del doble del valor medio de los incrementos de consanguinidad individual (Núñez-Domínguez et al., 2020; Sieklicki et al., 2020).
Probabilidad de Origen de los Genes
Se obtuvieron los valores de:
Número de fundadores, definido como el número de individuos con padre y madre desconocidos. Cuando solo tiene uno de los padres desconocidos se considera fundador fantasma;
Número de ancestros, definido como aquellos individuos que han influido más que sus ascendientes en la variabilidad genética presente en la población. También se puede tomar en cuenta a un ancestro como un fundador (Cervantes et al., 2009);
Número efectivo de fundadores (fe). Es el número de fundadores igualmente contribuyentes que se espera que produzcan la misma diversidad genética de la población estudiada. Se calcula utilizando los coeficientes AR de los individuos fundadores (Sheikhlou y Abbasi, 2016; Giontella et al., 2019; Perdomo-González et al., 2020);
Número efectivo de ancestros (fa). Es el número mínimo de antepasados, no necesariamente fundadores, que explica toda la diversidad genética de una población (Sheikhlou y Abbasi, 2016; Ramírez-Valverde et al., 2018; Giontella et al., 2019). Este parámetro complementa el fa, entendiéndose que cuando fa es menor que fe (relación fe/fa >1) indica que se produjo un cuello de botella por el uso desequilibrado de reproductores (Giontella et al., 2019; Silva-Faria et al., 2021);
Los equivalentes del genoma fundador (fg). Representa el número de fundadores que se esperaría que produjeran la misma diversidad genética en la población estudiada si los fundadores están igualmente representados y no se produce ninguna pérdida de alelos (Sheikhlou y Abbasi, 2016; Ramírez-Valverde et al., 2018; Giontella et al., 2019). La relación fg/fe indica si la población analizada está afectada por la deriva genética (Giontella et al., 2019).
RESULTADOS Y DISCUSIÓN
Estructura del Pedigrí
El registro anual en el CPP en Ecuador entre 1985 y 2018 fue de 143.2 ± 55.7 animales, con un máximo de registros de 233 animales en 2005. En el Cuadro 1 se muestra una descripción general de la población total (PT) que incluyó los ancestros peruanos y registrados en la ANCPCPP, las subpoblaciones de animales nacidos y registrados en Ecuador (PE) y la población de referencia en la que se tomó en cuenta los animales nacidos y registrados entre 2008 y 2018 en Ecuador (PR) por la ANECPCP.
Se observó una mayor población de hembras registradas en las tres poblaciones (59.50, 55.63 y 53.28%, respectivamente) de un total de 8330, 4870 y 1950 animales respectivamente, similar a la distribución que in forman otros estudios (Montenegro et al., 2018; Perdomo-González et al., 2020; Poyato-Bonilla, et al., 2020). Esto podría explicarse por los mayores costos que implica la cría de un semental sobre las yeguas; las particularidades de los requisitos de manejo de los sementales, por ejemplo, áreas más grandes sin contacto directo con otros machos; y el mayor cuidado en el manejo por un comportamiento más temperamental que las yeguas (Bussiman et al., 2018). Por otro lado, en el Cuadro 1 se observa que los machos en la PT, PE y PR poseen un mayor promedio en el número de crías (5.58±11.35, 7.35±10.76 y 4.00±5.40, respectivamente) sobre las hembras (2.33±2.04, 3.08±2.38 y 1.79±1.07, respectivamente).
Cuadro 1. Estructura del pedigrí de las poblaciones de caballos peruanos de paso en el estudio
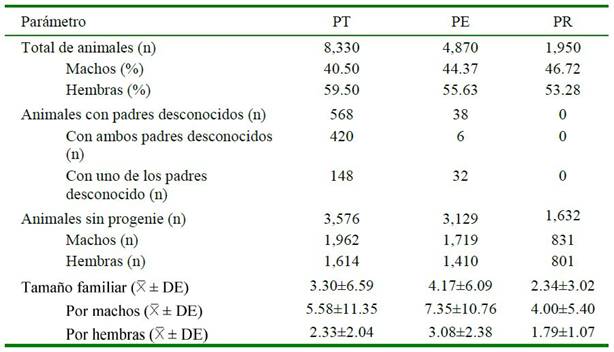
PT=Población total analizada; PE=Población registrada en Ecuador; PR=Población de referencia; DE=Desviación estándar
El alto número de animales registrados sin progenie es el resultado de criterios de selección de los criadores, donde algunos animales son todavía jóvenes y aún no entran en la etapa reproductiva, en tanto que algunos machos son castrados o las crías de estos no son registradas por no cumplir con los estándares ideales para exhibición. Es así que, el tamaño familiar promedio de la PR es inferior a los caballos de raza Mangalarga con 22.29 para machos y 4.69 para hembras (Moura-Baena et al., 2020).
Completitud del Pedigrí
El nivel de completitud del pedigrí, referido como un indicador de calidad del pedigrí (Duru, 2017) se muestra en el Cuadro 2. El número máximo de generaciones trazadas en la PE (11.14 ± 2.23) fue mayor en comparación a las poblaciones totales registradas de Maremmano con 10.5 (Giontella et al., 2018), Hispano-Árabe con 1.14 (Gómez, 2016) y CPP en Perú con 9.73 (Montenegro et al., 2018). Por otro lado, este valor fue similar a la población de animales vivos de la raza Maremmano con 11.6 (Giontella et al., 2019) e inferior a los resultados analizados en AngloÁrabe de Cerdeña con 13.09 (Giontella et al., 2020) y Criollo brasilero con 12.09 (Maciel et al., 2014).
Cuadro 2. Nivel de completitud del pedigrí de las poblaciones de ejemplares de Caballo Peruano de Paso
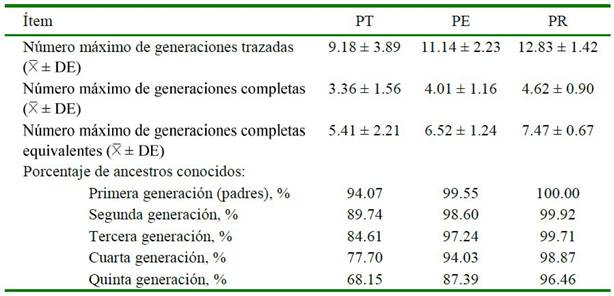
PT=Población total analizada; PE=Población registrada en Ecuador; PR=Población de referencia; DE = Desviación estándar
Al analizar la PE, se encontró que el promedio del número máximo de generaciones completas fue mayor a los promedios de las poblaciones de caballos Criollo brasilero con 1.85 (Maciel et al., 2014), Maremmano con 3.3 en la población de animales registrados y 3.80 en la población de animales vivos (Giontella et al., 2019) y CPP registrado en Perú con 3.10 (Montenegro et al., 2018), pero similar al Anglo-Árabe de Cerdeña con 4.00 (Giontella et al., 2020) e inferior al Hucul, Lipizzano y Shagya árabe con 17.54, 24.56 y 34.82 respectivamente (Pjontek et al., 2012). Asimismo, el promedio de PE para el número de generaciones completas equivalentes fue mayor sobre la población de animales de raza Campolina con 2.98 (Bussiman et al., 2018), Criollo brasilero con 4.62 (Maciel et al., 2014) y CPP registrado en Perú con 4.91 (Montenegro et al., 2018), pero inferior a la población de Anglo-Árabe de Cerdeña con 7.30 (Giontella et al., 2020).
Considerando la PR con intervalo generacional entre 2008 y 2018 de CPP registrados en Ecuador, el número máximo de generaciones trazadas fue mayor sobre la población de referencia de animales vivos de la raza Marennmano (Giontella et al., 2019) con 11.60, población de los animales nacidos en los últimos 10 años de Hispano-Árabe con 2.63 (Gómez, 2016), similar a la población de referencia de Norik of Muran de 25 animales con análisis genotípico (Kasarda et al., 2019) con 12.67 e inferior a las poblaciones de referencia del caballo Árabe Turco con 12.20 (Duru, 2017) y Pura Raza Español con 18.80 (Perdomo-González et al., 2020).
El número máximo de generaciones completas de la PR es mayor sobre la población de referencia de animales vivos de la raza Marennmano (Giontella et al., 2019) con 3.80, población de animales nacidos en el último decenio de la investigación de HispanoArabe con 1.14 (Gómez, 2016), población de referencia de Norik of Muran con análisis genotípico (Kasarda et al., 2019) con 2.75, e inferior a las poblaciones de referencia del caballo Árabe Turco con 5.40 (Duru, 2017) y del Pura Raza Español con 6.20 (Perdomo- González et al., 2020). Para el número máximo de generaciones equivalentes, la PR es superior a la población de referencia de animales vivos de la raza Marennmano (Giontella et al., 2019) con 6.40, similar al caballo Árabe Turco con 7.80 (Duru, 2017) e inferior al Pura Raza Español con 10.40 (Perdomo- González et al., 2020).
El grado de calidad de la información del pedigrí tiene un impacto en el coeficiente de consanguinidad promedio (Duru, 2017), por lo que el mejor criterio para evaluar la información genealógica es el número equivalente de generaciones, el mismo que influye en el cálculo del ΔFi y de Ne (Pjontek et al., 2012). La PT de CPP presentó un porcentaje de ancestros conocidos superior al 90% del pedigrí solo en la primera generación (94.05%), mientras que, los registros de la PE alcanzan el 99.55% en la primera generación disminuyendo gradualmente y en la PR se observa el máximo de 100% en la primera generación para disminuir paulatinamente hasta 96.46% en la quinta generación (Cuadro 2).
Se ha encontrado que algunas razas de caballos poseen resultados similares del presente estudio con el CPP; esto es, tomando como referencia el 90% de completitud del pedigrí, en la población de caballos Standarbreed hasta la décima generación (MacCluer et al., 1983), hasta la octava generación en el Árabe Turco (Duru, 2017), en el Pura Raza Español hasta la séptima generación (Perdomo-González et al., 2020), igual número de generaciones en la población de referencia de los animales vivos del Maremmano, y en la población de animales registrados oficialmente de esta raza hasta la tercera generación (Giontella et al., 2019), hasta la quinta generación en Pantaneiro (McManus et al., 2013) y hasta la segunda generación en el Campolina (Bussiman et al., 2018).
El aumento de la completitud del pedigrí en la PE y PR sugiere una mejora en la calidad de la información genealógica que lleva la ANECPCP hasta la fecha, manejando un libro genealógico cerrado. También se pueden atribuir estos valores de completitud al número de generaciones que cuenta el registro (Cervantes et al., 2008). No obstante, en los pedigríes con una gran profundidad y alta completitud, el aumento de su profundidad tiene poco impacto en la Fi (Perdomo-González et al., 2020).
Intervalo Generacional
Las líneas paternas para PT, PE y PR tienen mayor intervalo generacional sobre las líneas maternas, siendo los valores medios para intervalo generacional de 8.72 ± 4.56, 8.79 ± 4.30, y 9.20 ± 4.61 años para PT, PE y PR respectivamente (Cuadro 3). En comparación con otras poblaciones estudiadas, el intervalo generacional de la PR es superior con la población de caballos Campolina con intervalo de 9 años (Bussiman et al., 2018) y Pantaneiro con 8.2 (McManus et al., 2013) y las tres poblaciones estudiadas son inferiores a los intervalos generacionales reportados en caballos árabes turcos con 12.4 (Duru, 2017), en Criollos brasileros con 10.3 (Maciel et al., 2014), en la población total de caballos Mangalarga y su población de referencia con 10.43 y 9.48 años, respectivamente (Moura- Baena et al., 2020) y en el Caballo de Carrera Japonés con 10.50-11.50 (Yamashita et al., 2010).
Por lo general, los intervalos generacionales en el caballo son largos (Pjontek et al., 2012); sin embargo, los valores más bajos del presente estudio pueden estar ligado a que muchos criadores los utilizan como reproductores a temprana edad (2 años), lo cual disminuye el intervalo generacional promedio (Bussiman et al., 2018); por otro lado, el mayor intervalo generacional en otras razas puede deberse al riguroso control que pasan para calificar su conformación y aires básicos, lo que retrasa el inicio de la vida reproductiva (Gómez, 2016).
Parámetros Genealógicos
El nivel de consanguinidad (Fi), el nivel de parentesco (AR) entre cada individuo y su población y el incremento de consanguinidad individual (ΔFi) promedio para PT, PE y PR se muestran en el Cuadro 4. El tamaño efectivo de la población (Ne) calculado con el ΔFi indica que la PT (46.81) es similar a la PE (46.73) y ambos superiores a la PR (43.86) (Cuadro 4).
La Fi promedio para el CPP en la PT y PE son superiores a los reportados en Campolina con 2.45% (Bussiman et al., 2018), Criollo brasilero con 0.88% (Maciel et al., 2014), y Mangalarga con 1.02% (Moura-Baena et al., 2020), e inferiores a los promedios indicados en las razas Árabe Español con 7% (Cervantes et al., 2008), Lusitano con 9.92% (Vicente et al., 2012) y Kladruver con 13% (Vostra et al., 2016). La consanguinidad media para la PR es superior al valor encontrado en las poblaciones de referencia de caballos árabes turcos con 4.8% (Duru, 2017), Mangalarga con 1.1% (Moura-Baena et al., 2020) y Pura Raza Español con 7.51% (Perdomo-González et al., 2020), e inferior a las poblaciones de referencia del caballo Árabe Español con 9.8% (Cervantes et al., 2008) y Lusitano con 11.34% (Vicente et al., 2012).
Los programas de reproducción modernos conducen a un rápido progreso genético, pero también conducen a la acumulación de Fi y la disminución de la diversidad genética, situación que preocupa en diferentes especies de animales domésticos en los últimos años (Sheikhlou y Abbasi, 2016). Dependiendo de los criterios de selección practicados en determinadas razas de caballos, podría provocar un aumento en la frecuencia de genotipos homocigotos para alelos realmente favorables, permitiendo estimar los efectos positivos de la consanguinidad sobre los rasgos morfológicos (Bussiman et al., 2018) y al mismo tiempo, en términos de cambiar su estructura genética a favor de los homocigotos, resultará en una pérdida de diversidad genética, lo que puede afectar la aptitud de la población (Pjontek et al., 2012).
Cuadro 4. Valores de los principales parámetros de endogamia en el Caballo de Paso ecuatoriano

PT=Población total analizada; PE=Población registrada en Ecuador; PR=Población de referencia; Ne=Tamaño efectivo de la población
El promedio de AR para el CPP en la PT y PE son superiores a los reportados en animales Anglo-Árabe de Cerdeña con 2.48% (Giontella et al., 2020), Maremmano con registro con 5.52% (Giontella et al., 2019) y Criollo brasilero con 0.65% (Maciel et al., 2013). La PE posee un AR similar al Hucul húngaro con 10.39% (Somogyvári et al., 2018), y la PT es inferior a los promedios indicados a la población de Hucul eslovaco con 9.34% (Pjontek et al., 2012) y de Kladruber con 21% (Vostra et al., 2016). El parentesco medio para la PR estudiada es superior al valor encontrado en las poblaciones de referencia de caballos árabes turcos con 9.5% (Duru, 2017), población de animales vivos en Maremmano con 6.13% (Giontella et al., 2019) e Hispano-Árabe con 0.17% (Gómez, 2016), similar al Pura Raza Español con 11.31% (Perdomo-González et al., 2020) e inferior a las poblaciones de referencia del caballo Lusitano con 13.54% (Vicente et al., 2012).
La Fi de las poblaciones de referencia es mayor que la mayoría de poblaciones totales analizadas en todas las razas de este estudio e inclusive en otras especies de animales domésticos y la misma tendencia se observa con el AR, por lo que se asume que el CPP, al ser una población pequeña, está representada por una mayor cantidad de individuos con niveles altos de Fi y de AR en comparación con la PT, ya que esta última involucra mayor cantidad de individuos, incluyendo fundadores y otros que tienen una Fi bajo o igual a cero.
Los promedios de ΔFi de las tres poblaciones analizadas de CPP son superiores a los reportados en poblaciones de Maremmano con 0.21% (Giontella et al., 2019), donde solo el Hucul eslovaco con 1.06 (Pjontek et al., 2012) posee medias similares a la PT y PE e inferior a la PR. El Ne obtenido por incremento de consanguinidad en las poblaciones analizadas es superior a la población de caballos Pantaneiros con 25.8 (McManus et al., 2013) e inferior a otras poblaciones de caballos analizadas como Anglo-Árabe de Cerdeña con 196.32 (Giontella et al., 2020), Campolina con 93 (Bussiman et al., 2018) y Criollo brasilero con 98.94 (Maciel et al., 2013).
La importancia del ΔFi como indicador de Fi radica en que dos individuos pueden tener el mismo nivel de Fi, pero derivan de diferente número de generaciones y pueden expresar diferente depresión endogámica (Domínguez et al., 2014); por lo que es considerado uno de los principales parámetros del seguimiento de la diversidad genética (Vostrá-Vydrová et al., 2016). La Organización de la Naciones Unidas para la Alimentación y la Agricultura (FAO) recomienda restringir el ΔFi por debajo del 1%, y mejor aún por debajo del 0.5% (Krupa et al., 2015). Por otro lado, los valores de Ne, derivados de ΔFi, no deben ser inferiores de 50 individuos (Vostrá-Vydrová et al., 2016; Silva-Faria et al., 2021), lo que resultaría en una rápida fijación de genes recesivos deletéreos (Hartfield y Glémin, 2014). Es así que para evitar la depresión por endogamia a corto plazo se sugiere un valor mínimo de Ne superior a 50, pero en el largo plazo se debe monitorear poblaciones aún más grandes para evitar la depresión endogámica en los rasgos de aptitud, reproducción y supervivencia (Bussiman et al., 2018).
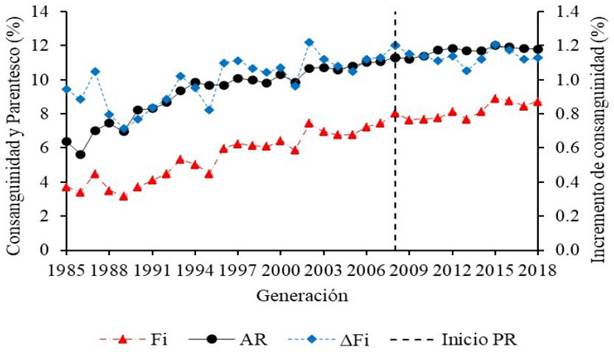
Figura 1 Variación anual del promedio de consanguinidad (Fi), parentesco (AR) e incremento de consanguinidad individual (ΔFi) de la población registrada del Caballo Peruano de Paso en Ecuador y de su población de referencia (2008-2018).
Los niveles altos de Fi, AR, ΔFi y los valores bajos de Ne indican la pérdida de variabilidad genética y la posible expresión fenotípica de defectos genéticos (Pjontek et al., 2012) e incluso una población con un Ne bajo tiene una mayor probabilidad de extinción (Duru, 2017). Algunos estudios revelaron que poblaciones cerradas, con múltiples generaciones de intensa selección direccional y alto éxito reproductivo por el uso de tecnologías reproductivas avanzadas, tienden a acumular endogamia y perder variabilidad genética (Perdomo-González et al., 2020).
La variación de los niveles de Fi y AR desde el inicio en el registro genealógico de la ANECPCP hasta 2018 y de los animales considerados dentro de la población de referencia que arranca desde 2008 tiende a un ligero incremento con el tiempo (Figura 1). Sin embargo, el nivel de Fi en la PE alcanza a su máximo histórico en 2015 con 8.91%, con una baja en 2017 e incremento en 2018. Comportamiento donde se puede ver que el incremento de consanguinidad llega a su máximo histórico de 1.22% en 2014, mientras que el nivel de parentesco llega a su valor más alto en 2015 con 12.02% y disminuye gradualmente hasta 11.81% en 2018.
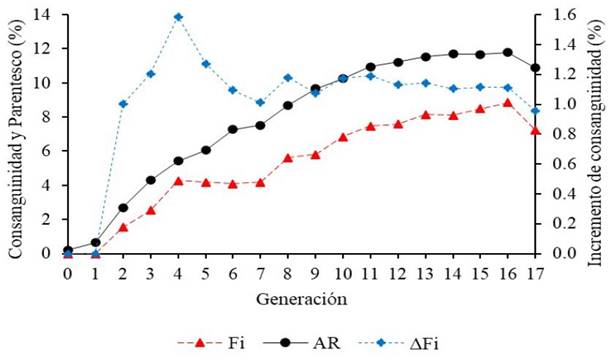
Figura 2 Variación generacional de la consanguinidad (Fi), parentesco (AR) e incremento de consanguinidad individual (ΔFi) de la población total del Caballo Peruano de Paso en Ecuador
El 58.86% de los animales de la PT tienen una Fi<6.25%, seguido por el 30.47% de los animales con Fi entre 6.25 y 12.5%. Similares proporciones de frecuencias se encontró en la PE con 51.56 y 38.13% para Fi<6.25% y entre 6.25 y 12.5%, respectivamente; en el caso de la PR son más representativos con el 54.36% los animales con Fi entre 6.25 y 125.5%, seguidos por el 34.05% de animales con Fi<6.25%.
A nivel generacional, se observa en la PT que tanto el nivel de consanguinidad como de parentesco se incrementan paulatinamente a través de cada generación, hasta alcanzar los valores máximos en la décima sexta generación con 8.85 y 11.78% respectivamente (Figura 2). El ΔFi tuvo un comportamiento irregular hasta la onceava generación, donde se estabiliza y empieza a descender paulatinamente. No obstante, en la décima séptima generación se puede ver un notable descenso para los tres parámetros con 7.22% de Fi, 10.88% de AR y 0.96% de ΔFi (Figura 2).
Probabilidades de Origen de los Genes
En el Cuadro 5 se observa que el número de fundadores para PT, PE y PR es de 568, 550 y 477 y el número de ancestros es de 488, 409 y 323, respectivamente. Si bien el CPP es una raza nueva, se debe considerar que solo se está analizando la población de CPP que dieron origen a los animales registrados en Ecuador, por lo que no se puede concluir en comparación con el total de raza y se debe tomar en cuenta la profundidad de pedigrí de los animales analizados, el tiempo transcurrido del libro genealógico y la calidad del registro de los datos genealógicos (Cervantes et al., 2008). Al relacionar el número efectivo de fundadores (fe) con el número efectivo de ancestros (fa) se obtuvieron valores de 1.50 para la PT y PE y de 1.73 en la PR, lo que indica que se presentó un efecto de cuello de botella en las tres poblaciones. De la misma forma, al relacionar el número efectivo de genomas fundadores (fg) con el fe, se encontraron valores de 0.46, 0.38 y 0.34 para la PT, PE y PR, respectivamente; lo que indica, que hay pérdida de variabilidad genética por deriva genética.
Cuadro 5. Análisis de las probabilidades del origen de los genes de las poblaciones del Caballo Peruano de Paso registrado en Ecuador

El valor fe en la PT es inferior a los reportados las poblaciones totales de caballos Mangalarga con 1062 (Moura-Baena et al., 2020), Campolina con 83.13 (Bussiman et al., 2018) y Criollo brasilero con 62 (Maciel et al., 2013), y superior solo en Hucul húngaro con 23 (Somogyvári et al., 2018). La PE es inferior a todos los mencionados anteriormente, en tanto que la PR es inferior a las poblaciones de referencia de Mangalarga con 225 (Moura-Baena et al., 2020), Pura Raza Español con 33 (Perdomo-González et al., 2020), y Lusitano con 27.47 (Vicente et al., 2012).
La fa en la PT y PE son inferiores a los valores indicados en Mangalarga con 1038 (Moura-Baena et al., 2020), Campolina con 55.01 (Bussiman et al., 2018), y Criollo brasilero con 45 (Maciel et al., 2013). La PT es similar al Hucul con 16 (Pjonteck et al., 2012). Por otro lado, la PT y PE son superiores al Poni deportivo eslovaco con 7 (Pjonteck et al., 2012). La PR es inferior a las poblaciones de referencia de Mangalarga con 198 (Moura-Baena et al., 2020), Pura Raza Español con 19 (Perdomo-González et al., 2020) y Lusitano con 11.73 (Vicente et al., 2012).
Las reducciones de la variabilidad genética pueden ocurrir debido a la contribución desigual de los fundadores, los cuellos de botella y los eventos de deriva (Bussiman et al., 2018). Dado a que esta relación fe/fa en las tres poblaciones del estudio es mayor a 1, el efecto del cuello de botella será mayor como resultado de una disminución del número de sementales utilizados para el apareamiento a lo largo de las generaciones (Duru, 2017). En el CPP registrado en Ecuador y los padres de estos registrados en Perú, el efecto del cuello de botella se debe a que algunos criadores utilizaron y siguen utilizando para el apareamiento solo sementales que ganaron en las exhibiciones.
El fg para PT y PE son inferiores a los resultados obtenidos en Mangalarga con 150 (Moura-Baena et al., 2020) y Campolina con 46.21 (Bussiman et al., 2018). La PT es superior al Kladruber con 4.78 (Vostrá-Vydrová et al., 2016). La PR es inferior a las poblaciones de referencia de Mangalarga con 133 (Moura-Baena et al., 2020), Lusitano con 6.01 (Vicente et al., 2012) y Hucul húngaro con 5.79 (Somogyvári et al., 2018).
Considerando el número de ancestros que contribuyen al 50% de la variabilidad genética, las tres poblaciones estudiadas son inferiores a las poblaciones de ancestros de la raza Hispano-Árabe con 208 animales (Gómez, 2016), Criollo brasilero con 41 (Maciel et al., 2013) y Lusitano con 14 (Vicente et al., 2012). En el caso del Hispano-Árabe, Gómez (2016) indica que los valores de los ratios entre los fundadores y los ancestros y el número de ancestros que contribuyen sobre el 50% de la variabilidad, son causados por mantener un libro genealógico abierto y, por lo tanto, la inclusión de nuevos genes resulta directamente en la conservación o aumento de la variabilidad genética de la raza.
CONCLUSIONES
A nivel individual de consanguinidad y de relación de parentesco se observa un aumento estable de sus valores desde el inicio del libro genealógico de la ANECPCP hasta 2015, mientras que se presentó un pequeño e irregular descenso entre 2015 y 2017; sin embargo, a nivel generacional se observa un marcado descenso en la última generación lo que demuestra que los criadores tomaron conciencia en el manejo de la consanguinidad.
El incremento de consanguinidad es superior al 1% y el número efectivo de la población menor a 50, contrario a la recomendación de la FAO para la conservación de razas en peligro de extinción.
La pérdida de diversidad genética por efecto del cuello de botella y la deriva genética, se confirmó con los valores de las relaciones entre el número efectivo de fundadores, número efectivo de ancestros y número efectivo de genomas fundadores.
Se requiere que los criadores apliquen una adecuada estrategia de manejo que permita diseñar apareamientos entre animales que tengan menor valor de parentesco y ampliar el uso de sementales para aumentar la base genética de selección.












 uBio
uBio