INTRODUCCIÓN
La doncella, Pseudoplatystoma punctifer (Castelnau, 1855), es una especie que pertenece al grupo de los grandes bagres migradores de la Amazonia, y presenta una alta presión de pesca. Presenta potencial para la diversificación acuícola amazónica por su adaptación al manejo y la calidad de su carne (Kossowski, 1996; Darias et al., 2015), valorada actualmente en los mercados locales entre US$ 11.51 y US$ 12.27 por kilo de carne en estado fresco. Una de las grandes limitantes para la sostenibilidad acuícola se relaciona con el suministro de semilla para mantener ciclos productivos continuos, además, de la baja supervivencia de la fase larval atribuida al canibalismo, aunado a la baja aceptabilidad de los componentes de las dietas (Núñez et al., 2011; Gisbert et al., 2014). Por tal motivo, uno de los temas a tratar está referido a una mejor comprensión de las necesidades nutricionales de la especie en sus estadios tempranos de vida (Darias et al., 2015; Castro-Ruiz et al., 2021).
El hidrolizado proteico de pescado contiene fracciones de dipéptidos y tripéptidos de alta digestibilidad que, al ser suministrados en las dietas, incluso en cantidades mínimas (Yucra, 2016), son absorbidos por los enterocitos con mayor eficiencia que los aminoácidos libres, ya que son menos hipertónicos y presentan transporte facilitado a través de la pared intestinal del pez (Gill et al., 1996; Conceição et al., 2012). Los aminoácidos libres suministrados en la dieta pueden generar toxicidad y/o deficiencia aminoacídica en los peces, toda vez que existen aminoácidos que son movilizados al interior de los enterocitos por el mismo transportador, lo que provoca que se inhiba la absorción de un tipo de aminoácido frente a la mayor presencia de otro (Baldisserotto, 2013).
El hidrolizado proteico de pescado es considerado un ingrediente potencial en la formulación de dietas para acuicultura, pues posee péptidos bioactivos que actúan como agentes antibacterianos y antioxidantes, y poseen características atractantes y reguladoras de la actividad digestiva reforzando el sistema inmunitario, favoreciendo el desempeño productivo de peces marinos, como salmón del Atlántico (Salmo salar), lubina europea (Dicentrarchus labrax) y corvina amarilla (Pseudosciaena crocea) con niveles de inclusión dietética entre el 10 al 15% (Hevrøy et al., 2005; Kotzamanis et al., 2007; Tang et al., 2008). En relación a especies dulceacuícolas, niveles de inclusión de 1.20 a 20% promovieron el mejor crecimiento en juveniles de trucha arcoíris (Oncorhynchus mykiss) (Yucra, 2016; López-Macías y Salas-Benavides, 2020), mientras que niveles de inclusión de 4.75 y 10% favorecieron al desempeño zootécnico de poslarvas de arahuana (Osteoglossum bicirrhosum) y poslarvas de tilapia del Nilo (Oreochromis niloticus), respectivamente (Paz et al., 2016; Silva et al., 2017).
Por otro lado, es de entenderse que, a mayor nivel de inclusión de hidrolizado proteico de pescado como insumo dietético hay un incremento en el costo de producción, por lo que niveles mínimos de inclusión que promuevan mejor desempeño en los peces tienen que ser investigados. El presente estudio tuvo como objetivo evaluar el efecto de la inclusión en la dieta de 1.2% de hidrolizado proteico de pescado sobre el crecimiento corporal y la composición proximal del músculo de juveniles de doncella.
MATERIALES Y MÉTODOS
Dietas Experimentales
Dos dietas isoproteicas (42.15% PB) e isoenergéticas (4,415.69 kcal EB kg-1) fueron formuladas y preparadas siguiendo las recomendaciones sobre la preparación de dietas balanceadas para especies carnívoras tropicales (Cyrino et al., 2013): una dieta testigo (DT; sin inclusión de hidrolizado) y otra con inclusión de 1.20% de hidrolizado proteico de pescado (DHP) en substitución de la harina de pescado, de acuerdo a la mínima inclusión que favoreció el crecimiento en juveniles de trucha arcoíris (Yucra, 2016) (Cuadro 1).
Los ingredientes fueron pulverizados y homogenizados en una mezcladora de 500 kg de capacidad durante 10 minutos, extruidas a 0.6 mm de diámetro de pellet y secadas en horno a gas en torno a 60 °C durante 24 h. El hidrolizado proteico líquido de pescado (Aqua Natural Fish 40% Líquido®) se agregó mediante aspersión después del proceso de secado y enfriamiento de los pellets. Ambas dietas fueron almacenadas bajo congelamiento (- 4 °C) en sacos con aislante de luminocidad para evitar fotoxidación de nutrientes, principalmente lípidos, hasta su uso en el experimento.
Cuadro 1. Formulación y composición proximal de las dietas experimentales para doncella (Pseudoplatystoma punctifer)
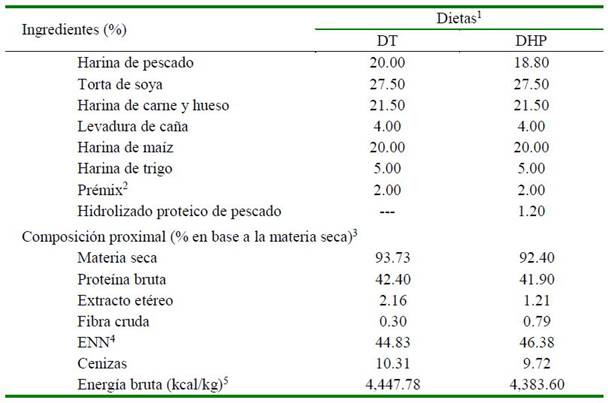
1 DT = dieta testigo; DHP = dieta com hidrolizado proteico líquido de pescado (Aqua Natural Fish 40 Líquido®). 2 Premezcla de vitaminas y minerales (DSM Acuacultura) - DSM es una premezcla de vitaminas Rovimix®, minerales Microgran®, BHT y BHA (antioxidantes) para uso animal, elaborado por DSM Nutritional Products Perú, contiene por producto de 20 kg: vitamina A 9 334 000 UI; vitamina D3 1 866 800 UI; vitamina E 93 333 UI; vitamina K3 5.33 g; tiamina (B1) 12.0 g; riboflavina (B2) 13.32 g; piridoxina (B6). 10.0 g; vitamina B12 0.02 g; ácido ascórbico 210.0 g; niacina 100.0 g; ácido pantoténico 33.32 g; ácido fólico 2.67 g; biotina 0.53 g; cobre 1.00 g; hierro 13.33 g; manganeso 26.66 g; cobalto 0.10 g; yodo 1.00 g; zinc 13.33 g; selenio 0.20 g; antioxidantes 26.60 g; excipientes c.s.p. 2 000 g. 3 Promedios de análisis de muestras por duplicado son mostrados. 4 ENN = extracto no nitrogenado = 100-(proteína bruta + extracto etéreo + fibra cruda + cenizas) (NRC, 2011). 5 Energía bruta basada en los valores calculados para proteína, 5.64 kcal/g; lípidos, 9.44 kcal/g; carbohidratos, 4.11 kcal/g (NRC, 2011).
Muestreos
El experimento se desarrolló en la Unidad de Producción de Peces Migratorios de la Estación Pucallpa del Instituto Veterinario de Investigaciones Tropicales y de Altura de la Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, ubicada en el km 59 de la carretera Federico Basadre, Provincia de Coronel Portillo, Distrito de Campoverde, Región Ucayali (Perú).
Un total de 114 juveniles de doncella (642.65 g; 47.93 cm) fueron distribuidos aleatoriamente en seis estanques excavados de 200 m2 de espejo de agua (19 peces por estanque) de acuerdo a densidad recomendada para su crianza (Affonso y Ono, 2016). Los estanques fueron previamente preparados conforme recomendaciones técnicas de Affonso y Ono (2016), con intercambio diario de agua del 1% del volumen aproximado de agua para reponer posibles pérdidas por evaporación. Inicialmente, todos los peces recibieron DT por un periodo de 10 días con el fin de que se aclimataran a las condiciones de crianza. Luego, los peces fueron alimentados con las dietas experimentales de manera diferenciada, donde los peces de tres estanques asignados al azar recibieron DT mientras que los peces de los otros tres estanques recibieron DHP. El experimento tuvo una duración de 60 días, el alimento fue ofrecido dos veces al día (08:00; 16:00) considerando una tasa de alimentación diaria del 1% en relación a la biomasa. Los parámetros de calidad de agua de cada uno de los estanques fueron monitoreados, diariamente para temperatura, pH y oxígeno disuelto utilizando un equipo multiparámetro de análisis de agua (Hanna-HI98194) y semanalmente para CO2 y amonio utilizando test de colorimetría (LaMotte AQ-2).
Ocho peces por estanque fueron capturados cada dos semanas con red anchovetera de 0.25" de abertura de malla para medirlos y pesarlos. Se consideró el peso final; longitud final; ganancia de peso [peso final - peso inicial]; ganancia en longitud [longitud final - longitud inicial]; tasa de crecimiento específico [100×(ln peso final-ln peso inicial)/días de experimento]; conversión alimenticia [consumo de alimento/ganancia de peso]; tasa de eficiencia proteica [ganancia de peso/consumo de proteina×100]; sobrevivencia [(número final de peces×100)/ número inicial de peces] y factor de condición [peso/longitud3].
Adicionalmente, al iniciar (día 0) y al finalizar (día 60) el experimento, tres peces por estanque fueron sacrificados por punción cerebral e inmediatamente puestos en cooler isotérmico con hielo en gel y transportados hasta el Laboratorio de Nutrición y Reproducción de Peces Amazónicos de la Estación IVITA Pucallpa. Se extrajeron filetes del lado izquierdo y derecho, que fueron picados, molidos y mezclados en un único pool por tratamiento. Esas muestras se empaquetaron en recipientes de plástico con tapa hermética, se colocaron en un cooler isotérmico con hielo en gel y se enviaron al Laboratorio de Bioquímica, Nutrición y Alimentación Animal de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Mar- cos, en Lima, para los análisis de composición proximal.
Las muestras de las dietas elaboradas y de la carne del pescado procedente del experimento fueron analizadas en términos del contenido de humedad, materia seca, proteína cruda, extracto etéreo, fibra cruda, cenizas y extracto no nitrogenado. La composición proximal fue determinada de acuerdo a los procedimientos descritos en AOAC (2005) y el extracto no nitrogenado por diferencias en la materia seca según NRC (2011).
Todos los procedimientos experimentales se llevaron a acabo de acuerdo con las directrices bioéticas establecidas por CONCEA (2013) y Jenkins et al. (2014).
Delineamiento Experimental y Análisis Estadístico
La homogeneidad inicial del peso de los peces fue confirmada por la prueba Q de Cochran (p<0.05) y la normalidad de los datos mediante la prueba de Shapiro-Wilk (p<0.05). El estudio siguió un diseño experimental completamente al azar con un arreglo factorial de 2 x 4 [2 dietas (DT y DHP) vs. 4 tiempos de muestreo (15°, 30°, 45° y 60° día)], resultando en 8 tratamientos con 3 repeticiones cada uno. Los tratamientos fueron. T1: DT15; T2: DHP15; T3: DT30; T4: DHP30; T5: DT45; T6: DHP45; T7: DT60 y T8: DHP60. Para este estudio el grado de libertad del residuo fue de 15 [2x4=8 tratamientos (gl=7); 8x3=24 observaciones (gl total=23); gl del residuo=23-7=15] el cual es considerado adecuado para experimentación (mayor que 10). Además, para la determinación de la repeticiones (triplicado), se utilizó el principio de reducción a las 3Rs en experimentación animal (replace, reduction and refinament), lo que permite afirmar que tres repeticiones por tratamiento fueron apropiadas para verificar diferencia estadística entre los tratamientos (NRC, 2011).
Cuadro 2. Parámetros de calidad de agua (promedio) de los estanques (unidades experimentales) analizados durante los 60 de experimento
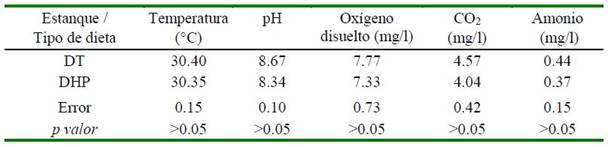
Dietas: DT = Dieta testigo; DHP = dieta con inclusión de 1.20% de hidrolizado proteico líquido de pescado en substitución de la harina de pescado
Las unidades experimentales fueron estanques excavados de 200 m2 de espejo de agua. Los datos del desempeño en crecimiento fueron sometidos a una prueba de análisis de varianza (ANOVA) de dos factores (dieta vs. tiempo) y posteriormente, cuando la interacción fue significativa, los datos se compararon por el test de Tukey (p<0.05); sin embargo, los factores se analizaron independientemente cuando no hubo interacción entre ellos. Los datos iniciales y finales de composición proximal de la carne del pescado se analizaron mediante ANOVA de un factor (p<0.05). Se utilizó el software Statistic 10.0.
RESULTADOS Y DISCUSIÓN
La calidad de agua de las unidades experimentales (Cuadro 2) se mantuvo constante durante todo el experimento, sin diferencia entre estanques y dentro del rango adecuado para la crianza de bagres amazónicos (Ríos, 2016), debido a las acciones diarias de monitoreo y la aplicación de buenas prácticas acuícolas a lo largo del experimento (Affonso y Ono, 2016). Con eso, la calidad de agua de los estanques no fue un factor influyente para el crecimiento de juveniles de doncella. Es importante acentuar esto porque desequilibrios del ambiente acuático pueden constituirse en factores estresantes que alteran directamente el metabolismo de los aminoácidos corporales y dietéticos como estrategia para combatir una inestabilidad homeostática (Gill et al., 1996; Conceição et al., 2012).
No hubo interacción significativa entre los factores dieta x tiempo para ninguno de los parámetros de crecimiento corporal analizados (p>0.05), por lo que los factores se sometieron a análisis por separado. Si bien la longitud total final y ganancia en longitud se incrementaron por efecto del tiempo (de 47.93 a 53.39 cm), no hubo efecto diferencial causado por las dietas DT y DHP para esos parámetros de crecimiento (p>0.05). De similar modo, las dos dietas experimentales no influenciaron los parámetros de tasa de eficiencia proteica (0.22%), sobrevivencia (100%) y factor de condición (0.006), con valores que se mantuvieron constantes a lo largo del experimento (p>0.05) (Cuadro 3).
Cuadro 3. Crecimiento corporal de doncella(Pseudoplatystoma punctifer) alimentada con dieta con inclusión de hidrolizado proteico de pescado
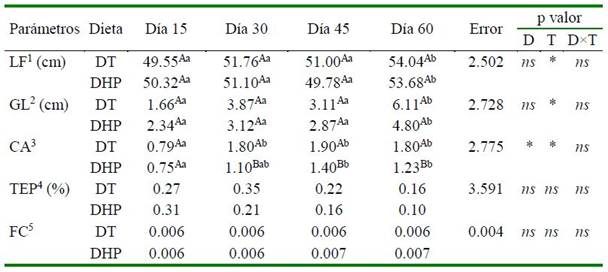
Dietas: DT = Dieta testigo; DHP = dieta con inclusión de hidrolizado proteico líquido de pescado. P valor: D = dieta; T = tiempo; D×T = interacción entre factores; ns = no significativo; * = significativo (p<0.05). Las interacciones D×T no fueron significativas de modo que los factores se analizaron separadamente. Letras mayúsculas indican diferencia entre las dietas en el mismo tiempo, mientras que letras minúsculas indican diferencia entre los tiempos en la misma dieta. 1 LF = Longitud final; 2 GL = Ganancia en longitud (acumulado desde el período inicial del experimento); 3 CA = Conversión alimenticia; 4 TEP = Tasa de eficiencia proteica; 5 FC = Factor de condición.
Se observó un incremento del peso de los animales a lo largo del estudio, sin diferencia estadística por influencia de las dietas hasta los 45 días de ensayo, pero con efecto diferencial a los 60 días de experimentación (p<0.05), pasando de 642.65 a 919.56 y 1049.17 g al finalizar el experimento para peces alimentados con DT y DHP, respectivamente, indicando una mayor ganancia de peso para los peces que consumieron la ración experimental (Figura 1a,b). Estos resultados difieren de lo reportado para juveniles de rodaballo (Scophthalmus maximus) y juveniles de paiche (Arapaima gigas) donde la suplementación con hidrolizado proteico de pescado en niveles de hasta 20 y 25%, respectivamente, respectivamente, no influenció el crecimiento (Oliva-Teles et al., 1999; Ribeiro et al., 2017), lo que podría explicarse por la capacidad de las especies de digerir proteínas dietéticas no fraccionadas, así como por la calidad del hidrolizado proteico de pescado (Furlan y Oetterer, 2002). No obstante, los resultados del presente estudio coindice con ensayos de inclusión entre el 10 al 15% de hidrolizado proteico derivado de pescado en dietas para especies marinas como salmón del Atlántico, lubina europea y corvina amarilla (Hevrøy et al., 2005; Kotzamanis et al., 2007; Tang et al., 2008).
Existen reportes que muestran un mejor desempeño en peces de aguas continentales alimentados con dietas suplementadas con hidrolizado proteico de pescado, como lo sucedido en las fases poslarvales de arahuana y tilapia del Nilo, así como en juveniles de trucha arcoíris en niveles de 4.75% (Silva et al., 2017), 10% (López-Macías y Salas-Benavides, 2020) y 1.20% de inclusión (Yucra, 2016). Este estudio reporta una experiencia alentadora que buscar promover un mejor crecimiento corporal de doncellas con la inclusión mínima (1.20%) de hidrolizado proteico de pescado, buscando contribuir al no incremento de los costos por alimentación en esta especie y favorecer su rendimiento.
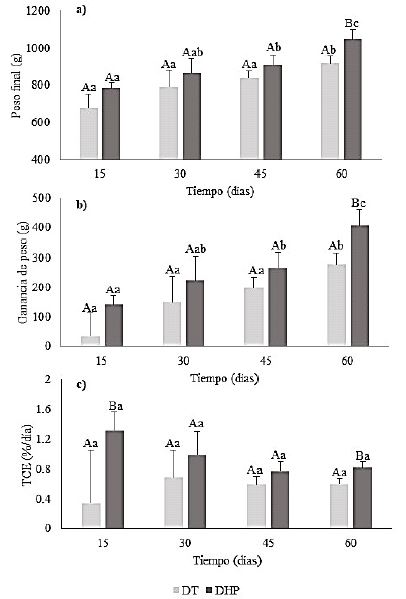
Figura 1 Comportamiento productivo de doncellas (Pseudoplatystoma punctifer) alimentada con dieta con inclusión de hidrolizado proteico de pescado en condiciones experimentales durante 60 días. a) Peso final, b) ganancia de peso, c) tasa de crecimiento específico (TCE). Como la interacción Dieta × Tiempo no fue significativa (p>0.05), los factores se analizaron separadamente. Letras mayúsculas indican diferencia entre las dietas en el mismo tiempo, mientras que letras minúsculas indican diferencia entre los tiempos en la misma dieta (p<0.05). Dietas: DT = Dieta testigo; DHP = dieta con inclusión de hidrolizado proteico líquido de pescado. Barras verticales denotan desviación estándar de la media
La tasa de crecimiento específico (Figura 1c) se mantuvo en torno de 0.76%/día; no obstante, expresó valores más altos en doncellas alimentadas con DHP a los 15 (1.32) y 60 días (0.82) del ensayo cuando comparadas con peces alimentados con DT en esos tiempos (0.34 y 0.60 al día 15 y 60, respectivamente). La respuesta inmediata observada a los 15 días puede estar relacionada a las características atractables de la dieta suplementada con hidrolizado proteico de pescado y/o a la absorción facilitada en la pared intestinal conferida a los péptidos (Gill et al., 1996; Chotikachinda et al., 2013); no obstante, esa respuesta no fue suficiente para causar efecto diferencial en la ganancia de peso durante los primeros 45 días de ensayo.
Los mejores valores de conversión alimenticia se observaron a los 15 días de muestreo, pero sin diferencia entre las dietas experimentales, indicando un probable crecimiento compensatorio en los peces por posibles deficiencias alimenticias previas al experimento. En todos los muestreos, la mejor conversión alimenticia se observó en los peces con la dieta suplementada, aunque los efectos en ganancia de peso solo se visualizaron a los 60 días de experimento.
La inclusión dietética de hidrolizado proteico de pescado no afectó el contenido de humedad (78.65%), ceniza (1.38%), proteína cruda (19.72%), extracto etéreo (0.41%) y extracto no nitrogenado (no detectable) de la carne de doncella en comparación con los valores registrados para los peces alimentados con la dieta testigo (p>0.05). Posiblemente, esto resulte de la formulación isoproteica e isoenergética de las dietas (NRC, 2011). Los resultados del contenido de lípidos en el músculo indican que su característica corresponde a la de un pez magro (<4% de extracto etéreo) de acuerdo a la clasificación realizada por Ackman (1989).
Los escasos estudios enfocados a la alimentación sobre el desempeño de productivo de la doncella se encuentran mayormente relacionados a las fases tempranas de vida del pez (Darias et al., 2015; Castro-Ruiz et al., 2021). Es recomendable realizar ensayos con niveles mayores de inclusión de hidrolizado proteico de pescado en la alimentación de doncella en sus diferentes fases de vida, buscando optimizar el crecimiento en menores tiempos de alimentación, acompañados de evaluaciones económicas.
CONCLUSIONES
La dieta con suplementación de 1.2% de hidrolizado proteico líquido de pescado no afectó la longitud total, ganancia de longitud, tasa de eficiencia proteica, sobrevivencia y factor de condición, así como tampoco afectó la composición proximal del músculo de doncella.
Doncellas juveniles alimentados con dieta suplementada con 1.2% de hidrolizado proteico de pescado presentaron mayor peso final, ganancia de peso y tasa de crecimiento específico a los 60 días de alimentación, así como mejor conversión alimenticia en comparación con una dieta sin suplementación.












 uBio
uBio 

