INTRODUCCIÓN
La ovulación es inducida por la cópula en la alpaca y la llama (San Martin et al., 1968; England et al., 1969), en tanto que la eyaculación seminal es intrauterina (Franco et al., 1981), tal y como fue encontrado en camellos (Chen et al., 1985), además de encontrar la existencia de un «Factor Inductor de la Ovulación» en el plasma seminal al ser aplicado en el útero de la camella. Similar resultado fue replicado en alpacas (Ríos et al., 1985; Panez et al., 2009).
Estudios bioquímicos del plasma seminal de alpacas reportan la presencia de un factor de crecimiento neurotrópico β como el factor responsable de la ovulación (Adams et al., 2016; Ratto, 2016); sin embargo, esto no explica el 5 a 20% de ovulación espontánea reportada en diversos estudios (Fernández- Baca et al., 1970b; Sumar, 1985) y de 40% encontrados por laparoscopia en hembras expuestas al macho al chequeo de celo cada semana durante la estación sexual (Leyva y Sumar, 1987), donde solo hubo contacto físico.
En el proceso de empadre se observan diversas manifestaciones del comportamiento sexual del macho como el sonido gutural (Fernández-Baca y Novoa, 1968; Novoa, 1970; England et al., 1971; Sumar y García, 1986), el movimiento semicircular del pene (Tibary, 2003) alrededor de la vulva para de- tectar la entrada de la vagina e iniciar la penetración (Novoa y Leyva, 1996) hasta alcanzar los cuernos uterinos (Franco et al., 1981), donde el frote continuo del pene resulta en una inflamación del endometrio (Bravo et al., 1996). Se desconoce si estas características sexuales del empadre influyen en el proceso de ovulación.
Para el presente estudio se hipotetizó que, en ausencia del plasma seminal, el proceso para la cópula intrauterina involucra otros factores de estímulos para inducir la ovulación. Por consiguiente, el objetivo del presente estudio fue evaluar el efecto del proceso del comportamiento sexual en la cópula con machos castrados en la inducción de la ovulación. Se tomó como base el efecto de la castración en la eliminación del plasma seminal como consecuencia de la regresión de las glándulas accesorias del aparato reproductor del macho, reportado en varios estudios (Raeside et al., 1997; Neves et al., 2013; Gofur et al., 2014).
MATERIALES Y MÉTODOS
El estudio se realizó durante la estación sexual entre enero y abril en el Centro Experimental (C.E.) «La Raya» de la Universidad Nacional del Altiplano, ubicado en el distrito de Santa Rosa, provincia de Melgar, región de Puno, Perú, a una altitud aproximada de 4400 msnm. En esta región, el clima es variado, registrándose temperaturas de 14.2 °C como máximo en los meses de octubre y noviembre, y mínima de -14.9 °C en los meses de junio y julio, siendo la temperatura media de 6.2 °C y una precipitación pluvial anual de 526 mm anual (SENAMHI, 2012).
Animales
Los animales pastoreaban sobre praderas de pastura nativa y para el empadre controlado se dispuso de 8 boxes (6 x 3 m cada uno) armados con paneles metálicos.
Se seleccionaron seis machos adultos (8 a 10 años) del núcleo de reproductores del C.E. La Raya. Los machos presentaban capacidad reproductiva comprobada a través de los registros de empadre, y durante la monta exhibían comportamiento sexual eserado (adecuada libido y sonido gutural en el cortejo, monta erección y penetración). Asimismo, del núcleo de reproductoras Suri se seleccionaron de manera aleatoria 60 hembras con aptitud de ser receptivas del macho, en celo, con antecedentes de partos previos, sin cría al pie y sin problemas reproductivos aparentes.
Procedimiento Experimental
Un mes antes del inicio del empadre se evaluó el comportamiento sexual y el estado clínico de los órganos reproductores de los seis machos. Tres fueron castrados y los otros tres fueron vasectomizados, este último grupo como grupo control de los castrados por poseer solo el plasma seminal de las glándulas accesorias con el factor neurotrópico para la ovulación. Las intervenciones quirúrgicas para la castración y vasectomía fueron realizadas 21 días previos al inicio del experimento.
Los animales fueron pesados (balanza tipo rampa, marca T-Scale, modelo BW con una precisión 0.5kg). La castración se realizó mediante el método quirúrgico tradicional. La anestesia se logró con una inyección IM de una combinación de 3 mg/kg de ketamina,
0.3 mg/kg de xilacina y lidocaína al 2%. Los machos fueron inmovilizados en decúbito lateral y castrados mediante un abordaje escrotal y una técnica cerrada. Cada testículo se extrajo tras la ligadura del cordón espermático con sutura absorbible. Los sitios de la incisión de castración se dejaron abiertos para la curación por segunda intención (Ciccarelli et al., 2018), y para evitar posibles infecciones se administró antibióticos (penicilina-estreptomicina). Los días -1, 15, 17, 21 y 51 de la castración se realizó la evaluación de las fases del comportamiento sexual de los machos (libido, erección del pene y sonido gutural) y se determinó si hubo presencia de fluido seminal con la técnica de electro eyaculación.
Para la vasectomía, la técnica de anestesia fue la misma que la usada para la castración y la sujeción de los animales fue en posición de cúbito dorsal. La región inguinal fue higienizada para la cirugía. Se realizó una incisión cutánea de 2 cm sobre el cordón espermático equidistante entre el testículo correspondiente y el anillo inguinal, se identificó el conducto deferente, y con pinzas hemostáticas se aisló un segmento de aproximadamente 2 cm. Se colocaron dos ligaduras (de sutura 2-0 PDS) alrededor del segmento, se incidió y se retiró el segmento. La túnica se dejó abierta y la piel se cerró con PDS 2-0 mediante un patrón de sutura sim- ple interrumpida, y para evitar posibles infecciones se administraron antibióticos (penicilina-estreptomicina). Los animales del grupo fueron monitoreados para detectar complicaciones posoperatorias, y antes del inicio del experimento (días 16 y 18 posvasectomía) se evaluó el comportamiento sexual y por electro eyaculación la presencia de plasma seminal (P. Sem) y microscópicamente la ausencia de espermatozoides.
El plasma seminal para ser usado en la inseminación artificial (IA) fue colectado de los machos vasectomizados, según la técnica descrita por Director et al. (2004), en tubos falcón de 15 ml, y para su conservación se almacenaron alícuotas en tubos falcón de 50 ml a -20 °C. Para el empadre controlado, las 60 hembras fueron presentadas al macho y se seleccionaron 45 de ellas que mostraron receptividad en el tiempo más breve adoptando la posición de cópula y que a la observación ecográfica transrectal de los ovarios presentaron un folículo entre 7 y 10 mm de diámetro.
Diseño Experimental
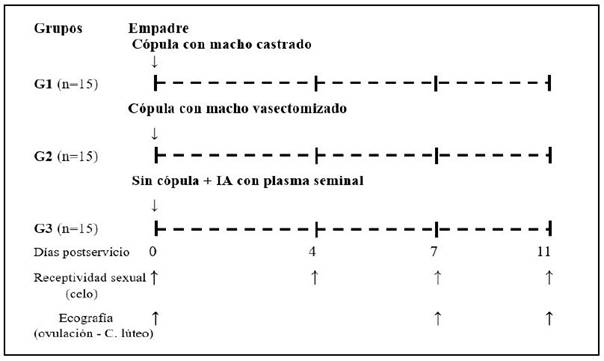
Las 45 hembras seleccionadas fueron distribuidas aleatoriamente en forma equitativa en tres grupos de 15 animales, según el diseño experimental mostrado en la Figura 1.
Las hembras de los grupos G1 y G2 recibieron cópula efectiva de 15 minutos de machos castrados y vasectomizados, respectivamente, asegurando un mínimo de tres hembras para cada macho. Ante la mayor disponibilidad de hembras en celo en un día determinado se asignó una hembra más a los machos de mayor actividad. A las hembras de G3 solo se les depositó 3 ml de plasma seminal en el cuerpo del útero vía infusión (similar al procedimiento de la IA), con la ayuda de un proctoscopio de uso humano, adaptado con fuente de luz, como espéculo (Alarcón et al., 2012).
La ocurrencia de ovulación en las hembras fue determinado el día 4 pos-cópula mediante su comportamiento sexual frente al macho, siendo el rechazo el indicador de ovulación. El día 7 y 11 se comprobó la presencia de un cuerpo lúteo activo, como indicador de haber ocurrido ovulación mediante ecografía transrectal de los ovarios, verificándose además el comportamiento sexual de rechazo.
La tasa de ovulación, receptividad sexual y presencia del cuerpo lúteo de los grupos experimentales fue expresada en porcentaje y la diferencia estadística entre ellas fue analizada mediante la prueba del Chi cuadrado.
RESULTADOS Y DISCUSIÓN
El Cuadro 1 muestra que la casi totalidad de hembras son receptivas al macho en el día 4 pos-cópula, a excepción de una hembra (7%) del G1; mientras que en el día 7, este comportamiento sexual es inverso, con un incremento en el porcentaje de hembras con presencia de CL activo que rechazan al macho (p<0.05) en el grupo vasectomizado (93%). Estos resultados concuerdan con el reporte de Leyva y García (1999) sobre el mayor porcentaje de hembras que muestran no receptividad (rechazo) después del día 3 de la ovulación (día 4 pos-cópula) por el efecto inhibitorio de la P4 (>1 ng/ml plasma sanguíneo) (Adam et al., 1989; Adams et al., 1991; Aba et al., 1995), que logra la secreción de un cuerpo lúteo activo. Este efecto hormonal desaparece desde el día 9 por efecto de la luteolisis del cuerpo lúteo (Fernández- Baca et al., 1970a; Adams et al., 1991), como se observa en el día 11 (Cuadro 1). De manera que todas las hembras vuelven a ser receptivas al macho.
Es remarcable la inducción de la ovulación por efecto de la cópula de macho castrado, considerando el posible efecto de la castración en la regresión y/o limitada secreción de las glándulas accesorias. En cerdos. Raeside et al. (1997), así como en ovinos y caprinos (Neves et al., 2013; Gofur et al., 2014) se ha demostrado que la castración conduce a la regresión de las glándulas accesorias del macho y de su actividad secretora (Risbridger y Taylor, 2006) desde los 15 días hasta la atrofia morfológica y funcional completa a los 30 días de la castración (Raeside et al., 1997; Neves et al., 2013; Gofur et al., 2014), y disminución o ausencia de la libido sexual (Pinckard, 1998).
El líquido seminal obtenido por electro eyaculación previo a la castración (1.2 ml) disminuyó a 0.4 y 0.3 ml a los 21 y 51 días pos-castración (Cuadro 2); sin embargo, los machos exhibieron las fases completas del comportamiento sexual (Cuadro 3: libido, sonido gutural, erección y copulación) hasta 51 días post-castración. No se descarta la presencia del factor neurotrópico β en la mínima cantidad de líquido seminal obtenido; sin embargo, el nivel presente sería muy reducido e insuficiente para inducir el efecto necesario para provocar el pico de LH y la consecuente ovulación. Tanco et al. (2011) determina ron el nivel apropiado del Factor neurotrópico en llamas; el cual debe estar presente en el volumen de 3-4 ml del plasma seminal que se obtiene por electro eyaculación (Giuliano et al., 2008; Casaretto et al., 2012) y por colección de semen con vagina artificial (Lichtenwalner et al., 1996; Baer y Hellemann, 1998); mientras que en alpacas este nivel debe estar en 1.5-2.5 ml de plasma seminal obtenido por electro eyaculación o vagina artificial (Sumar y Leyva, 1981; Cárdenas et al., 1987; Ordoñez et al., 2013).
Cuadro 1 Porcentaje de ovulación estimado mediante el comportamiento sexual (rechazo de la hembra al macho) el día 4 y complementado con ecografía ovárica para identificación de la presencia de cuerpo lúteo en el día 7 y 11 pos-cópula (n=15 hembras por grupo)
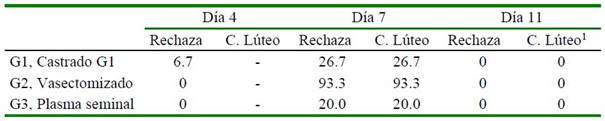
1 Solo se encontraron cuerpos lúteos en regresión
Ovulación día 4 G1 vs G2 X2c = 1.03; X2t (α 0.05; 1) = 3.84; p = 0.31
Ovulación día 7 G1 vs G2 X2c = 13.89; X2t (α 0.001; 1) = 10.83; p = 0.0002
Ovulación día 7 G2 vs G3 X2c = 16.43; X2t (α 0.001; 1) = 10.83; p = 0.0001
Cuadro 2 Volumen del plasma seminal (P. Sem) y presencia de espermatozoides en el eyaculado de machos previo a la castración (pre-C), y 21 y 51 días pos-castración (pos-C)
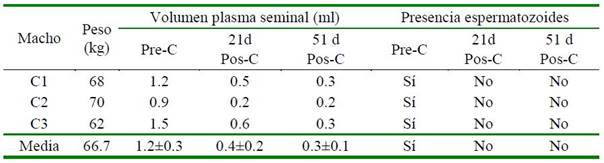
Vol. P. Sem previo a la castración vs 21d poscastración tc = 11.5; tT (α 0.01; 2) = 6.96 p =0.0037
Vol. P. Sem 21d poscastración vs 51d pos-castración tc = 1.9; tT (α 0.05; 2) = 2.92 p =0.0997
Cuadro 3 Evaluación del comportamiento sexual y tiempo de cópula (TC) de alpacas macho poscastración (Grupo 1)
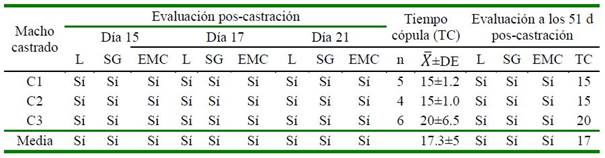
L = libido; SG= sonido gutural; EMC= erección, monta y movimiento circular del pene
Por tanto, el mecanismo fisiológico que explique la inducción de la ovulación por la cópula de macho castrado sería otro factor que relacione el comportamiento sexual del macho y su efecto en la hembra. En los rumiantes de ovulación espontánea, el factor responsable del celo es el estradiol (E2), el cual induce el pico preovulatorio de LH (Karsch et al., 1980). En alpacas, el responsable del celo es el mismo factor hormonal en su nivel alto en la fase estática de la onda folicular (Bravo et al., 1990; Vaughan, 2001), mientras que, la ovulación es inducida por el pico de LH estimulado por el factor neurotrópico β del plasma seminal del macho (Chen et al., 1985; Ríos et al., 1985; Adams et al., 2005; Ratto et al., 2010). Por tanto, en ausencia o muy limitada secreción del plasma seminal del macho castrado, el efecto del factor neurotrópico estaría ausente o sería muy limitado para inducir la ovulación. Ante esto, se podría deducir que en este mecanismo de acción también estaría involucrado el E2, sea por su efecto per se o por un incremento de su nivel relacionado con el incremento de la estimulación sexual de la hembra durante la penetración del pene en el útero. En la rata se reporta un incremento en E2 por estimulo cervical del útero (Hardy, 1969; Hardy y Debold, 1971; Erskine, 1989), así como en ovinos y cabras ante el contacto físico (Fabre-Nys y Gelez, 2007).
El mecanismo fisiológico del efecto del E2 puede estar mediado por su estímulo en la secreción del neurotransmisor GABA - ácido gamma-aminobutírico (Roa et al., 2011) que inhibe en el hipotálamo la actividad secretora del Núcleo A15, sobre todo de la dopamina inhibidor de la secreción de GnRH en el área preóptica, facilitando la actividad de las neuronas que secretan neurotransmisores, sobre todo de la neuroquinina â (Billings et al., 2010; Rance et al., 2010), que estimulan la producción de GnRH en el hipotálamo para provocar la descarga masi- va de LH para la ovulación. Por tanto, estas informaciones y los resultados del presente estudio sugieren la hipótesis de que un incremento de la estimulación sexual en la secreción de E2 fuese el mediador para la ovulación por efecto de la cópula de machos castrados, sin descartar el efecto del contacto físico o del sonido gutural del macho; informaciones que requieren ser investigados en alpacas. Por otro lado, la demostración del efecto de estos factores explicaría también el mecanismo fisiológico en la ocurrencia de las ovulaciones espontáneas.
La hipótesis del mecanismo fisiológico del efecto de la cópula del macho castrado en la inducción de la ovulación es debatible porque la ausencia de este efecto ocurrió en el mayor porcentaje de hembras (p<0.001). No obstante, es posible que esta diferencia se relacione con la susceptibilidad fisiológica entre las hembras a la respuesta del estímulo en la secreción de niveles apropiados de estrógenos para mediar el efecto en la inducción de la ovulación, tal y como puede haberse presentado, en el 20 a 40% de ovulaciones espontaneas que usualmente se reportan, y como efecto negativo de fallas en la ovulación, pues solo se logra entre 70 y 80% de ovulación inducida por la monta (Fernández-Baca et al., 1970b), de 75 a 90% con la administración de LH (Ratto et al., 2006) y de GnRH (Bravo et al., 1992). No obstante, ante la ausencia de estudios sobre repetibilidad individual de ovulaciones en alpacas en varias campañas reproductivas se dispone de reportes sobre diferencias en tasas de ovulación, fertilización y preñez múltiple por diferencias genéticas en los niveles de E2 en cerdas (Knox, 2005; Soede et al., 2011) y ovejas (Cahill et al., 1981).
El bajo porcentaje de ovulación en G3 (20%) por efecto solo del plasma seminal aplicado vía IA podría ser el resultado de la ausencia de la estimulación del contacto físi- co y del comportamiento sexual del macho; sin embargo, esta asunción es discutible considerando las tasas de ovulaciones de 93-38% reportados con la aplicación de plasma seminal con la misma técnica de IA o mediante vía IM (Adams et al., 2005; Ratto et al., 2005; Panez et al., 2009), sin descartar las fallas en el uso de la técnica de IA en el presente estudio.
En el Cuadro 3 se muestra asimismo, un análisis complementario sobre el comportamiento sexual de los machos castrados en el empadre controlado, en ausencia de la testosterona testicular. Además de manifestar las fases del comportamiento sexual de cortejo, monta, penetración y copulación (Hanzen et al., 2014), se observó el sonido gutural (típicos sonidos de apareamiento) (Fernández-Baca y Novoa, 1968; Novoa, 1970; England et al., 1971) y previo a la pe- netración y copulación fue posible observar la rotación semicircular del pene para ubicar la entrada de la vagina. Es remarcable la du- ración promedio de la cópula (17.3 ± 5.0 min), similar al grupo de machos vasectomizados (Cuadro 4), y superior al promedio de 15 min recomendado para empadre controlado (Condorena y Fernández-Baca, 1972).
La manifestación del comportamiento sexual del grupo macho castrado, en ausencia de la testosterona testicular, contradice los reportes sobre la fisiología del efecto de esta hormona en el libido sexual, la erección, penetración del pene y copulación (Novoa, 1970; England et al., 1971), a través de su metabolización enzimática a estradiol y 5α- dihidrotestosterona (DHT), como posibles responsables de estas características sexuales (Ryan et al., 1972); lo que supone la acción de otros factores o mecanismos fisiológicos independientes de la acción de la testosterona testicular en la expresión de las características sexuales durante el proceso de cópula. La testosterona disminuye a niveles no detectables en la rata (Resko, 1970; Hart, 1974), en tanto que ocurre dentro de la primera semana de la castración en ovinos y vacunos (Haynes et al., 1976; Schanbacher y D’Occhio, 1984); sin embargo, ellos siguen mostrando las fase del comportamiento sexual por días o semanas (Davidson, 1966; Clegg et al., 1969), desapareciendo la fase de eyaculación a los pocos días, posteriormente la penetración peniana y más tardíamente la monta y erección (Clegg et al., 1969). En este estudio, se comprobó en las alpacas castradas la ausencia de semen y mínima secreción de las glándulas accesorias en los días 21 y 51 después de la castración (Cuadro 2), No obstante, la libido, el sonido gutural de empadre y la monta y penetración (cópula efectiva) pudo observarse hasta aproximadamente dos meses de la castración (Cuadro 3).
Cuadro 4. Evaluación del comportamiento sexual y tiempo de cópula (TC) de alpacas macho pos-vascetomía (Grupo 2)
L = libido; SG= sonido gutural; AEP= ausencia de espermatozoides en plasma seminal
Fisiológicamente, es probable que haya ocurrido la acción de las hormonas E2 y DHT mediante la secreción de las enzimas aromatasa y 5α-reductasa por las células cerebrales (Ryan et al., 1972) y la presencia de receptores estrogénicos (E2R) y androgénicos (AR) en las células de los núcleos cerebrales del área preóptica del hipotálamo con el comportamiento sexual de los machos (Wood et al., 1992). La testosterona (T2), en ausencia de los testículos, es secretada por la glándula adrenal o proviene de la conversión de la P4 en la misma glándula (Kitay et al., 1970; Sanford et al., 1977), para su metabolización a nivel cerebral. Es probable que la producción de T2 haya sido estimulada en las glándulas adrenales por el deseo sexual, basado en estudios que muestran mayor nivel de producción de T2 en machos con agresividad sexual que en aquellos con baja actividad sexual (Simpson, 2001; Giammanco et al., 2005; van der Meij et al., 2008). En el empadre de alpacas es frecuente observar machos con mayor agresividad sexual (Novoa, 1970), en tanto que Urquieta et al. (1994) demostró mayor agresividad sexual en vicuñas con mayor nivel de T2.
El presente estudio muestra que los machos castrados evaluados 21 y 51 días pos- castración exhiben las fases del comporta- miento sexual: cortejo, monta, erección con movimiento semicircular del pene, penetración y copulación, con mínima secreción (0.4 y 0.3 ml respectivamente) de plasma seminal y ausencia del eyaculado de semen, induciendo la ovulación en 27% de las hembras. Por otro lado, el análisis de los efectos que expliquen los resultados obtenidos plantea vacíos de información que requieren ser investiga- dos, como la capacidad de cada fase del comportamiento sexual en ausencia del factor neurotrópico y el rol del E2 en la inducción de la ovulación y su relación con el factor genético en la susceptibilidad de la respuesta ovulatoria.












 uBio
uBio