INTRODUCCIÓN
Los métodos clínicos de análisis de la marcha han ido evolucionando en comparación con décadas pasadas (Torres y Budsberg, 2019), lo que ha permitido explorar con precisión y eficiencia el ciclo de la marcha canina. Puede ser útil para identificar patrones anormales de marcha generados por patologías osteomusculares y para verificar la efectividad de los tratamientos utilizados (Vilar et al., 2013, Gillette y Angle, 2008).
Los sarcomas de tejidos blandos surgen de los tejidos mesenquimales y tienen características similares al tipo celular de origen (Forrest et al., 2000). Estos sarcomas pueden ocurrir en cualquier parte del cuerpo, aunque más comúnmente involucra la piel y los tejidos subcutáneos. Comprende entre 8 y 15% de los tumores cutáneos y subcutáneos en el perro y son especialmente frecuentes entre los de raza mediana y grande (Dobson et al., 2002).
Estas neoplasias malignas tienen una pseudocápsula y la invasión tumoral ocurre a lo largo de los planos de invasión tumoral (White y Martínez, 2013). Debido a esto, los sarcomas pueden ser extirpados fácilmente mediante cirugía, pero tienen una alta tasa de recurrencia local, especialmente si no re realiza terapia adyuvante, y pueden hacer metástasis (Forrest et al., 2000). El diagnóstico se realiza por histopatología, citología, y se clasifican basados en inmunohistoquímica, así como en estudios de diagnóstico citogenético y molecular, siendo posible en la actualidad determinar el tipo celular de origen, reduciendo así el número de tumores clasificados dentro del grupo de no diferenciados (Huyghe et al., 2013). También es recomendado realizar ayudas diagnósticas como la resonancia magnética donde se puede hacer énfasis en la visualización de la grasa y el tejido blando (T1), de líquidos e inflamaciones (T2) y en otros casos suprimir la grasa u otro tejido especifico (STIR) (Rivera et al., 2011) lo que favorece la delimitación de la extensión de la lesión para realizar programaciones quirúrgicas más acertadas.
El tratamiento de elección es el quirúrgico realizando la edición en bloque con 2-3 cm de tejido sano y mínimo un plano de profundidad, y en el caso de los miembros está indicada la amputación (Liptak y Forrest, 2007; Etttinger y Feldman, 2007). También se puede realizar radioterapia posquirúrgica en casos no se haya podido extraer todo el tumor (Gagnon et al., 2020), así como terapia metronómica y quimioterapia (Lara, 2012).
La opinión actual en oncología humana es que se logran tasas de supervivencia y control local similares con un mejor resultado funcional y cosmético al realizar escisión quirúrgica marginal más terapia adyuvante en comparación con la cirugía radical sola ((Ray- Coquard et al., 2018; Gagnon et al., 2020; Saerens et al., 2021).
Se presenta el caso de una hembra canina de raza Husky Siberiano con un sarcoma de tejidos blandos ubicado en el miembro anterior izquierdo a la cual se le retiró el tumor incluyendo parte de la musculatura del miembro. Se inició terapia adicional y se evaluaron los cambios cinemáticos del miembro antes y después del procedimiento quirúrgico.
MATERIALES Y MÉTODOS
Anamnesis
A la Clínica Veterinaria Lasallista Hermano Octavio Martínez López f.s.c fue llevada una perra Husky siberiana de 11 años. El propietario indicó que un año atrás le fue extirpado un tumor en el brazo izquierdo, pero le había vuelto a salir, había crecido y le molestaba para caminar.
Examen Clínico
Paciente esterilizada con 22 kg de peso, constantes fisiológicas dentro de los rangos normales, presentaba masa lobulada a nivel de la zona lateral y anterior de la parte distal del brazo y codo del miembro anterior izquierdo y había dificultad para la flexión y extensión total del miembro. La estructura no generaba dolor, pero estaba adherida a las estructuras internas y la piel. Se observó la cicatriz del procedimiento anterior y claudicación 1/4. El diagnóstico presuntivo fue sarcoma indiferenciado de tejidos blandos.
Pruebas Paraclínicas
Se realizó placa de rayos X del miembro y de tórax, No se evidenció compromiso óseo en el miembro, pero se observó aumento de la radio-densidad de los tejidos blandos periarticulares del codo y de la región del brazo izquierdo. En las placas de tórax no se observaron cambios sugerentes con metástasis. Se tomaron muestras de sangre análisis rutinario de laboratorio.
Se recomendó la amputación del miembro, pero el propietario no aceptó y solicitó alternativas de tratamiento. Se le comentó sobre la cirugía oncológica y sobre la realización de quimioterapia adyuvante, terapia que fue aceptada. No obstante, antes de realizar el procedimiento quirúrgico se le realizó una resonancia magnética del miembro.
Como resultado de la resonancia magnética se encontró una masa heterogénea en la cara craneal del brazo, con extensión medial y lateral de 10.2 x 8.8 x 5.5 cm, superficial a los músculos braquial y bíceps, con desplazamiento caudal del tríceps, y sin aparente infiltración muscular. La masa tenía contornos lobulados, hiperintensa al músculo estriado en T2 y STIR, ligeramente hiperintensa al musculo en T1 y con realce homogéneo con el medio de contraste, así como un área de necrosis. No se observaron signos de sangrado ni calcificaciones. La lesión presentaba contornos bien definidos y no se observaba compromiso de la topografía del nervio radial, mediano, musculocutáneo y cubital.
Los vasos braquiales no mostraban alteraciones, los músculos con intensidad de señal normal, sin evidencia de lesiones. Los tendones del bíceps y tríceps de apariencia normal. El húmero y lo incluido del cúbito, radio y la articulación del codo no demostraban alteraciones. No había derrame articular en el codo ni se observaban adenopatías (Figura 1).
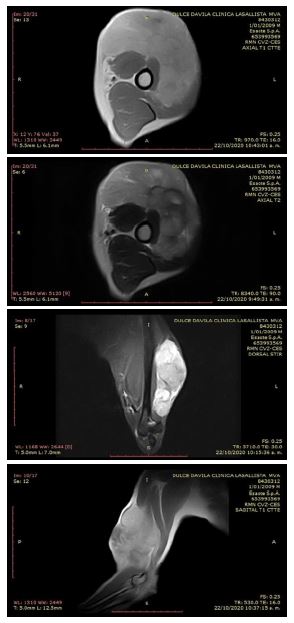
Figura 1. Resonancia magnética de una perra Husky siberiana de 11 años. A. Corte axial en T1. B. Corte axial T2, se observa la masas y su proyección. C. Corte dorsal en STIR luego de la administración del gadolinio de forma intravenosa donde se resalta la masas y su extensión. C. Corte sagital en T1
Por lo observado se programó el procedimiento quirúrgico y se advirtió a los propietarios que podría presentarse daños en los músculos al realizar retiro con márgenes de seguridad. También se realizó un análisis de la marcha antes del procedimiento para evaluar el compromiso de la funcionalidad del miembro.
Análisis de la Marcha
Se ubicaron 11 marcas en el lado izquierdo del animal en las siguientes zonas: cresta iliaca, trocánter mayor, epicóndilo lateral del fémur, maléolo lateral de la tibia, aspecto lateral del quinto metatarsiano, ángulo craneal de la escápula, articulación escapulohumeral, epicóndilo lateral del húmero, proceso estiloides de la ulna, aspecto lateral del quinto metacarpiano y base de la oreja.
Se realizó un video a 120 fotogramas por minuto y luego se realizó el análisis de la marcha por medio del programa de libre uso Skill Spector®, obteniéndose los ángulos articulares en los dos momentos de la marcha: estación y oscilación (Figura 2).
Cirugía
La paciente fue premedicada con ketamina, diazepam y fentanilo, y se hizo mantenimiento con isoflurano a 1.5 CAM. Se pre- paró la zona quirúrgica y se hicieron marcas de márgenes de seguridad (Figura 3). Se extirpó la masa tumoral y por los márgenes de seguridad se retiraron parte de los músculos bíceps braquial y tríceps. Para cubrir el defecto se realizó un colgajo rotatorio de la piel y musculo cutáneo (Figura 3).
Los tejidos extirpados fueron remitidos al laboratorio de histopatología donde se encontró una neoplasia maligna, no encapsulada, no delimitada, constituida por células mesenquimatosas, que se organizaban formando empalizadas, y áreas sólidas desordenadas, arremolinadas, a veces siguiendo un patrón estoriforme. Las células neoplásicas presentaban pleomorfismo moderado, cito- plasma amplio, eosinófilo intenso, sin límites apreciables, y a veces espumoso, con microvacuolas en su interior. El núcleo era vesicular, central, basófilo intenso, con anisocariosis moderada, algunos exhibían formas alargadas, poligonales, ovaladas, triangulares, con nucléolos múltiples y prominentes. Se observaron hasta 33 mitosis en 10 campos de alto poder (MC en 400X). Los bordes no se apreciaron comprometidos con la infiltración neoplásica. No se observó infiltración linfática ni vascular, dándose como diagnostico final sarcoma indiferenciado.
Luego de la cicatrización de la piel se inició la quimioterapia con protocolo OSA que incluye, carboplatino 30 mg/m2, vacuna inmunoestimulante (vacuna kimera; Instituto de Inmunoterapia de Argentina), lo cual se hizo en dos ciclos con diferencia de 20 días cada uno. Un mes después de la intervención quirúrgica, la paciente mostraba una leve claudicación del miembro (¼) y disminución apreciable de la masa muscular del brazo. Se realizó un nuevo análisis de la marcha para verificar las alteraciones que se produjeron con la cirugía (Cuadro 1).
DISCUSIÓN
En términos generales se considera que los sarcomas son neoplasias malignas que generan fácilmente metástasis regional y a distancia (Bray, 2016), aunque hay grandes variaciones para casos de metástasis; así Stefanello et al. (2011) y Demetriou et al. (2012) indican frecuencias entre 17 y 41%. No obstante, esto puede depender del tipo de sarcoma y de otras variables como el índice mitótico del mismo (Kuntz et al., 1997). En el presenta caso no se pudo llegar a definir con exactitud el tipo de tumor y se le caracterizó como sarcoma indiferenciado, que según Bray (2016) pueden ser sarcomas malignos o que por el proceso de diagnóstico sin la utilización de marcadores no se le puede definir.

Figura 2 Captura de la imagen y análisis de la marcha. En la imagen de la izquierda se observa un fotograma del video realizado con los puntos de interés en cada articulación evaluada. En la imagen de la derecha se evidencia la representación digitalizada de la imagen de la izquierda con la cual se realizó el análisis de la marcha
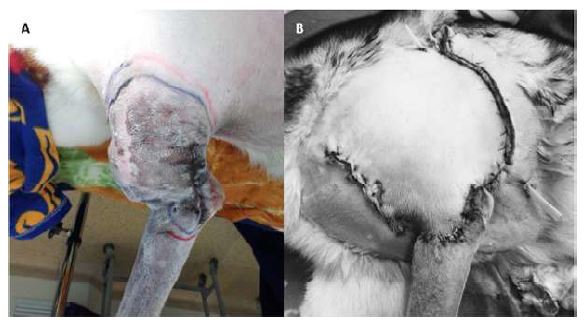
Figura 3 Paciente canina Husky siberiana de 11 años con masa tumoral en brazo izquierdo. (A) La masa ubicada en el brazo delimitada con márgenes de seguridad. (B) Cierre de la herida después de extirpar la masa tumoral
El índice mitótico en este caso fue de hasta 33 figuras mitóticas en 10 campos de alto poder, lo que se ha asociado con tasas mayores (y más tempranas) de recurrencia tumoral, tasas más altas de metástasis y supervivencia general reducida (Avallone et al., 2021; Dennis et al., 2011)
La utilización de ayudas diagnósticas de imágenes avanzadas como la resonancia o la tomografía axial computarizada son funda- mentales para el proceso de definir el tratamiento a seguir con este tipo de pacientes, pues permiten determinar la extensión de la lesión y el compromiso de las estructuras aledañas (Brühl-Day et al., 2020). En medicina veterinaria, la cirugía por sí sola sigue siendo la estrategia más eficaz en el manejo de los sarcomas de tejidos blandos, aunque hay serias controversia sobre esto (Stefanello et al., 2008, Prpich et al., 2013, Bray et al., 2014). En el presente caso el procedimiento se planificó siguiendo los lineamientos para este tipo de tumores como son una escisión local am plia del tumor en bloque con márgenes mínimos de 3 cm de tejido normal lateralmente y un plano fascial limpio profundo (Ehrhart, 2005; Liptak y Forrest, 2013), lo que involucró el retiro de parte de los músculos y el empleo de quimioterapia.
Cuadro 1 Análisis de la marcha, valores del ángulo máximo y mínimo en grados encontrados en la articulación del hombro, codo y carpo izquierdo, antes y después de la cirugía, en comparación con el miembro contralateral derecho, en Paciente canina Husky siberiana de 11 años con masa tumoral en brazo izquierdo
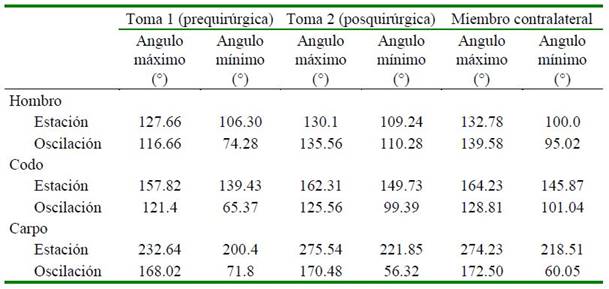
El análisis de la marcha mostró cambios en el ángulo mínimo y máximo de las articulaciones del hombro, codo y carpo, lo que sugiere una mejoría como consecuencia del procedimiento quirúrgico, posiblemente debido al retiro del tejido que no permitía la flexión y extensión normal del miembro por ocupar un espacio que impedía que la articulación del codo pudiera lograr el rango de movimiento óptimo. Las otras articulaciones también podían haber estado afectadas como medida compensatoria para mantener un tamaño del paso normal en comparación con el miembro derecho, lo cual se pudo evidenciar al comparar los valores antes y después de la cirugía, con lo encontrado en la valoración cinemática de la marcha del miembro anterior derecho.
El musculo bíceps tiene como función flexionar el codo y ayuda a extender el hombro, mientras que el tríceps braquial extiende el codo y flexiona el hombro (López et al., 2018), de modo que la afectación de cual- quiera de ellos supondría la generación de alteraciones en la marcha del animal. En este caso se podría decir que el aumento en el rango de flexión y extensión articular luego del procedimiento puede deberse a que si bien se retiró parte del bíceps y todo el tríceps, es posible que algún otro músculo intrínseco del miembro hubiera asumido en parte la funcionalidad del este músculo, pues hubo mejoría de la extensión del codo.
Cabe resaltar que, en comparación con los valores del análisis de la marcha del miembro derecho y del miembro izquierdo antes del procedimiento, se pudo observar un in- cremento de los valores cinemáticos después de la cirugía, y aunque hay muchos factores que pueden influenciar en los valores obtenidos, como son la colocación de los marcadores por la movilidad de la piel (Taylor et al.,2005), así como la masa y el tono muscular, que suelen reducirse por el desuso propio del miembro afectado (Reusing et al., 2020). Este método puede ser utilizado de manera individual para poder verificar el resultado de los procedimientos quirúrgicos de los miembros en un animal, adicional al bajo costo de la realización de la prueba en comparación con otras que existen actualmente (Saner et al., 2017).












 uBio
uBio 

