INTRODUCCIÓN
Los estudios de morfometría de paramfistomidos, tanto de adultos como de los huevos, son recursos importantes para poder identificar parásitos de la familia Paramphistomidae (Panyarachun et al., 2010), familia constituida por numerosas especies que parasitan a los rumiantes, afectando su estado de salud y nivel de producción (Alarcón y Velásquez, 2009; Sanabria et al., 2011; Anuracpreeda et al., 2013).
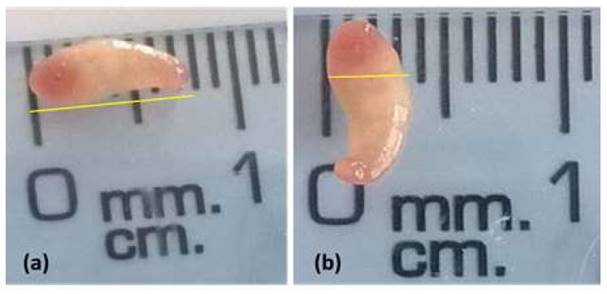
Los paramfistomidos adultos se caracterizan por ser cilíndricos cónicos, de forma piriforme, 2 a 5 mm de ancho y 1 cm de largo, variando según la especie, y presentan un color rojo claro a rosado (Dube et al., 2005; Zintl et al., 2014) con cuerpo carnoso (Rojo- Vázquez et al., 2012). Además, presentan acetábulo en posición terminal (ventosa ventral) y la cutícula no tiene espinas, por lo que frecuentemente tienen papilas tegumentales (Quiroz, 2016). El poro genital se abre en la cara ventral sobre la línea media del tercio anterior (Torrel y Paz, 2015).
Los huevos son grandes y operculados, similares a los de Fasciola hepatica; sin embargo, son de color gris (Rojo-Vázquez et al., 2012), aunque según Torrel y Paz (2015) son de color claro y de mayor tamaño (142.6 µm de largo y 67 µm de ancho), de forma ovala- da, el polo operculado más fino que el polo opuesto y el cigoto está localizado en la parte medial posterior a diferencia del huevo de F. hepatica que presenta el cigoto en posición medial anterior (Dube et al., 2005; Tantaleán et al., 2012; Torrel y Paz, 2015).
El presente estudio se fundamenta debido a que en la región Amazonas, Perú, se presenta paramfistomosis, la cual provoca pérdidas económicas considerables en la crianza y producción de bovinos. Para combatir esta parasitosis es necesario contar con información actualizada y precisa de la especie de parásito que se encuentra en estas lo- calidades con el fin de tomar las medidas de control y prevención adecuadas. Así, el objetivo del presente estudio fue determinar las características morfométricas de los huevos y de los parásitos adultos de paramfistomidos recolectados en el Centro de Beneficio Municipal de Chachapoyas, Amazonas.
MATERIALES Y MÉTODOS
El estudio corresponde a una investigación descriptiva transversal prospectiva, teniendo como unidad de análisis el parásito adulto de paramfistomido recolectado en el Centro de Beneficio Municipal de Chachapoyas, Amazonas, Perú, en setiembre de 2017. Estos especímenes fueron seleccionados teniendo en cuenta la uniformidad y mayor tamaño (n=40), mediante observación directa.
Para la recolección de los parásitos adultos, posterior al beneficio de los anima- les, se eliminó el contenido ruminal y reticular con agua corriente para una mejor visibilidad, se localizaron los parásitos y se desprendieron con la mano cubierta con guantes de látex. Los parásitos se colocaron en tubos cónicos Falcon de 50 ml con suero fisiológico salino al 0.9% (30 ml) a temperatura ambiente, los que fueron colocados en una caja de poliestireno expandido (Tecnopor) con bolsas de agua caliente a 37 °C. Las muestras fueron llevadas al Laboratorio de Inmunología e Investigación de la Facultad de Ciencias Veterinarias de la Universidad Nacional de Cajamarca en un lapso de ocho horas.
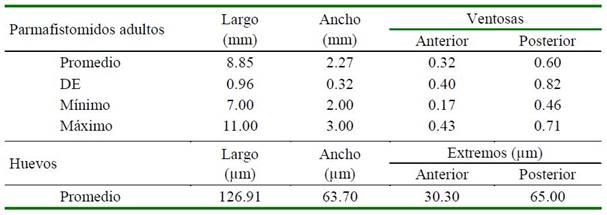
Los parásitos adultos en los tubos Falcon con solución fisiológica salina se mantuvieron en estufa a 38 °C durante 4 h para lograr la ovoposición, según el protocolo de Dinnik modificado (Dinnik y Dinnik, 1954) y Dinnik (Dinnik, 1962), escogiendo 30 huevos en forma aleatoria para las mediciones. La medición de los parásitos adultos (largo, ancho y ventosas a los extremos) se llevó a cabo utilizando una regla milimetrada y un estereoscopio de 1.6X. Las dimensiones de los huevos (largo, ancho, extremos anterior y posterior) se hizo utilizando un microscopio con objetivo ocular micrométrico de 40X y magnificación ocular de 10X, donde los valores de cada medida fueron multiplicados por el factor de ajuste para este aumento (1.64).
RESULTADOS Y DISCUSIÓN
Morfometría de los Parásitos Adultos
Los digeneos adultos se presentaron de un color rojizo, más intenso en los extremos anterior y posterior, con cuerpo cónico y curvado ventralmente (Figura 1), con un acetábulo muy desarrollado en la región posterior, a diferencia de la ventosa oral que se muestra estrecha, cranealmente (Figura 2). Estas características son similares a los de Calicophoron microbothrioides reportadas por Torrel y Paz (2015).

Figura 2 Paramfistomido adulto mostrando ventosa anterior u oral (va), glándulas vitelógenas (gv) y acetábulo (a)
El ancho y largo promedio fue de 2.27 y 8.85 mm respectivamente (Cuadro 1), valores muy cercanos a los encontrados por López y Velásquez (2012) en Colombia, donde Cotylophoron panamensis presentó 7.65 mm (6.63-8.84) de longitud y 2.91 mm (2.3- 3.25) de ancho.
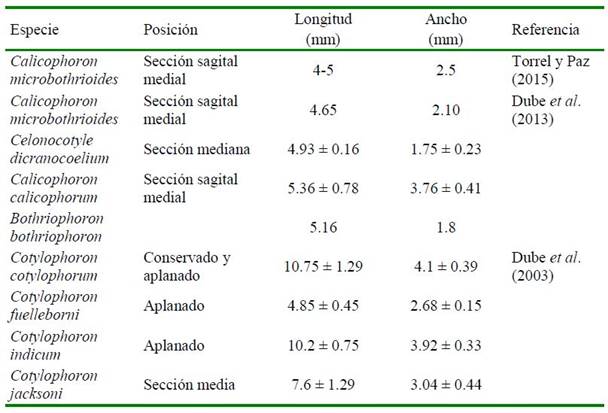
Asimismo, los valores del presente estudio difieren y concuerdan con otros estudios en trematodos de la familia Paramphistomidae (Cuadro 2), pero que enmarcan a los valores encontrados. Dada la diversidad de medidas encontradas, López y Velásquez (2012) mencionan que el tamaño obedece a variables como técnicas de relajación, fijación, coloración y montaje, además de la variabilidad intraespecífica, por lo que no se considera un carácter importante en la determinación específica.
En cuanto a la medida del acetábulo (ventosa posterior), el valor más cercano al presente estudio es el de Cotylophoron marajoensis n. sp., reportado por Amaral et al. (2020), el cual midió 0.74-1.77 mm longitud por 0.43-1.67 mm de ancho. Por otro lado, un valor más dispar fue reportado por Dube et al. (2013) en Calicophoron dicrano- coelium con 0.99 ± 0.05 mm. No obstante, la mayoría de los estudios de parásitos de la familia Paramphistomidae reportan dimensiones del acetábulo superiores a los valores encontrados en el presente estudio (Dube et al., 2005; Alarcón y Velásquez, 2009; Dube, 2010; López y Velásquez, 2012).
Morfometría de los Huevos
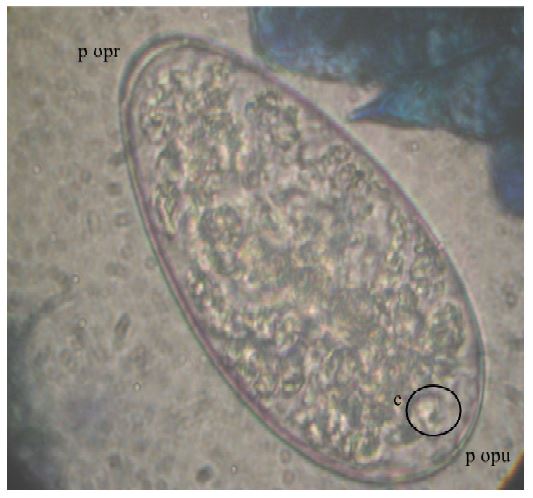
Los huevos tienen forma ovalada con el extremo anterior más agudo. El cigoto se presenta en el extremo medio posterior, con escasas células embrionarias, tal como mencionan Torrel y Paz (2015) en huevos de Calicophoron microbothrioides que son de forma ovalada, con un polo operculado más delgado que el polo opuesto (Figura 3). Los huevos miden entre 114 a 176 µm de longitud por 63 - 71 µm de ancho y son de color gris claro, pero con lugol parasitológico fuerte se tornan a amarillo claro y con azul de metileno al 0.1% se observan de azul claro.
Las medidas de los huevos se encuentran en el Cuadro 1 y Figura 4, con valores cercanos a los reportados por Dube et al. (2005) en Paramphistomum microbothrium con 133 x 63 µm y en Pamphistomum clavula con 140 x 67 µm. Las dimensiones de otros huevos de paramfistomidos reportados en la literatura se presentan en el Cuadro 3.
Cuadro 3. Dimensiones comparativas de huevos de trematodos paramfistomidos reportados en la literatura
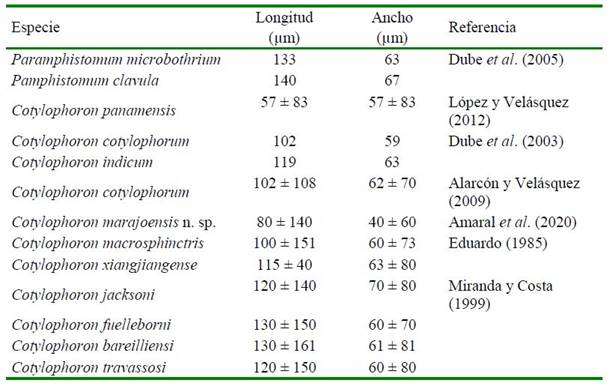
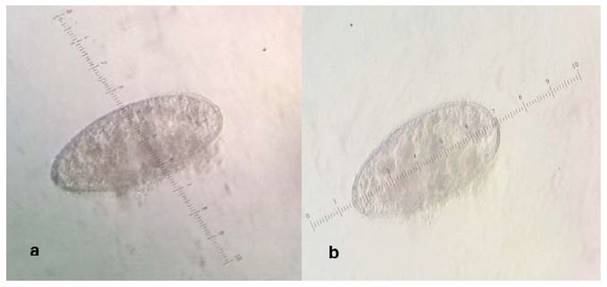
Figura 4. Morfología de huevos de Paramfistomidos adultos. (a) Ancho: 63.7 µm; (b) Largo: 126.91 µm. 400X
Los resultados de la presente investigación deberán considerarse preliminares si se busca conocer la especie de paramfistomido, ya que para este tipo de resultados es necesario estudios moleculares: sin embargo, por los valores y características halladas indica- rían que se trata de Calicophoron microbothrioides.
CONCLUSIONES
Las características de los huevos y del parásito adulto en estado fresco; color rojizo más intenso en los extremos anterior y posterior, cuerpo cónico y curvado ventralmente y los resultados del estudio morfométrico de- terminan que los paramfistomidos recolectados del Centro de Beneficio Municipal de Chachapoyas, Amazonas, Perú, pertenecen a la familia Paramphistomidae, características compatibles con Calicophoron micro- bothrioides.












 uBio
uBio