INTRODUCCIÓN
El distemper canino (DC) es una enfermedad multisistémica que afecta a carnívoros domésticos y silvestres, y presenta una mortalidad aproximada del 50% (Greene, 2006). La infección es causada por un virus ARN monocatenario de la familia Paramyxoviridae (Deem et al., 2000). Las manifestaciones clínicas son similares en todas las especies afectadas (Oleaga et al., 2021) e incluyen cuadros de neumonía, diarrea, fiebre, anorexia, conjuntivitis, hiperqueratosis de las almohadillas digitales y signos neurológicos severos como mioclonía, ataxia, paraplejia, movimientos circulares y coma (Vandevelde y Cachin, 1993; Carvalho et al., 2012).
Diversos reportes en carnívoros silvestres se han asociado a interacciones con perros domésticos en zonas urbanas y periurbanas (Cottrell et al., 2013, Needle et al., 2020). La transmisión del virus en fauna silvestre está asociada al contacto con perros enfermos a través de la inhalación de partículas aéreas o fómites (Newbury, 2021).
Hallazgos histopatológicos muestran desmielinización perivascular, incremento de células inflamatorias, edema nervioso central (Lempp et al., 2014; Feijóo, 2020), gliosis multifocal y pérdida de células de Purkinje (Oleaga et al., 2021), así como cuerpos de inclusión eosinofílicos en tejido nervioso, especialmente en astrocitos, células epiteliales de la vejiga urinaria, pulmón, estómago y tonsilas (Headley y Graça, 2000).
El zorro de Sechura (Lycalopex sechurae) es uno de los seis cánidos silvestres nativos de Perú, especie que se encuentra clasificada como Casi Amenazada por la IUCN (Unión Internacional para la Conservación de la Naturaleza - siglas en inglés) y se encuentra distribuida desde el sur de Ecuador a la costa central de Perú (Olson y Dinerstein, 1998). Al igual que otros cánidos silvestres, el zorro de Sechura puede ser susceptible al Virus de Distemper Canino (VDC); sin embargo, no existen reportes previos del desarrollo de esta enfermedad en la especie. El presente trabajo tuvo como objetivo reportar el desarrollo clínico, hallazgos post mortem y lesiones histopatológicas asociadas al VDC en un zorro de Sechura encontrado en la ciudad de Trujillo, Perú.
DESCRIPCIÓN DEL CASO
Un ejemplar hembra juvenil de zorro de Sechura fue reportado por la Autoridad Regional de Fauna Silvestre y Recursos Forestales de la Región La Libertad el 30 de enero de 2021. Debido a la falta de un centro de rescate de fauna silvestre regional fue trasladado al Centro Veterinario de Animales Exóticos y Silvestres «Siamo» para su evaluación clínica.
El animal se mostró dócil y acostumbrado al manejo humano durante la evaluación clínica inicial. Presentaba buena condición corporal y tenía un peso de 1.76 kg. Evidenció una lesión única hiperqueratinizada en el plano dorsal de la nariz. En los siguientes dos días el animal mostró letargia, anorexia, mioclonías, ataxia y realizaba movimientos circulares. Ante la sospecha de una enfermedad viral, se tomó una muestra de mucosa conjuntival y se realizó una prueba rápida de inmunocromatografía para detectar los antígenos virales de distemper canino (CDV Ag-Antigen Rapid Test kit®, Bionote, Corea). La muestra salió positiva al DC y ante el deterioro de las condiciones del paciente las autoridades decidieron por la eutanasia.
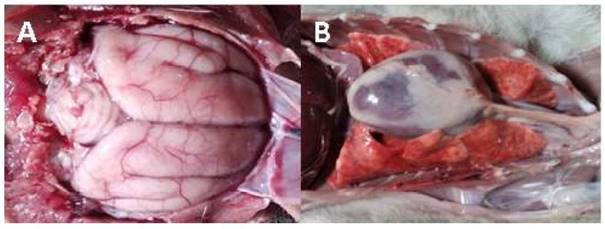
Figura 1 Lesiones macroscópicas en un ejemplar hembra juvenil de zorro de Sechura (Lycalopex sechurae). (A) Congestión y edema cerebral y cerebelar. (B) neumonía y cardiomegalia
Hallazgo a la Necropsia
Los hallazgos macroscópicos más relevantes fueron congestión y edema cerebral y cerebelar (Figura 1A), pulmones insuflados con áreas rojizas deprimidas, lesiones compatibles con neumonía, corazón aumentado de tamaño ocupando gran parte de la caja torácica, compatible con cardiomegalia (Figure 1B). Muestras de tejidos fueron preservados en formalina al 10% y remitidos al Departamento de Histología, Embriología y Patología de la Universidad Nacional Mayor de San Marcos, Lima, para su estudio histopatológico
Hallazgos Histopatológicos
La examinación histopatológica de cortes de tejidos teñidos con hematoxilina-eosina reveló tumefacción del urotelio con vacuolas de bordes irregulares, degeneración balonante y presencia de cuerpos de inclusión acidófilos en el citoplasma en células epiteliales de la vejiga (Figura 2A), severa dilatación vascular con material acidófilo en la luz de bronquiolos y escasas células inflamatorias (Figura 2B). Bronquios con descamación de células acompañados del células inflamatorias y material acidófilo, pérdida de cilios las células de la mucosa y cuerpos de inclusión en citoplasma (Figura 2D) pérdida de continuidad de las neuronas de Purkinje y edema perineuronal en cerebelo (Figura 2C). gliosis y edema perivascular y neuronal en cerebro.
DISCUSIÓN
La evaluación clínica apoyada con los hallazgos histopatológicos coincide con un caso de distemper canino. Los anticuerpos selectivos contra el virus de distemper cani- no (VDC) son usados como detectores de antígenos del virus y se usan frecuentemente en pruebas rápidas de diagnóstico con una alta precisión en perros domésticos; sin embargo, no son pruebas específicas para otras especies, como en carnívoros silvestres (Buñay, 2019).
Un estudio retrospectivo en 250 perros domésticos diagnosticados de distemper reporta cuerpos de inclusión en muestras de encéfalo (82%), seguido de vejiga urinaria (15%), pulmones (6%) y otros tejidos (Head- ley y Graça, 2000). En el presente caso no se logró detectar cuerpos de inclusión en cerebro o cerebelo, pero estuvieron presentes en vejiga urinaria y pulmones. La incidencia de cuerpos de inclusión puede variar y no siempre es frecuente en muestras de encéfalo de especies silvestres afectadas por el VDC (Van Moll et al., 1995; Oleaga et al., 2021).
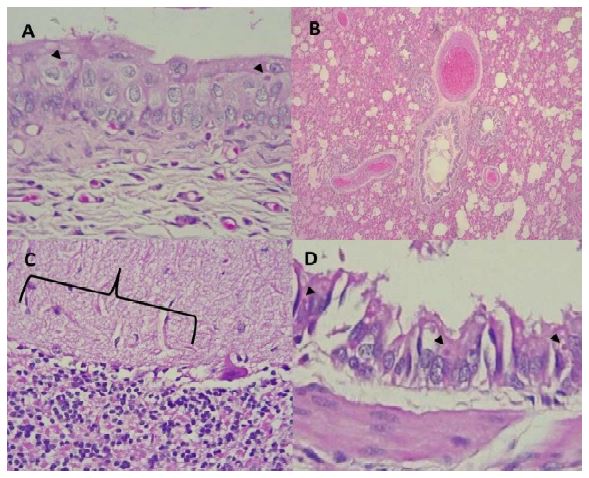
Figura 2 Lesiones microscópicas en tejidos de un ejemplar hembra juvenil de zorro de Sechura (Lycalopex sechurae). (A) Degeneración hidrópica y cuerpos de inclusión eosinofílicos (flechas) en citoplasma de células epiteliales de la vejiga urinaria (40x). B) Dilatación vascular severa, edema inflamatorio en alveolos y exudado seroso en bronquiolos (10x). C) Pérdida de continuidad de células de Purkinje y edema perineuronal en cerebelo (llave) (40x). D) Descamación epitelial, pérdida de cilios y cuerpos de inclusión eosinófilos en el citoplasma del epitelio bronquial (flechas)(40x)
En el presente caso se describe la aparición progresiva de signos neurológicos como eventos de epilepsia focal, los cuales están asociados a gliosis, pérdida de continuidad en células de Purkinje y edema en encéfalo. Algunas de estas lesiones han sido reportadas en casos de distemper (Lempp et al., 2014; Oleaga et al., 2021).
El VDC es un patógeno global con diversos reportes en carnívoros silvestres. Sin embargo, su presencia en la fauna peruana está poco documentada. En un estudio en la Reserva Nacional de Tambopata, Madre de Dios, no se hallaron anticuerpos contra el VDC en pumas (Puma concolor) ni en jaguares (Panthera onca) (Atauje et al., 2019). Sin embargo, Quevedo (2018) reportó la presencia de anticuerpos contra VDC en seis de quince zorros de Sechura en Piura, aunque ninguno presentaba signos clínicos agudos.
La persecución humana, debido a conflictos en terrenos de cultivo y tráfico ilegal de fauna, se encuentran dentro de las amenazas principales para el zorro de Sechura (Cossíos, 2004). Estos factores, sumado a una posible baja tasa de vacunación de perros en Perú (Rubio et al., 2018) predispone a la propagación del VDC y otros patógenos. El paso del VDC de carnívoros domésticos a silvestres y viceversa puede modificar su virulencia, y favorecer la aparición de nuevas cepas (Van Moll et al., 1995), en tanto que el curso de la enfermedad va a depender de estos factores, sumado a la especie, la edad del huésped y su estado inmunitario (Zhao et al., 2015; Loots et al., 2017).
En este caso, debido al comportamiento dócil, se puede asumir que el animal estaba acostumbrado al manejo humano y procedía del tráfico ilegal de fauna silvestre, lo cual le predispuso al contacto con perros domésticos enfermos.












 uBio
uBio 

