INTRODUCCIÓN
La tilapia es una especie adaptada a las condiciones climáticas de Brasil y su producción tiene excelentes niveles de rendimiento (Barroso et al., 2018). Uno de los factores más importantes para la tilapicultura es la temperatura del agua, que entre épocas del año puede sufrir cambios significativos, lo que puede llevar a una condición de estrés térmico en los peces y, en consecuencia, provocar cambios fisiológicos y metabólicos perjudiciales para la salud de los animales (Zeni et al., 2016). El estrés térmico también altera considerablemente la cinética de los antibióticos, como el florfenicol, uno de los dos fármacos autorizados para el tratamiento de las bacteriosis en la piscicultura en Brasil (Padua et al., 2012; Yang et al., 2018; Rairat et al., 2019).
La influencia de la variación de la temperatura en la cinética de los antibióticos empleados en tilapicultura plantea la necesidad de optimizar las dosis, ya que las concentraciones plasmáticas bajas determinarán falta de eficacia y concentraciones plasmáticas elevadas podrían provocar efectos adversos y generar residuos en los productos de origen (Feng et al., 2019).
Los modelos farmacocinéticos son herramientas útiles que permiten predecir la concentración plasmática de los fármacos en respuesta a covariables como, por ejemplo, a las variaciones de temperatura en el agua de cría. Estos realizan estimaciones robustas para diversos regímenes terapéuticos, asegurando la eficacia y minimizando los efectos adversos de los medicamentos. Se han desarrollado modelos farmacocinéticos de florfenicol canino (Tameirão et al., 2021), para el pez tambaqui, Colossoma macropomum (Ferrante et al., 2020), para alpacas (Ferrante y Wosiacki, 2019) y para cerdos (Dorey et al., 2017). Ante esto, el objetivo de este trabajo fue desarrollar un modelo farmacocinético de florfenicol en plasma de tilapia (Oreochromis niloticus) sometida a diferentes temperaturas de cría para estimar la concentración plasmática de los protocolos indicados en los prospectos de los productos de florfenicol autorizados en Brasil.
MATERIALES Y MÉTODOS
El modelo farmacocinético en tilapia se creó tomando como base los datos de concentración plasmática del estudio de Rairat et al. (2020), en el cual se evaluó la farmacocinética del florfenicol en tilapias del Nilo (Oreochromis niloticus) clínicamente sanas tras la administración única de florfenicol por sonda en dosis de 10, 15, 30 y 45 mg/kg y a temperaturas de 24, 28 y 32 °C.
Los datos de la concentración plasmática de florfenicol a lo largo del tiempo se extrajeron utilizando el programa GetData Graph Digitizer®, y luego se tabularon los datos en Microsoft Excel®.
La construcción del modelo farmacocinético se realizó con el programa Monolix 2020R1 de Lixoft®, partiendo de los datos de farmacocinetica plasmáticas de florfenicol extraídos del estudio de Rairat et al. (2019). Para ello, se siguieron las recomendaciones de la Agencia Europea del Medicamento - EMEA (EMEA, 2007) y el estudio de Bauer et al. (2007). Se evaluaron varios parámetros a fin de determinar un modelo que consiga estimar los valores de concentración plasmática de forma adecuada.
Los parámetros evaluados para la construcción del modelo fueron tiempo de latencia de liberación, absorción de primer orden o de orden cero, distribución en uno, dos o tres compartimentos y cinética de eliminación lineal o de Michaelis-Menten. Además, se incluyó la influencia de la temperatura sobre los valores de los parámetros del modelo, siendo incluida como covariable cuantitativa continua. El Tiempo de latencia (Tlag) corresponde al tiempo que tarda el fármaco en liberarse desde la formulación para quedar disponible y ser absorbido. La constante de absorción (Ka) representa la velocidad del proceso de absorción del fármaco que implica el paso del fármaco desde el sitio de liberación hasta la circulación sistémica (Lin y Harvey Wong, 2017). Para modelar la distribución del fármaco, el organismo es representado en diferentes números de compartimientos que pueden estar correlacionados con tejidos corporales. La eliminación del fármaco es dependiente de la concentración del fármaco en el plasma (linear) o puede tener mecanismos saturables y, por tanto, tener velocidades máximas de eliminación (Michaelis-Menten).
La selección del modelo estructural se basó en los siguientes criterios: valor mínimo de disminución de la función objetivo (-2 x log-verosimilitud), el criterio de información de Akaike (AIC), el criterio de información bayesiano (BIC), la precisión de la estimación de los parámetros expresada como error estándar relativo (R.S. E %), los análisis gráficos observados en función de la concentración estimada por el modelo y el gráfico de comprobación visual predictiva (VPC) construido con los percentiles 5 y 95 de la población simulada (Knøsgaard et al., 2016; Robertson et al., 2019). Tras establecer el modelo adecuado, se calcularon los parámetros farmacocinéticos y se evaluó su correlación con la temperatura del agua de cría.
Mediante este modelo construido, se realizó la simulación in silico de las concentraciones plasmáticas a través del tiempo luego del empleo de diferentes protocolos terapéuticos, utilizando el programa Simulx 2020 de Lixoft®. La simulación fue realizada en 4 grupos con 4 temperaturas (18, 21, 26 y 30 °C) y cada grupo fue subdivido en 3 subgrupos de 12 animales según los protocolos de administración. Los protocolos usados fueron dosis de 10 mg/kg (MSD Animal Health, 2022) y 15 y 20 mg/kg (Farmabase, 2022) cada 24 horas durante 10 días, siguiendo las indicaciones en los prospectos de los productos de florfenicol autorizados para su uso en tilapias en Brasil. El estudio de simulación fue realizado en 10 000 repeticiones.
RESULTADOS
El modelo farmacocinético establecido fue vía oral/extravascular, absorción de primer orden, tiempo de retardo, distribución en dos compartimentos y cinética de eliminación lineal. Los parámetros del modelo fueron: tiempo de latencia (Tlag) = 7.61; constante de absorción (Ka) = 0.83; aclaramiento (Cl) = 0.0039; volumen de distribución en el compartimento central (V1) = 0.31; volumen de distribución en el compartimento periférico (V2) = 0.13 y la constante de tránsito entre los compartimentos (Q) = 0.057.
El modelo presentó una adecuada correlación entre los valores observados y los predichos, como se muestra en la Figura 1a, donde se observa que los valores presentan una dispersión homogénea respecto a la línea de valores predichos, dentro del intervalo de con- fianza del 90% de los valores predichos. En la Figura 1b se puede observar que las curvas de los valores de concentración plasmática observados y predichos presentan un alto grado de correspondencia. Además, los valores observados están dentro del rango de variación del intervalo de confianza del 95%.
El modelo farmacocinético construido a partir de los estudios in vivo realizados por Rairat et al. (2019) presentó una correlación entre algunos parámetros y la temperatura. Se observó que los parámetros Tlag, Ka y Cl están influenciados por las temperaturas de crianza, mientras que los parámetros V1, V2 y Q no fueron influenciados (Figura 2).
La simulación realizada en las dosis de 10, 15 y 20 mg/kg frente a las temperaturas de 18, 21, 26 y 30 ºC demostró la variación de las medianas de la concentración plasmática a lo largo del tiempo (Figura 3). Los animales mantenidos a 18 ºC presentan una mediana móvil de la concentración plasmática de aproximadamente la mitad de la de los animales criados a 18 ºC y tratados a las tres dosis en estudio. Por otra parte, a medida que aumentan las dosis, como de 10 a 15 mg/kg, se determina el aumento de aproximadamente el doble de las medianas de concentración plasmática.
DISCUSIÓN
El modelo farmacocinético construido permitió comprobar la influencia de la temperatura en los parámetros farmacocinéticos y simular los protocolos terapéuticos de florfenicol a distintas temperaturas del agua utilizada para la crianza de la tilapia del Nilo, además de estimar las concentraciones plasmáticas de florfenicol.
Los animales mantenidos a mayor temperatura mostraron menor Tlag que los mantenidos a menor temperatura (r=0.882). El Tlag corresponde al tiempo que tarda el fármaco en liberarse del alimento a la fase acuosa del contenido intestinal. La liberación del fármaco de la forma farmacéutica se controla en función de la temperatura del sistema (Aydin, 2020), de allí que la disminución de Tlag corresponde a una mayor velocidad de liberación a temperaturas más altas.
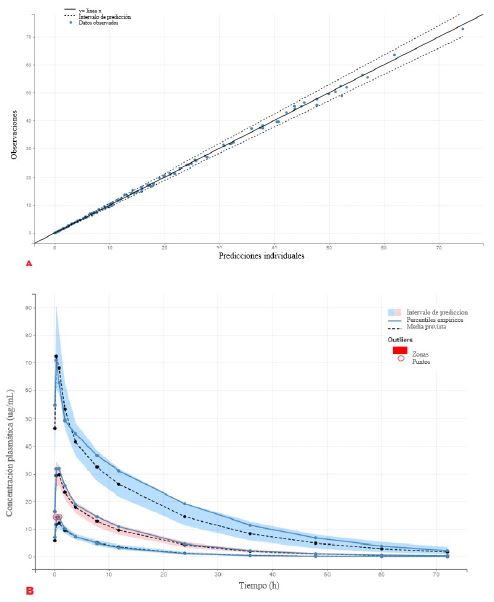
Figura 1 (a).Valores de concentración plasmática de florfenicol en la tilapia del Nilo (Oreochromis niloticus) observados (puntos azules) y estimados (línea negra sólida). La línea de puntos indica el intervalo de confianza del 90% de los valores previstos. (b). Las zonas sombreadas (color azul, rosa y azul) representan el intervalo de predicción en los percentiles 95, 50 y 5 (intervalo de confianza del 95%). Las líneas de puntos negros representan la mediana de los percentiles estimados 95, 50 y 5. La mediana, el percentil 5 y 95 de los datos observados se representan por las líneas continuas azules y los puntos azules
La constante de absorción (Ka) mostró una correlación positiva con el aumento de la temperatura (r=0.867) (Figura 2). Esta constante representa la velocidad del proceso de absorción que implica el paso del fármaco desde la luz intestinal a la circulación sistémica (Lin y Harvey Wong, 2017). Este proceso depende de la circulación sanguínea en el tracto gastrointestinal y de la tasa metabólica general del animal en el proceso de absorción del fármaco (Toutain et al., 2004a). Los animales poiquilotérmicos, como la tilapia, alteran de forma directamente proporcional la tasa metabólica general y el gasto cardíaco en función de la temperatura a la que están sometidos, como forma de adaptación al medio (Zeni et al., 2016). Esto podría explicar el hecho de que a bajas temperaturas de crianza se observaron constantes de absorción más bajas.
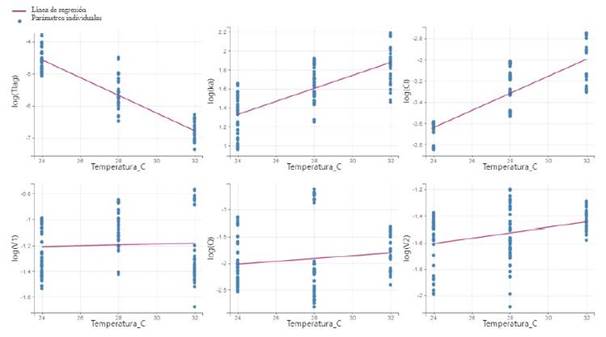
Figura 2 Correlación del tiempo de latencia de absorción (Tlag), la constante de absorción (Ka), el aclaramiento (Cl), la velocidad de tránsito entre compartimentos (Q), el volumen del compartimento central (V1) y el volumen del compartimento periférico (V2) del florfenicol en la tilapia del Nilo (Oreochromis niloticus) con las temperaturas de 24, 28 y 32 ºC (n= 12)
Figura 3 Mediana y percentiles de las concentraciones plasmáticas de florfenicol (ìg/ml) en tilapias del Nilo (Oreochromis niloticus) estimadas por la simulación de monte Carlo (n=10 000)
El aclaramiento (Cl) mostró una correlación positiva en relación con la temperatura, observándose una disminución en condiciones de baja temperatura (r=0.807) (Figura 2). El aclaramiento es el parámetro que representa la eliminación del fármaco del organismo, incluyendo el componente hepático y renal (Toutain et al., 2004b). Los estudios en peces han demostrado que el metabolismo hepático y la eliminación renal disminuyen a bajas temperaturas (Zeni et al., 2016). Así, la menor tasa de metabolización hepática y de eliminación renal, observada a temperaturas más bajas, podría medirse por el aclaramiento.
En la Figura 3 se puede observar que el modelo permitió cuantificar la influencia de la temperatura en las concentraciones plasmáticas de florfenicol y estimar las concentraciones correspondientes a temperaturas distintas a las observadas por Rairat et al. (2019). El éxito terapéutico del florfenicol viene determinado por unas concentraciones plasmáticas adecuadas a lo largo del tiempo (Toutain et al., 2021). Por otro lado, las concentraciones excesivas de florfenicol prolongadas en el tiempo provocan la saturación del metabolismo con el consiguiente daño hepático (Carraschi et al., 2018). En Brasil, las temperaturas de crianza a las que se someten los animales varían según las regiones y dentro de ellas según las estaciones del año (Casaroli et al., 2018). Por ello, el modelo propuesto en este trabajo permite ajustar las dosis específicas en función de la temperatura para cada región de cría y sus variaciones climáticas a lo largo del año.
El modelo permite determinar el perfil de concentración plasmática en función de la dosis administrada y la temperatura de crianza. Así, la asociación del modelo con un modelado farmacocinético/farmacodinámico (PK/PD) permitirá establecer la eficacia terapéutica en función de la Concentración Inhibitoria Mínima (CIM) de la bacteria que está infectando el lote (Toutain et al., 2021). Por ejemplo, se ha demostrado una variabilidad en la susceptibilidad de Streptococcus agalactiae observada por CIM, que va de 0.125 a 16 µg/ml de florfenicol (Gozi, 2016; Oliveira et al., 2018), y para Aeromonas spp de 0.125 a 4 µg/ml de florfenicol (Gozi, 2016; Godoy et al., 2008). El concepto de medicina de precisión aplicado en la producción animal implica también la administración de las dosis correctas para el lote correcto en el momento y en el periodo correcto. Por tanto, la integración del modelo propuesto con un modelo PKPD permitiría el cálculo de dosis para un tratamiento asertivo considerando variables de temperatura de crianza y susceptibilidad de la cepa infectante.
Ante los retos y dificultades que se presentan los cambios térmicos durante los periodos de crianza en los sistemas de producción, surge la necesidad de adaptar los manejos terapéuticos en las diferentes condiciones ambientales. La mayoría de los medicamentos veterinarios destinados al tratamiento de peces se administran por vía oral añadidos a la ración, debido a que esta vía de administración presenta una eficacia adecuada para el tratamiento de poblaciones y requiere procedimientos de manejo más simples. Sin embargo, esta vía de administración se muestra eficiente solo en condiciones donde los animales tienen condiciones metabólicas más altas, donde, a pesar de estar infectados, buscan voluntariamente el alimento proporcionado, lo que aplica a tratamientos con temperaturas más altas. Por tanto, este trabajo sirve de base para futuros estudios que determinen estrategias terapéuticas para tratamiento vía oral de lotes de tilapias criadas a bajas temperaturas.
CONCLUSIONES
El modelo propuesto por este trabajo permitió cuantificar el impacto de la temperatura en los parámetros farmacocinéticos, y estimar las concentraciones plasmáticas de florfenicol para la tilapia del Nilo (Oreochromis niloticus) a diferentes temperaturas de crianza.
El modelo resultó ser una herramienta prometedora para ajustar las dosis necesarias para optimizar los tratamientos en función de las temperaturas de crianza en diferentes regiones y climas.












 uBio
uBio 

