INTRODUCCIÓN
La Amazonía peruana acoge una gran diversidad de ictiofauna habiéndose registrado alrededor de 3000 especies (García Dávila et al., 2018), siendo ejemplares de varias de estas especies capturadas y distribuidas para el consumo humano en la región amazónica. Los pescados que se ofrecen en los mercados provienen en su mayoría de la pesca comercial o artesanal que se realizan en zonas aledañas de las ciudades o de centros piscícolas (García Dávila et al., 2018). De esta manera, la pesca en la región se convierte en uno de los primordiales valores ecosistémicos de los ríos y de biodiversidad, así como una de las principales acciones pro- ductivas (WCS, 2021).
Según PRODUCE (2020), la tasa de extracción de recursos hidrobiológicos procedentes de pesca amazónicos (considerándose principalmente las regiones de Loreto, Ucayali, Madre de Dios y San Martín) alcanzó las 19 184 t en 2021. Las principales especies destinadas para el consumo son el «boquichico» (Brycon amazonicus), «fasaco» (Hoplias malabaricus), «tigre zúngaro» (Pseudoplatystoma tigrinum), «palometa» (Mylossoma duriventre), «sardina» (Triportheus angulatus) y la «lisa» (Megaleporinus trifasciatus). El fasaco se encuentra dentro de los 10 pescados más extraídos (García Dávila et al., 2018). La presentación de los pescados en el mercado se encuentra según las costumbres de consumo de la localidad o región y del poder adquisitivo de los consumidores, pudiendo ser como frescos, congelados y seco-salado, entre otros (Cartay, 2018).
Los peces pueden convivir y estar infectados por diversos agentes patógenos y ser susceptibles a contraer enfermedades, tanto en su medio natural (ríos, quebradas, lagunas, etc.) como en cautiverio (centros de cultivo y de crianza) (Goncharov et al., 2018). Entre los agentes patógenos se encuentran los parásitos. Algunos de estos requieren de hospederos intermediarios para cumplir su ciclo biológico (Ferre, 2016). El parasitismo es una interrelación hospedero, parásito y ambiente. Los peces pueden llegar a ser hospederos intermediarios, definitivos, paraténicos o accidentales, dependiendo de su ciclo biológico (Murrieta Morey, 2019).
Algunas especies de nematodos (principalmente los anisákidos) pueden ser responsables de importantes enfermedades zoonóticas que son frecuentes en los países en los que existe el hábito de comer pescado crudo o poco cocinado (Blanco, 1998). El término anisakidosis se refiere a la enfermedad en humanos producida por cualquier miembro de la familia Anisakidae, mientras que la anisakiasis (o anisakiosis) es provocada particularmente por miembros del género Anisakis, la pseudoterranoviasis por el género Pseudoterranova y la contracaeciasis por miembros del género Contracaecum (Mühlenbrock et al., 2021).
Existen reportes de casos de ictiozonosis por consumo de peces parasitados, presentando síntomas como dolores de estómago, náuseas, vómitos y evidencias de perforación intestinal. El humano es considerado hospedero accidental por parásitos zoonóticos como especies del género Eustrongylides sp (Bjeliæ-Èabrilo et al., 2013). Es por esto que el consumo de pescado con parásitos de potencial zoonótico sin previas medidas correctivas puede llegar a ser un problema de salud pública (Murrieta Morey, 2019).
En la región de Loreto, Perú, el fasaco es consumido por los pobladores por ser una especie de bajo costo y de abundante carne. Ante esto, el presente estudio busca identificar los parásitos zoonóticos que se encuentran presentes en la musculatura y cavidad intestinal de Hoplias malabaricus (fasaco) colectados en el mercado Belén, Iquitos, a fin de generar información que pueda ser utilizada por los tomadores de decisiones para garantizar la inocuidad de la carne de pescado que se expende en los mercados.
MATERIALES Y MÉTODOS
Localización del Estudio
El presente trabajo se ejecutó en el Laboratorio de Parasitología y Sanidad Acuícola del Instituto de Investigaciones de la Amazonia Peruana (IIAP), ubicado en el distrito de San Juan Bautista, Maynas, región Loreto.
Especímenes
Basándose en la fórmula para calcular el tamaño de la muestra se determinó trabajar con 80 ejemplares de fasaco «Hoplias malabaricus», con medidas de 35.2 ± 3.4 cm y peso de 522.0 ± 151.0 g, que fueron adquiridos en el mercado Belén de Iquitos. Las muestras se analizaron en el laboratorio con ayuda de estereoscopios y microscopios. Adicionalmente se tomaron medidas biométricas de los parásitos encontrados.
Para el estudio se realizó un corte abdominal desde el ano hasta la altura de las branquias a los especímenes, y se retiraron los órganos para visualizar la cavidad visceral y observar la presencia de parásitos en esa zona. Para analizar los parásitos ubicados en la musculatura, se realizó un proceso de cortes y fileteado, e incluso en algunas partes musculares se hicieron pequeños cortes para analizarlos a vista del estereoscopio.
Colecta y Fijación de Parásitos
Los nematodos encontrados se colectaron y guardaron en alcohol 70%. Para el proceso de clarificación los parásitos fueron colocados en láminas portaobjetos, se agregaron unas gotas de ácido láctico hasta cubrir el nematodo, se cubrieron con laminillas y se les dejó reposar 24 horas. Las láminas fueron posteriormente observadas al microscopio para su identificación utilizando claves taxonómicas (Moravec, 1998).
Los trematodos encontrados fueron fijados con AFA (alcohol, formalina y ácido acético) por 24 horas, y se les dio un baño en alcohol 70% por 15 minutos. Las láminas fueron colocadas dentro de placas Petri, se agregó unas gotas de agua y con ayuda de pinceles se buscó posicionar al trematodo en forma ventral para cubrirlo con otra lámina, se cubrió toda la lámina con fijador AFA, y finalmente se comprimió al parasito y se dejó por 24 horas en esa posición. Para el estudio de las características morfológicas se colorearon los parásitos mediante el proceso regresivo de Carmín (Murrieta Morey, 2019). Los trematodos fueron fijados en forma permanente en las láminas con bálsamo de Canadá colocándolos en estufa por 24 horas a fin de identificarlos con ayuda del microscopio utilizando las claves taxonómicas de Thatcher (2006).
Los pentastómidos fueron guardados en alcohol 70% y colocados en láminas porta objetos con una gota de solución clarificadora Hoyer. Se les cubrió con laminillas cubreobjetos durante 24 horas para su identificación al microscopio mediante las claves taxonómicas indicadas por Giesen et al. (2013).
Para las medidas morfométricas se utilizaron 10 ejemplares por especie parasitaria en donde con ayuda de una regla metálica de 20 cm para el caso de los parásitos de mayor tamaño y el programa de captura de imagen del microscopio óptico Leica ICC50 para los parásitos más pequeños.
Índices Parasitarios
Los índices parasitarios son expresados según Bush et al. (1997):
Prevalencia (%). Se consideró como el número de hospederos infectados por una explícita especie de parásito dividido entre el número de peces examinados (P = [N.° peces infectados/N.° total de peces]*100).
Intensidad media. Se consideró el número total de parásitos de una determinada especie dividido por el número de peces examinados (IM = [N.° total de parásitos /N.° de peces infectados]).
Abundancia. Se consideró el número total de parásitos según la especie.
Abundancia media. Se consideró el total de parásitos de una determinada especie dividido entre el número total de peces examinados (AM = [N.° total de parásitos /N.° de peces examinados]).
RESULTADOS Y DISCUSIÓN
Parásitos zoonóticos en la musculatura de Hoplias malabaricus
Se registraron 31 nematodos del género Eustrongylides sp en estadio larval L3, considerado como parásitos con potencial zoonótico. Asimismo, se encontraron 11 trematodos (Ithyoclinostomum dimorphum) y 34 pentastómidos (Sebekia sp) considerados también con potencial zoonótico.
La descripción de los parásitos es como sigue:
Eustrongylides sp. Clase: Chromadorea
Orden: Spirurida (Chitwood,1933) Familia: Dioctophymatidae (Railliet, 1915)
Género: Eustrongylides (Jagerskiold,1909) Características: En la región cefálica se observan las papilas internas y externas con forma puntiaguda y redondeada, respectivamente. La terminación de la cola se observa en forma de una ventosa (forma de chupón), además del color rojizo característico cuando están vivos (Figura 1 y 2).

Figura 1 Estadio larval L3 de Eustrongylides sp sin clarificar. Se evidencia el color rojizo en todo el cuerpo
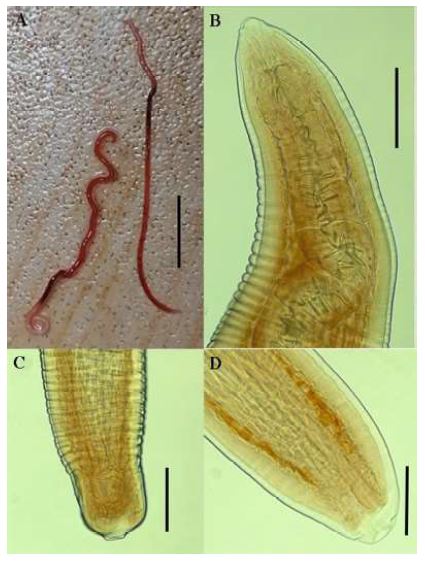
Figura 2 Eustrongylides sp. A. Cuerpo completo del endoparásito; B. Región anterior del cuerpo del parásito; C- D. Parte posterior del cuerpo
Ithyoclinostomun dimorphum Clase: Trematoda (Rudolphi, 1808) Orden: Enoplida
Familia: Clinostomidae (Luhe,1901) Género: Ithyoclinostomun (Witenberg,1925)
Especie: Ithyoclinostomun dimorphum
(Diesing, 1850) 33
Características: Mide 5 mm de largo. Presenta el cuerpo alargado y atenuado. Tiene una ventosa oral subterminal envolviendo la boca. En la parte anterior del cuerpo se encuentra la ventral o acetábulo con abertura en forma subtriangular (Figura 3).
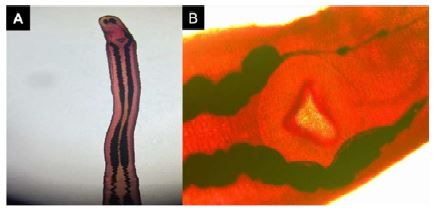
Figura 3 Ithyoclinostomun dimorphum. A. Parte anterior, cuerpo alargado; B. Ventosa ventral con abertura en forma subtriangular
Sebekia sp.
Clase: Pentastomida (Diesing,1836) Orden: Porocephalida (Heymons, 1935) Familia: Sebekidae (Sambon, 1922) Género: Sebekia sp. (Sambon, 1922)
Características: Cuerpo cilíndrico y anillado. Presenta cuatro mandíbulas, que con la presencia de la boca aparentan cinco estructuras ubicadas en la parte anterior del cuerpo (Figura 4).
Resultados diferentes fueron reportados por Brusa et al. (2019), quienes encontraron 10 taxas de parásitos, de los cuales 88.1% fueron acantocéfalos, 5.6% nematodos, 4.0% cestodos y 2.4% digeneos, con una mayor intensidad y abundancia de Quadrigyrus machadoi. La mayoría de las investigaciones parasitológicas en peces dulceacuícolas se han realizado en Brasil; entre ellas, el estudio de Kohn et al. (2011) en la zona media del río Paraná con 78 especies de peces, incluyendo Hoplias malabaricus, reportando 48 especies de nematodos, 34 de Digenea, 18 de Cestoda y 10 de Acantocephala.
Takemoto et al. (2009) evaluaron a los parásitos de H. malabaricus y Hopleryth- rinus unitaeniatus en la parte alta del río Paraná, encontrando los nematodos Eustron- gylides ignotus, Contracaecum sp, Porro- caecum sp, Paracapillaria piscicola, Procamallanus peraccurataus y Goezia spinulosa, así como el acantocéfalo Quadri- gyrus machadoi y el pentastómido Sebekia oxycephala. Por otro lado, Meneguetti et al. (2013) describe por primera vez a Eustrongylides sp en el estado de Rondônia, Amazonia occidental de Brasil. La presencia de estas larvas de nematodos no solo supone un riesgo sanitario en la salud pública, sino que también puede influir negativamente en el aspecto comercial del pez y sus derivados (Patiño y Olivera, 2019).
Índices parasitarios
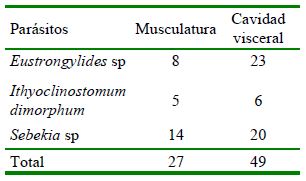
El parásito más prevalente fue Sebekia sp (42.50%) y el de menor prevalencia fue Ithyoclinostomum dimorphum (13.75 %; Cuadro 1).
Resultados similares obtuvieron Kohn et al. (2011) con ejemplares de H. malabaricus encontrando una prevalencia de 63% de nematodos, así comoMeneguetti et al. (2013) quienes reportaron una prevalencia de 93.3% de Eustrongylides sp. Resultados diferentes fueron registrados porBenigno et al. (2014) con una prevalencia de 0.96% de Ithyoclinostomum dimorphum parasitando la musculatura de H. malabaricus, yCosta et al.(2015) con 5.81% de prevalencia para Ithyoclinostomum sp. Las diferencias podrían ser atribuidas al número de peces evaluados o a su procedencia.
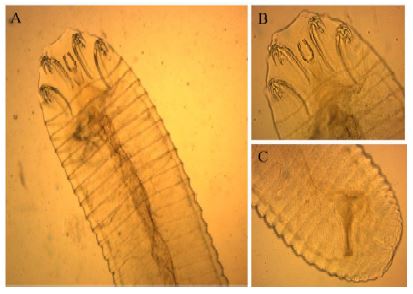
Figura 4 Sebekia sp. (Pentastómido). A. Cuerpo de Sebekia sp. B. Parte anterior mostrando los cuatro ganchos. C. parte posterior
Cuadro 1 Índices parasitarios de las especies de parásitos internos encontradas en Hoplias malabaricus adquiridos en el mercado Belén de Iquitos, Perú
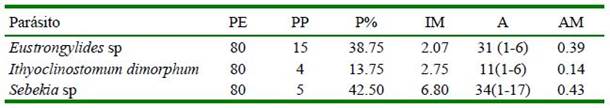
PE = peces examinados; PP = peces parasitados; P% = prevalencia; IM = intensidad media de infección;
A = abundancia, AM = abundancia media de infección
Lugar de fijación parasitaria
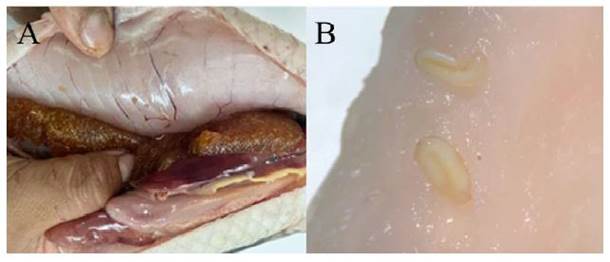
Se encontraron 27 parásitos en la musculatura y 49 en la cavidad visceral (Cuadro 2, Figuras 5-7).
Estos resultados coinciden con Pereira (2016) quién reportó la presencia de Sebekia sp en la musculatura de H. malabaricus. Por otro lado, Kuraiem et al. (2019) analizaron 20 peces parasitados por 347 larvas de nematodos indicando que la localización de Eustrongylides sp fue la musculatura, el mesenterio, la cavidad abdominal, la serosa del intestino, el estómago y el hígado. En forma similar, Milena Monroy (2019) menciona como lugar de fijación de Eustrongylides sp e Ithioclinostomun dimorphum el mesenterio, músculo y cavidad intestinal.
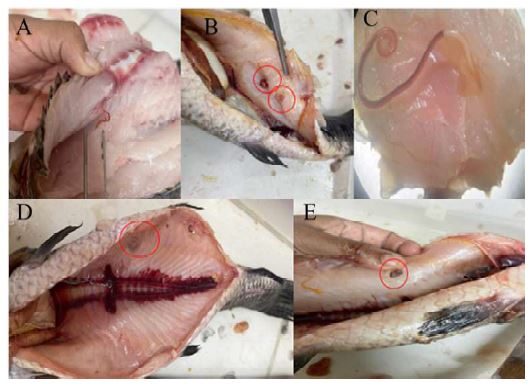
Figura 5 Fijación de Eustrongylides sp en Hoplias malabaricus. A) Nematodo fijado en la musculatura. B) Ejemplares de Eustrongylides sp ubicados en la musculatura. C) Ejemplar de Eustrongylides sp visualizado con el estereoscopio. D-E) Vista de Eustrongylides sp
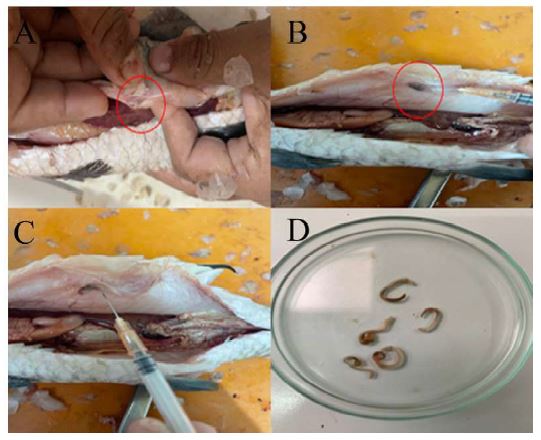
Figura 6 Fijación de Ithyoclinostomum dimorphum en Hoplias malabaricus. A) trematodo fijado en la musculatura. B-C) Ithyoclinostomum dimorphum fijado en la cavidad visceral. D) Ejemplares de Ithyoclinostomum dimorphum aislados en placas Petri
Morfometría de los parásitos
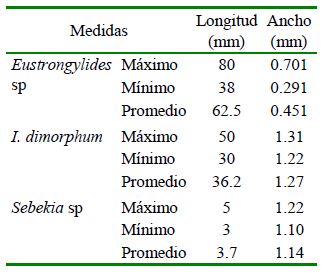
Los resultados de la morfometría realizada con base a las medidas de 10 parásitos de cada especie encontrada se presentan en el Cuadro 3.
Milena Monroy (2019) reportó medidas similares (77-78 mm) para Eustrongylides sp y de 41 mm para Ithioclinostomun dimorphum, en tanto que Meneguetti et al. (2013) registraron un tamaño de 50-70 mm para Eustrongylides sp. La longitud total de
I. dimorphum del presente estudio fue, no obstante, menor al descrito por Delgado et al. (2017) en «Shuyo» (Hoplerythrinus unitaeniatus), pero mayor al descrito por Costa et al. (2015) con 33 mm y Benigno et al. (2014) con 23.5 mm.
CONCLUSIONES
Endoparásitos de los géneros Eustrongy- lides sp y Sebekia sp y de la especie Ithyoclinostomum dimorphum fueron encontrados en la musculatura y cavidad visceral de Hoplias malabaricus.
Todas las especies de parásitos encontradas son considerados como parásitos con potencial zoonótico.
El parasito de mayor prevalencia fue Sebekia sp, seguido de Eustrongylides sp.












 uBio
uBio