INTRODUCCIÓN
La inseminación artificial es una herramienta de gran importancia para el mejoramiento genético de los rebaños, siendo la colecta de semen mediante vagina artificial la técnica más utilizada en la mayoría de las especies domésticas. En camélidos sudamericanos (CSA), además de la vagina artificial, se emplean otros métodos de colecta como la electro eyaculación, la fístula uretral y la aspiración post coital, entre otros (Giuliano et al., 2008; Pacheco, 2008; Carretero et al., 2017; Huanca et al., 2020; Fumuso et al., 2021; Garcia et al., 2021). El semen colectado se caracteriza por ser filante y altamente viscoso (Casaretto et al., 2012, Carretero et al., 2015), lo cual dificulta la evaluación, manejo y crioconservación de las muestras (Carretero et al., 2015; Kershaw et al., 2017; Fumuso et al., 2019). La colecta de espermatozoides mediante la desviación del conducto deferente es una técnica interesante para aplicar en los CSA, ya que es posible obtener muestras sin filancia, facilitando su manejo y evaluación, y permitiendo una mejor homogeneización con los diluyentes, lo que podría tener un efecto beneficioso en la criopreservación (Bertuzzi et al., 2020a).
El conducto deferente en los CSA es una estructura que emerge del testículo mediante el cordón espermático y que aumenta su diámetro al ingresar a la cavidad abdominal (de 2 a 3 mm) permitiendo realizar la técnica quirúrgica de desviación para la colecta de espermatozoides (Pérez et al., 2006, 2014). Se dispone de varios estudios en los que se congelan espermatozoides de alpaca obtenidos a partir de la desviación de los conductos deferentes (Gómez-Quispe et al., 2016; Mamani- Mango et al., 2019; Aisen et al., 2021), pero no existen reportes de congelamiento de espermatozoides de llama obtenidos a partir de esta técnica.
En la mayoría de los mamíferos domésticos, la crioconservación de espermatozoides consiste en la colecta de las muestras a temperatura corporal, su posterior fase de enfriamiento hasta los 5 °C, temperatura de equilibrio donde generalmente se adicionan los crioprotectores y el congelamiento que se realiza sobre vapores de nitrógeno líquido (-196 °C) (Khalil et al., 2018). La eficiencia del congelamiento de espermatozoides depende de factores como la especie, dilutores, crioprotectores, y tasas de enfriamiento y de congelación y descongelación, entre otros (Castro et al., 2016; Yeste, 2016; Peris-Frau et al., 2020). En los CSA se han analizado el efecto de varias de estos factores, incluyendo el uso combinado de crioprotectores permeables (Aller et al., 2003; Vaughan et al., 2003; Santiani et al., 2013; Carretero et al., 2015, Kershaw et al., 2017; Stuart et al., 2019; Contreras et al., 2020; Flores Huarco et al., 2021; Fumuso et al., 2021).
En semen congelado de llama tratado con colagenasa, Carretero et al. (2015) compararon dos temperaturas de equilibrio (temperatura ambiente y 5 °C), en tanto que Stuart et al. (2019) y Tarifa et al. (2021) compararon tres curvas de congelamiento en semen congelado de alpaca y de llama tratado con papaína. Así mismo, Mamani-Mango et al. (2019) evaluaron dos curvas de descenso de temperatura (rápida y lenta) para congelar espermatozoides de alpaca obtenidos del conducto deferente. Hasta nuestro conocimiento, no se ha reportado la evaluación de curvas de congelamiento en espermatozoides de llama obtenidos por desviación de los conductos deferentes. En tal sentido, el objetivo de la presente investigación fue determinar el efecto de tres curvas de crioconservación sobre la viabilidad de espermatozoides de llama procedentes del conducto deferente.
MATERIALES Y MÉTODOS
Animales y Lugar de Estudio
El estudio se realizó en las instalaciones del Laboratorio de Reproducción Animal de la Facultad de Medicina Veterinaria y Zootecnia, Puno-Perú, ubicada a una altitud de 3918 msnm. Se utilizaron seis llamas macho con edad promedio de 2.5 años y condición corporal promedio de 2. 7 (Van Saun y Herdt, 2014). Los animales se alimentaron con base a pastos cultivados (asociaciones de gramíneas y leguminosas) con suplementación de heno de avena y agua ad libitum, pernoctando en corrales con cobertizo.
Colecta y Dilutor
Se realizó la desviación de los conductos deferentes mediante intervención quirúrgica en las seis llamas, según Perez et al. (2014). Las colectas fueron realizadas aproximadamente a los dos meses posteriores al procedimiento quirúrgico. Para obtener los espermatozoides se realizó la fricción del conducto deferente hacia la salida de la fístula y la muestra (porción espermática) fue colectada con una punta de pipeta unida a una jeringa de tuberculina humedecida con el dilutor Tris (0.5 ml en un tubo de ensayo de 6 ml de capacidad) a 37 °C. Luego, las seis muestras fueron trasladadas al laboratorio y se mezclaron para evitar el efecto macho («pool» de espermatozoides de los seis machos). Se evaluó la motilidad y concentración espermática en cada pool. La colecta de los espermatozoides se realizó dos veces por semana durante tres meses, periodo en que se trabajó con 19 «pools».
La composición del dilutor fue: Tris (Tri- hidroximetilaminometano) 2.42 g, ácido cítrico 1.4 g, fructosa 1.0 g, glicerol 5% (Merck®, Alemania), yema de huevo 20% preparado en agua bidestilada y suplementado con 50 µg de gentamicina/ml según Anzar et al. (2011) con algunas modificaciones. El dilutor Tris mezclado con la yema de huevo se centrifugó a 4000 rpm por 30 min y el sobrenadante fue filtrado con papel filtro N.° 2 Whatman® para que las lipoproteínas de baja densidad (LDL: Lipoprotein density low) de la yema de huevo queden con el diluyente.
Crioconservación de Espermatozoides
Los «pools» fueron diluidos a 120x106 espermatozoides/ml con la Fracción A (Tris, ácido cítrico, fructosa y yema de huevo) a 37 °C; seguidamente se procedió al proceso de enfriamiento hasta los 5 °C por un lapso de 2.5 h, donde se adicionó la Fracción B (Tris, ácido cítrico, fructosa, yema de huevo y glicerol [al 10% en esta fracción y al final de la dilución quedará a 5%]) llegando a una concentración final de 60x106 espermatozoides/ml. Las muestras se mantuvieron durante 30 min a 5 °C (fase de equilibro). Las muestras fueron almacenadas en pajillas de 0.25 ml (IMV Technologies®; Francia) y congeladas en un biocongelador de semen (TK 3000 CSE, TK Technologies®, Brasil) utilizando una tasa de descenso de la temperatura de -20 °C/minuto y llegando a tres temperaturas antes de ser introducidas al nitrógeno líquido: -80 °C (TI), -100 °C (TII) y -120 °C (TIII) en 4, 5 y 6 minutos, respectivamente. El descongelamiento se realizó a 37 °C durante 45 s. El diseño experimental se presenta en la Figura 1.
Características Espermáticas
Se evaluó la motilidad, funcionalidad de membrana y viabilidad espermática luego de la colecta («pools»), y en la fase de equilibrio y en pos-descongelación.
La motilidad se evaluó utilizando un microscopio de contraste de fase y una platina térmica (37 °C) colocando una gota de 20 µl de muestra entre porta y cubreobjetos (100x). Se evaluaron los siguientes patrones: motilidad progresiva (MP: espermatozoides que se mueven en línea recta o describiendo grandes círculos), motilidad oscilatoria (MO: espermatozoides que se mueven en su lugar sin avanzar) y motilidad circular (MC: espermatozoides que se mueven en círculos muy cerrados), determinándose la motilidad total (MT: MP+MO+MC) (Bertuzzi et al., 2022).
La funcionalidad de membrana se evaluó mediante el test hipoosmótico (HOS- test) utilizando una solución hipoosmolar compuesta por citrato de sodio dihidratado (0.735 g) y fructosa (1.351 g) [Merck®, Alemania] csp 100 ml de agua destilada). Se contaron un mínimo de 200 espermatozoides en microscopio de contraste de fase a 400x (Flores Huarco et al., 2021). Los espermatozoides que mostraron hinchazón a nivel de la cola fueron clasificados como Hos positivos teniendo la membrana plasmática funcional.
Cuadro 1 Porcentajes de motilidad (promedio ± error estándar) a la descongelación en espermatozoides de llama obtenidos de la desviación de los conductos deferentes y sometidos a tres curvas de crioconservación (n=19)

a Letras similares dentro de filas indican ausencia de diferencia significativa (p˃ 0.05)
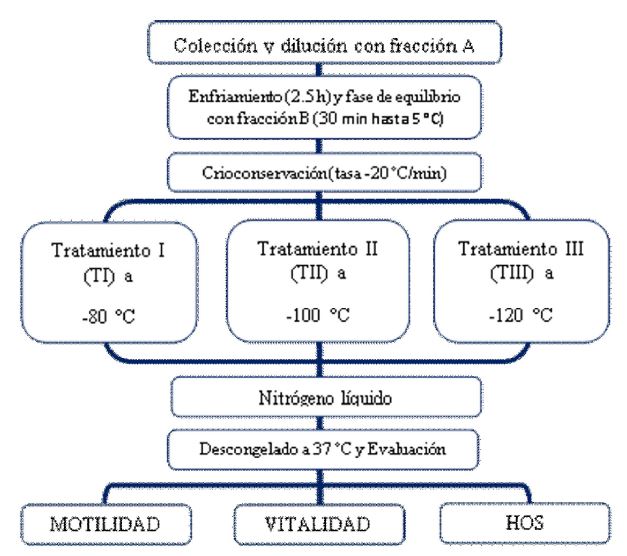
Figura 1 Diseño experimental utilizado para la criopreservación de espermatozoides de llamas obtenidos de la desviación de los conductos deferentes.
La vitalidad fue evaluada con eosina - nigrosina (1 g eosina, 5 g de nigrosina, csp 100 ml) colocando sobre el porta- objetos atemperado 10 µl de muestra y 20 µl del colorante y se realizando un frotis. Se contaron un mínimo de 200 células en microscopio de contraste de fase a 400x, para determinar el porcentaje de espermatozoides vivos (aquellos que no se colorearon) y muertos aquellos que se colorean (Gómez-Quispe et al., 2016).
Análisis Estadístico
Los análisis fueron realizados mediante el programa estadístico de R con el paquete RCmdr (R Core Team, 2020). Los datos fueron sometidos a la prueba de Shapiro Wilk y Levene para comprobar los supuestos de normalidad y homocedasticidad, respectivamente. Para comparar los parámetros espermáticos entres los pools (luego de la colecta) y las muestras equilibradas se utilizó un T de Student apareada. Además, se realizaron estudios de correlación entre los parámetros espermáticos utilizando la prueba de Pearson habiendo determinado el su puesto de normalidad de las variables. Los patrones de motilidad (MP, MO y MC) en las muestras descongeladas fueron analizados mediante una multi-análisis de varianza; mientras que, para comparar la MT, funcionalidad de membrana y viabilidad de las muestras descongeladas se utilizó un análisis de varianza «one way» con comparación de medias de Tukey.
RESULTADOS Y DISCUSIÓN
Características espermáticas a la colecta y fase de equilibrio
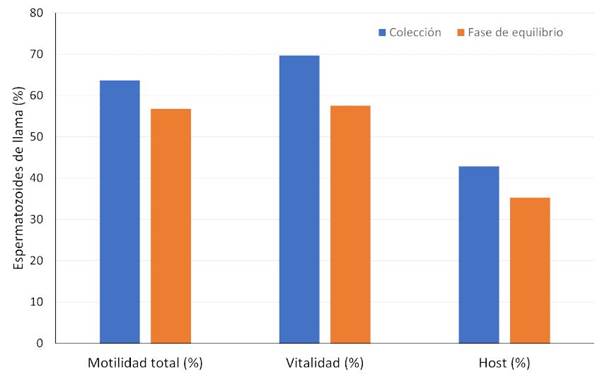
Los resultados de las características espermáticas luego de la colecta fueron de 63.7 ± 2.3%, para la MT, 42.9 ± 3.4% para la funcionalidad de membrana y 69.7 ± 2.3% para la viabilidad (promedio ± error estándar). Se observó una correlación media positiva entre la funcionalidad de membrana y la MT (r2=0.55, p=0.26), una correlación alta positiva entre la viabilidad y la MT (r2=0.78, p=0.07) y una correlación baja positiva entre la funcionalidad de membrana y la viabilidad (r2=0.01, p=0.978).
Los valores obtenidos durante la fase de equilibrio (5 °C) fueron: 56.8 ± 2.9% para MT, 35.3 ± 1.6% para funcionalidad de membrana y 57.6 ± 1.4% para la viabilidad. Se observaron correlaciones altas positivas entre la funcionalidad de membrana y la MT (r2=0.881, p=0.02), la viabilidad y MT (r2=0.813, p=0.049) y la funcionalidad de membrana y la viabilidad (r2=0.708, p=0.1153). Por otro lado, se observó una disminución significativa (p<0.05) en las tres características espermáticas (MT, viabilidad y funcionalidad de membrana) en las muestras equilibradas respecto a las muestras luego de la colecta (Figura 2).
Cuadro 2 Porcentajes de motilidad total, funcionalidad de membrana y viabilidad a la descongelación (promedio ± error estándar) en espermatozoides de llama obtenidos de la desviación de los conductos deferentes y sometidos a tres curvas de congelación (n=19)

a,b Letras diferentes dentro de filas indican diferencias significavas (p˂0.05)
El 63.7% de MT luego de la colecta fue superior a lo reportado en espermatozoides de llama obtenidos por electroeyaculación y vagina artificial (22 a 50%) (Giuliano et al., 2008; Santa Cruz et al., 2016; Bertuzzi et al., 2020b; Carretero et al., 2020; 2021; Fumuso et al., 2021). No obstante, estos valores fueron similares a lo reportado en estudios don- de los espermatozoides fueron obtenidos mediante la desviación del conducto deferente (Aisen et al., 2021; Bertuzzi et al., 2020a; Meza et al., 2018). Tanto en la colecta con electroeyaculación como con vagina artificial se obtienen espermatozoides con plasma seminal (semen) que, en los CSA se caracteriza por ser viscoso, mientras que, en muestras obtenidas de los conductos deferentes se obtienen espermatozoides sin plasma seminal, lo cual influencia los resultados de motilidad.
La funcionalidad de membrana obtenida de 42.95% fue similar al 35.6 y 40% reportado en espermatozoides de alpacas obtenidos por corte y lavado de epidídimos (Mamani-Mango et al., 2019) y de 40-45% en semen de llama obtenido por electroeyaculación (Bertuzzi et al., 2020b; Fumuso et al., 2021), pero inferior al 71.7 y 50% reportado en muestras obtenidas del conducto deferente de alpacas (Gómez-Quispe et al., 2016; Bertuzzi et al., 2020a).
El 69.7% de viabilidad observada al momento de la colecta fue similar al 71.7% reportado por Mamani-Mango et al. (2019) en espermatozoides de epidídimo de alpaca y ligeramente inferior al 79.3% reportado en espermatozoides de alpaca obtenidos de la desviación de los conductos deferentes (Gómez-Quispe et al., 2016).
Los parámetros evaluados muestran una disminución de entre 10 a 20% luego del proceso de equilibrio (5 °C) en comparación con los valores determinados al momento la colecta. Tal y como sucede en semen de otras especies, la disminución de temperatura hasta los 5 °C genera daños irreversibles en los espermatozoides como cambios de orientación de los lípidos de la membrana plasmática, pérdida de la motilidad, baja producción de energía, daños en el acrosoma y la membrana plasmática, reducción del metabolismo y pérdida de iones y de componentes intracelulares (Salamon y Maxwell, 2000; Medeiros et al., 2002; Kumar et al., 2003). Contrario a estos resultados, Fumuso et al. (2021) no observaron diferencias significativas en motilidad total ni en porcentaje de espermatozoides vivos con acrosomas intactos en semen de llama de muestras equilibra- das a 5 °C y semen fresco.
Características espermáticas a la descongelación
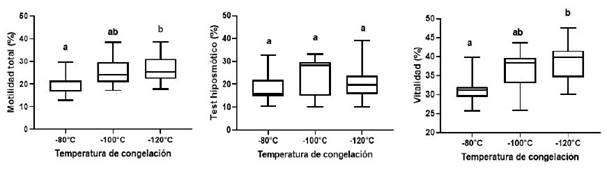
No se observaron diferencias significativas (p>0.27) en motilidad (progresiva, oscilatoria y circular) entre las curvas de congelación de las muestras (Cuadro 1). Los porcentajes de motilidad total y viabilidad fueron significativamente mayores en las muestras congeladas con la curva de congelamiento TIII respecto a la TI (p=0.0416 y p=0.0031, respectivamente), en tanto que no se observaron diferencias significativas en la funcionalidad de membrana entre las tres curvas de congelamiento (p>0.27) (Cuadro 2).
En las tres curvas de congelamiento se observó una caída cercana al 65% en la motilidad total de los espermatozoides. Simi- lar descenso fue reportado en espermatozoides congelados-descongelados de llama y de alpaca (Aller et al., 2003; Santiani et al., 2013; Stuart et al., 2019; Fumuso et al., 2020, 2021; Aisen et al., 2021). Teniendo en cuenta que Santiani et al. (2018) reportaron que la criopreservación de espermatozoides de epidídimo de alpaca afecta la motilidad y el potencial de membrana mitocondrial, el descenso de la motilidad observado en el presente estudio podría vincularse a una disminución en la actividad mitocondrial; sin embargo, este parámetro no fue analizado en el presente estudio. Por otra parte, se observó asimismo una caída cercana al 50% en la funcionalidad de membrana y la viabilidad, tal y como ha sido reportado en semen congelado de CSA (Aller et al., 2003; Santiani et al., 2013; Carretero et al., 2015; Stuart et al., 2019; Fumuso et al., 2020, 2021).
En la Figura 3 se muestran las diferencias en motilidad total y viabilidad por efecto de las curvas de congelación TI (-80 °C) y TIII (-120 °C), generando una mejor respuesta en TIII. La figura permite determinar mayor o menor variabilidad en los porcentajes obtenidos (tamaño de cajas y largo de los bigotes), observando una importante variabilidad en la funcionalidad de membrana al utilizar la curva TIII (-120°C) y en la viabilidad al utilizar la curva TII (-100°C).
Se tienen pocos estudios en CSA que comparen curvas de congelamiento a partir de una misma muestra de semen o espermatozoides. En semen congelado de llama tratado con colagenasa, Carretero et al. (2015) compararon dos temperaturas (temp. ambiente y 5 °C) para el equilibrio de las muestras con los crioprotectores encontrando mayores porcentajes de espermatozoides con sus membranas funcionales al realizar el equilibrio a 5 °C (24.2 vs. 29.3%), siendo estos valores similares a los observados en el presente estudio. Por otra parte, en semen criopreservado de alpaca tratado con papaína, Stuart et al. (2019) observaron mayores porcentajes de movilidad espermática al utilizar una curva rápida (-47.8 °C/min) de congelamiento respecto a las curvas media y lenta (23.9 y 16 °C/min), siendo igualmente con valores similares a los observados en el presente estudio.
Tarifa et al. (2021), utilizando semen congelado de llama tratado con papaína no observaron diferencias en la viabilidad espermática (29.92, 29.98 y 29.46%) al comparar curvas de congelamiento con duración de 13, 15 y 18 minutos, respectivamente. Sin embargo, estos autores no reportan la tasa de descenso de la temperatura. Por otro lado, Mamani-Mango et al. (2019) congelaron espermatozoides de alpaca obtenidos de la cola del epidídimo y reportaron mejores valores de motilidad (20.9 vs 35.7%) y viabilidad (30.4 vs 40.0%) al utilizar una curva rápida de congelamiento (100- 150 °C/min) respecto a una curva lenta (10- 15 °C/min).
En conclusión, de los protocolos de congelamiento evaluados, la curva de descenso de la temperatura hasta los -120 °C utilizando una tasa de -20 °C/min, sería la más adecuada para criopreservar espermatozoides de llama obtenidos a partir de la desviación de los conductos deferentes. Sin embargo, sería conveniente evaluar otras curvas de descenso de la temperatura con el objetivo de mejorar la sobrevida espermática al descongelamiento de las muestras, por ejemplo, una curva rápida similar a la utilizada por Mamani-Mango et al. (2019).












 uBio
uBio