INTRODUCCIÓN
La inseminación artificial (IA) es una de las biotecnologías reproductivas que permite el uso más eficiente del macho y su empleo se encuentra ampliamente difundido en la especie porcina; sin embargo, solo el 1% de los servicios de IA se realizan con semen congelado (Didion et al., 2013). El uso de espermatozoides criopreservados se encuentra limitado, en parte debido a la menor tasa de fertilidad y prolificidad que se obtiene en comparación con las del semen fresco. No obstante, entre las ventajas que conlleva su aplicación incluye mayor aprovechamiento de los verracos de alto valor genético, la eliminación de riesgos sanitarios, aprovechamiento del semen en épocas reproductivas desfavorables y ventajas en el comercio internacional de semen congelado (Pezo et al., 2019; Jovièiæ et al., 2020).
La menor fertilidad y prolificidad del semen congelado de porcinos en comparación con el semen refrigerado se debe probablemente a la mayor sensibilidad de los espermatozoides al proceso de congelación en comparación con otras especies, donde las temperaturas de congelación afectan a la membrana plasmática y acrosomal (Yeste et al., 2017; Pezo et al., 2019; Jovièiæ et al., 2020). Para prevenir estos daños y mejorar los resultados de fertilidad del semen descongelado se han realizado diferentes modificaciones a los protocolos de congelación, incluyendo el uso de diluyentes basados en la utilización de la yema de huevo y de glicerol como agentes crioprotectores, o de concentraciones elevadas de azúcares aunado a la adición de un detergente (Orvus et paste) (Yeste et al., 2017; Jovièiæ et al., 2020).
Triladyl® es un diluyente ampliamente utilizado para la criconservación de semen de bovinos, ovinos y caprinos (Rekha et al., 2016; Miguel-Jimenez et al., 2020), pero existe escasa información sobre su empleo en semen porcino (Lee et al., 2010, 2015). Es importante destacar que uno de los componentes del Triladyl® es el Tris (hidroximetil aminometano) que se utiliza en el protocolo de congelación de verracos de Pursel y Johnson (1975), y en la preparación del diluyente de congelación Beltsville 5, siendo junto con el Ley-Leygo, uno de los más utilizados (Yeste et al., 2017; Pezo et al., 2019).
Otro aspecto importante relacionado con el procesamiento y la congelación del semen es el tiempo de equilibrio aplicado; es decir, el tiempo que debe transcurrir después de incorporar el crioprotector hasta el momento en que el semen se somete a la temperatura de congelación. Si bien se ha reportado que el tiempo de equilibrio influye en la motilidad espermática a la descongelación, en la integridad de la membrana espermática, en el porcentaje de actividad mitocondrial de los espermatozoides y en el porcentaje de espermatozoides con acrosoma normal, los resultados aún son contradictorios (Schäfer et al., 2017; Passarelli et al., 2020).
En México existe escasa información sobre el diluyente adecuado para la congelación del semen porcino y del efecto de los tiempos de equilibrio durante el proceso de criopreservación para minimizar el daño celular durante la congelación en esta especie. Por lo tanto, el objetivo de este estudio fue evaluar el efecto de los diluyentes Ley-Leygo y Triladyl® y dos tiempos de equilibrio sobre la motilidad individual, la integridad de la membrana plasmática, la actividad mitocondrial y el acrosoma intacto del semen congelado- descongelado de cerdo.
MATERIALES Y MÉTODOS
Área de Estudio
El estudio se llevó a cabo en el laboratorio del Departamento de Reproducción y Mejoramiento Genético del Campus de Ciencias Biológicas y Agropecuarias de la Universidad Autónoma de Yucatán, ubicado en Mérida, Yucatán, México. El clima de la región es tropical subhúmedo tipo Aw0, con una precipitación pluvial anual de 983 mm, una humedad relativa entre 75 y 80% y temperatura anual entre 25 y 28 °C.
Procedimientos
Se utilizaron cinco verracos de la línea PIC 337, de entre 2 y 3 años de edad, todos bajo el mismo régimen de manejo y alimentación de la granja. El semen se obtuvo con el método de la mano enguantada, recogiendo únicamente la fracción rica del eyaculado. Las colectas de semen se realizaron a intervalos de 5 a 7 días obteniendo cuatro eyaculados de cada verraco. Las muestras fueron colocadas de inmediato en probetas graduadas en el baño a 37 °C para su evaluación.
Se determinó el volumen del eyaculado a través de la observación directa de la probeta graduada, la motilidad masal (MS) mediante una gota de semen que se colocó en un portaobjetos y se observó con microscopía de campo brillante utilizando el objetivo 100x. La MS se calificó en cruces (0 a 5), siendo cinco la calificación más alta. Además, se colocó una gota de semen en un portaobjetos con un cubreobjetos para observar la motilidad espermática individual (MI) con el objetivo de 400x. Para esto, se evaluó el tipo de movimiento y se puntuó el porcentaje de motilidad de los espermatozoides (0-100%) tras observar tres o cuatro campos del frotis. Finalmente se realizó una dilución 1:1 con Beltsville Thawing Solution (BTS).
El semen diluido con BTS fue depositado en tubos Falcon de 50 ml dentro de un termo y se transportó al laboratorio para continuar el proceso. Allí se evaluó nuevamente el semen para verificar que la muestra conservara una MI no inferior al 80%. Las muestras permanecieron durante 1 h a 24 °C. En el entretiempo se evaluó la concentración espermática tomando 0.1 ml de semen que fue diluido 1:100 con 99.9 ml de solución salina fisiológica con azul de metileno y formol al 1%. Con la ayuda de una pipeta Pasteur, se tomó una porción de esta preparación y se llenó una cámara Burker. Finalmente, con el objetivo de 400x se procedió a contar los espermatozoides expresando el resultado como número de espermatozoides por mililitro.
Para evaluar la morfología espermática se preparó una solución con formaldehído al 1% y semen puro. Se tomó una gota de esta mezcla y se determinó la morfología en el microscopio de contraste de fase a 1000x. Se contaron 100 espermatozoides por muestra y se determinó el porcentaje de anormalidades primarias o secundarias (Yoval- Montemira et al., 2020).
Los eyaculados que se utilizaron para la congelación debían tener al menos 80% de espermatozoides normales y 85% de MI (Roca et al., 2006).
Diluyentes de Congelación y Tratamientos
Los diluyentes utilizados para la congelación fueron Ley-Leygo (Lactosa y yema de huevo), siguiendo el protocolo de Westendorf et al. (1975) y el diluyente comercial Triladyl® (Minitüb, Alemania). El diluyente Ley-Leygo consta de una fracción (Ley) compuesta por 80% de agua destilada estéril, 20% de yema de huevo, 8.49 g de lactosa B y 40 µl de kanamicina, y una segunda fracción (Leygo) que incluye 92.5% de la fracción Ley, 6% de glicerol y 1.5% del detergente Orvum Paste. El diluyente Triladyl® está compuesto por glicerol, citrato de sodio, fructosa, ácido cítrico, Tris (hidroximetilaminometano), lincomicina y estreptomicina. En la preparación de este diluyente se utilizó 60% de agua destilada, 20% de yema y 20% de Triladyl®.
Cada muestra de semen se dividió en cuatro partes iguales en tubos Falcon de 15 ml. Dos tubos se diluyeron con el primer diluyente (LEY-Leygo) y los dos tubos restantes con Triladyl®. Asimismo, con cada diluyente se trabajó con dos tiempos de equilibrio, 0 y 1 h. Los tratamientos quedaron como sigue:
T1. Diluyente LEY-Leygo + 0 h de tiempo de equilibrio
T2: Diluyente Triladyl® + 0 h de tiempo de equilibrio
T3: Diluyente LEY-Leygo + 1 h de tiempo de equilibrio
T4: Diluyente Triladyl® + 1 h de tiempo de equilibrio
Congelación del Semen
Se utilizó el proceso de congelación descrito por Westendorf et al. (1975) y modificado por Thurston et al. (1999). Las muestras en tubos Falcon de 4 a 15 ml fueron colocadas en una conservadora a 16 °C durante 3 h (previamente 1 h a 24 °C). Luego, los tubos se centrifugaron a 800 g durante 15 min a 16 ºC en una centrífuga refrigerada (Hermle, Alemania). Se eliminó el exceso de plasma seminal quedando en el tubo el pellet con los espermatozoides, al cual se añadió el diluyente correspondiente. En el caso de T1 y T3, se añadió la primera fracción (Ley), asegurando una concentración de 1500 x 106 de espermatozoides/ml para cada tubo, en tanto que para T2 y T4 se hizo una dilución buscando una concentración final de 1000 x 106 de espermatozoides/ml. A continuación, todos los tubos se sumergieron en un recipiente con agua a 16 ºC, y luego a 5 °C durante 2 h. Al final de este tiempo, se añadió a las muestras de T1 y T3 la segunda fracción (Leygo) que ajustó la concentración a 1000 x 106 de espermatozoides/ml.
Las muestras de T1 y T2 (0 h de tiempo de equilibrio) fueron envasadas de inmediato en nitrógeno líquido, en tanto que las muestras de T3 y T4 permanecieron 1 h a 5 °C. Todas las muestras se envasaron en pajillas de 0.54 ml con una concentración final de 500 x 106 de espermatozoides por pajilla.
Para la congelación, las pajillas se colocaron en una rampa, a una altura de 5 cm del nitrógeno líquido contenido dentro de una caja de espuma de poliestireno, recubierta de acero para exponer el vapor de nitrógeno durante 20 min, y luego se sumergieron en el nitrógeno líquido. Las pajillas se almacenaron posteriormente en un termo con nitrógeno líquido. La descongelación se realizó a las 72 h de la congelación, en un baño de agua a 37 °C durante 20 s, agitando enérgicamente la pajilla. Finalmente se efectuó una dilución 1:1 con BTS y se esperó 1 min para la evaluación.
Evaluación del Semen Congelado-Descongelado
En el semen descongelado se evaluó la MI. Se tomó una gota de semen diluido y se observó con microscopio óptico (400x). También se cuantificó la integridad acrosomal de los espermatozoides, para lo cual se tomó una gota del semen diluido y se depositó en tubos con formol al 1%. Se evaluaron 100 espermatozoides por muestra, utilizando un microscopio de contraste de fase a 1000x. considerando acrosomas intactos (AI) aquellos que tenían una forma de medialuna oscura, clara y bien definida (Yoval-Montemira et al., 2020).
La integridad de la membrana plasmática (IMP) y la actividad mitocondrial espermática (AM) se analizaron mediante la técnica de fluorescencia con diacetato de carboxifluoresceína (DCF) y rodamina 123 (Sigma-Aldrich, USA). Se mezclaron dos pajillas de cada tratamiento y se tomaron 500 µl de semen, y se llevaron a un cuarto oscuro (requerido por las características químicas de las tinciones) para agregar 20 µl de DCF y 6 µl de rodamina. Se incubó a 37 °C durante 10 min. Luego se tomaron 4 µl de la muestra para su observación en un microscopio de epifluorescencia (Olympus, Japón) a 1000x. Primero se contaron 100 espermatozoides para determinar la integridad de la membrana plasmática teniendo en cuenta cómo integrar los espermatozoides que mostraban una coloración verde en la cabeza. Posteriormente, en la misma muestra se tomó el mismo volumen y se procedió a analizar la actividad mitocondrial, considerando como espermatozoides activos aquellos que mostraban una fluorescencia verde en la sección media (Nagy et al., 2003). Los resultados para ambos indicadores se expresaron en porcentaje.
Análisis Estadístico
Los datos se analizaron bajo un diseño factorial de 2x2 (dos diluyentes: Ley-Leygo y Triladyl®, y dos tiempos de equilibrio: 0 y 1 h). Cada tratamiento tuvo 20 repeticiones. Las variables dependientes estudiadas fueron los porcentajes de MI, IMP, AM y de espermatozoides con AI. Para conseguir una distribución normal, los datos se transformaron mediante la función de raíz cuadrada. Se utilizó Statgraphics Plus 5.1. Los valores se consideraron significativos cuando p<0.05. Los resultados se presentan como media y error estándar de la media (EE).
RESULTADOS
En el Cuadro 1 se muestran los resultados del estudio expresados como media y error estándar (EE). La motilidad espermática individual (MI) y la integridad de la membrana plasmática (IMP) no fueron afectadas por los diluyentes ni por los tiempos de equilibrio (p>0.05).
Cuadro 1 Efecto de dos diluyentes y de dos tiempos de equilibrio en la congelación del semen de verraco
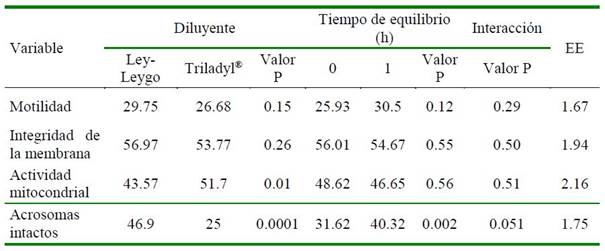
Los valores de la actividad mitocondrial espermática (AM) fueron más altos con el uso del Triladyl® en comparación con aquellos del Ley-Leygo (p<0.05); sin embargo, el tiempo de equilibrio no afectó esta variable (p>0.05).
El porcentaje de espermatozoides con acrosoma intacto (AI) fue mayor con el tratamiento a base de Ley-Leygo comparado con el diluyente Triladyl® (p<0.001), así como con el tiempo de equilibrio de 1 h (p<0.05). Por otro lado, la interacción (diluyente x tiempo de equilibrio) no afectó (p>0.05) a las variables de estudio.
DISCUSIÓN
El MI de los espermatozoides a la descongelación fue en general bajo y sin diferencias entre diluyentes ni entre tiempos de equilibrio. Estos resultados fueron similares a los reportados por Buranaamnuay et al. (2009) utilizando el diluyente Ley-Leygo para la congelación; no obstante, Malo et al. (2010) reportaron una mayor MI (59%) utilizando el diluyente Ley-Leygo a la obtenida en el presente estudio. Por otro lado, Lee et al. (2011) encontraron mayor MI con Ley-Leygo que empleando Triladyl®. Estas diferencias en MI, a pesar de utilizar el mismo diluyente, probablemente se deban a la variabilidad del verraco, a la época en que se realizaron los experimento y a otros factores como el método de congelación. En general, se espera una disminución pos-descongelación de la MI de hasta 40-50% (Salamon y Maxwell, 2000), debido al daño sufrido por las células espermáticas como consecuencia del choque de frío, el estrés osmótico, el aumento de la concentración de sales, los cambios en el pH, la desnaturalización de proteínas, la ruptura mecánica de elementos estructurales y la formación de cristales de hielo intracelulares durante el proceso de congelación y posterior descongelación (Yeste et al., 2017).
Los resultados del efecto del tiempo de equilibrio sobre la MI coinciden con otros trabajos (Yi et al., 2002; Khan et al., 2013; Schäfer et al., 2017). En forma similar, Herold et al. (2006) realizaron un estudio en búfalos utilizando Triladyl® con diferentes tiempos de equilibrio (2-9 horas), sin encontrar diferencias significativas en MI. Generalmente, se considera adecuado utilizar entre 2 y 4 h como tiempo de equilibrio para que el crioprotector pueda penetrar la célula espermática, dependiendo de la concentración y tipo de crioprotector (Leite et al., 2010).
El estudio no mostró diferencias significativas entre diluyentes ni entre tiempos de equilibrio para el IMP. Saravia et al. (2009), utilizando el diluyente Ley-Leygo indican que es posible alcanzar hasta 63.3% de espermatozoides con membrana íntegra a la des- congelación; no obstante, los resultados de este estudio fueron similares a los reportados por Yoval-Montemira et al. (2020) quienes obtuvieron 55.4% de IMP , en tanto que Lee et al. (2015), utilizando Triladyl, solo obtuvieron 40% de IMP a la descongelación. El hecho de no encontrar diferencias entre tratamientos se podría deber a que ambos diluyentes están elaborados con yema de huevo, el cual contiene lipoproteínas de baja densidad, que recubren la membrana plasmática de los espermatozoides protegiéndola de daños durante la congelación y descongelación (Malo et al., 2010; Jovièiæ et al., 2020). Tampoco tuvo efecto el tiempo de equilibrio, probablemente debido a que los fosfolípidos de la membrana plasmática ya se encuentran estabilizados, siendo por lo tanto más resistente a los cambios que se producen durante el proceso de congelación (Yi et al., 2002; Alcay et al., 2016).
Con respecto a la AM, se obtuvieron mejores resultados con el empleo del Triladyl®. Estos resultados fueron similares a los reportados por Yoval-Montemira et al. (2020), utilizando el diluyente Ley-Leygo. No se dispone de una explicación sólida para los resultados obtenidos con Triladyl® debido a la insuficiente información (Lee et al., 2010). Sin embargo, Palacios (1994) señala que durante el descenso de la temperatura en el proceso de congelación, especialmente a 20 ºC, se produce un aumento de la permeabilidad de la membrana plasmática debido al daño que se produce en las bombas de iones, provocando una salida de iones, afectando a los espermatozoides, de allí que sería posible que el Triladyl®, añadido a 16 ºC, proporcione una mayor protección a los espermatozoides a través del tris (hidroximetil aminometano), que tiene la función de regular el pH del medio y como consecuencia, la concentración de Ca intracelular se mantiene en niveles adecuados para estimular la producción de ATP por las mitocondrias a través de la fosforilación oxidativa (Olivera et al., 2006).
En relación con el porcentaje de AI a la descongelación, hubo diferencias significativas entre diluyentes. Se obtuvieron valores más bajos de AI con el uso de Triladyl®, posiblemente debido a que este diluyente contiene 7% de glicerol (Morrier et al., 2002). Se ha observado que tasas superiores al 6% de glicerol en el diluyente afectan negativamente a la integridad del acrosoma del verraco (Corcuera et al., 2007). No obstante, puede que la técnica utilizada para evaluar el acrosoma, al ser subjetiva, no haya sido debidamente interpretada, ya que no hubo diferencia en la integridad de la membrana, pero sí en el acrosoma. Esto podría indicar un error en la evaluación de las muestras, ya que la yema presente en el diluyente impide la correcta visualización del acrosoma.
Khan et al. (2013) encontraron menor porcentaje de AI a la descongelación con un tiempo de equilibrio de 0 h (53.2%) en comparación al obtenido con 1 h de equilibrio (56.7%), semejante a lo obtenido en el presente estudio. Sin embargo, Yi et al. (2002) obtuvieron 45 y 67% de AI a la descongelación con 0 y 1 hora de tiempo de equilibrio, respectivamente. Por otro lado, el mejor porcentaje de AI fue empleando el diluyente Ley- Leygo, probablemente debido a la adición del Orvus es Paste, ya que este proporciona una mayor protección al espermatozoide, al modificar los componentes de la yema del huevo, actuando específicamente sobre los fosfolípidos y proporcionando protección a las bombas iónicas de la membrana del espermatozoide. En este sentido, las concentraciones intracelulares de calcio serían menores y, por lo tanto, se reduce el estrés osmótico de congelación y descongelación proporcionando una mayor protección al acrosoma (Fraser et al., 2014).
CONCLUSIONES
Los diluyentes Ley-Leygo y Triladyl® presentaron efectos similares sobre la motilidad individual y la integridad de la membrana plasmática
El diluyente Triladyl® mejoró la actividad mitocondrial de los espermatozoides a la descongelación.
Una hora como tiempo de equilibrio incrementó el porcentaje de acrosomas intactos de los espermatozoides a la descongelación, en comparación con 0 h de tiempo de equilibrio.












 uBio
uBio 

