INTRODUCCIÓN
La cabra (Capra hircus) doméstica proviene de la domesticación de la cabra bezoar (Capra aegagrus), especie silvestre que habitaba el Asia Central hace más de 10 000 años. La cabra fue una de las primeras especies en ser domesticada y que contribuyó al desarrollo y migración del humano (Zheng et al., 2020). Es una especie que se encuentra distribuida en todos los continentes, estimándose una población cercana a los mil millones, y de ese total, el 58.2 y 36.2% se encuentran en los continentes asiático y africano, respectivamente (Amills et al., 2017).
Las primeras cabras llegaron al Perú con el ingreso de los españoles en 1536 para abastecerlos de carne y leche. Las razas inicialmente introducidas fueron la Granada, Murcia y Málaga. Luego de muchas adaptaciones al sistema de crianza, mestizaje y a las diversas condiciones geográficas del país, se desarrolló el tipo de animal conocido como la «criolla» (Urviola et al., 2016). La población caprina en el país es de 1 814 359, según el último censo agropecuario de 2012, encontrándose principalmente en la costa (68%), mayormente bajo crianza transhumante, mientras que el 31% se distribuye en los valles interandinos de la sierra (INEI, 2012; Urviola et al., 2016).
Las cabras en el Perú, al igual que en otros países, cumplen un importante rol en la vida socio-económica de numerosas familias rurales al proveerles ingresos por la venta de queso, carne y cuero y como fuente de proteínas; sin embargo, su crianza sigue siendo precaria con escasa asistencia técnica y médica (Urviola et al., 2016; Miller y Lu, 2019). No obstante, es una de las especies que está siendo considerada como una alternativa para la crianza moderna y sostenible debido a su rusticidad, adaptabilidad a ambientes áridos y resistencia a enfermedades (Urviola et al., 2016; Miller y Lu, 2019).
Se dispone de escasa información de su situación sanitaria en el país, con excepción de la vigilancia oficial de brucelosis (SENASA, 2019). En estas últimas décadas, la Lengua azul, enfermedad arboviral, está emergiendo como una enfermedad de gran impacto económico al ocasionar severos brotes epizoóticos en rumiantes en áreas geo gráficas donde no hubo reportes previos (Tabachnick, 2004). Lengua azul es una enfermedad de reporte obligatorio ante la Organización Mundial de Sanidad Animal (OMSA), cuya presentación limita el comercio internacional de animales y de sus productos (MacLachlan et al., 2019).
Lengua azul es una enfermedad prevalente en zonas tropicales y subtropicales, donde los animales son infectados por el virus sin que se observe una evidencia clínica (Rivera et al., 2013; Navarro et al., 2019, Jurado et al., 2020). Diversos estudios epidemiológicos sugieren que el calentamiento global es uno de los principales factores que favorece la migración y distribución de vectores hacia altitudes superiores hallando animales susceptibles y ocasionado brotes y pérdidas económicas (MacLachlan y Guthrie, 2010). La mayor población de cabras en el Perú se encuentra en el norte, donde existen factores medioambientales propicios para la presencia de insectos Culicoides. Ante esto, el objetivo del estudio fue determinar la seroprevalencia del virus de Lengua azul (VLA) en cabras de los departamentos del norte del Perú como base para futuros estudios epidemiológicos y moleculares sobre esta enfermedad.
MATERIALES Y MÉTODOS
Muestras
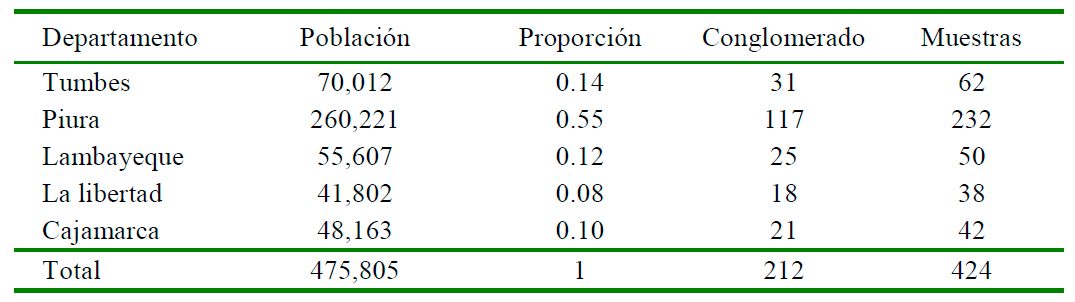
Las muestras de sueros de cabras del estudio fueron obtenidas por el Servicio Nacional de Sanidad Animal (SENASA) entre junio a octubre de 2017 como parte de la vigilancia activa de la brucelosis caprina a nivel nacional. La presente investigación consideró los sueros de cabras de los departamentos de Tumbes, Piura, Lambayeque, La Libertad y Cajamarca, con base a las condiciones ecológicas y climáticas favorables para la presencia del vector y por existir una mayor población de cabras en dichas zonas.
Se consideraron muestras de sueros de cabras (n=424) hembras mayores a seis meses y que no estuvieran en gestación aparente en el momento del muestreo. El tamaño de muestra fue obtenido para un muestreo bietápico con probabilidad proporcional al tamaño de la población de sueros de cabras registrados en el censo agropecuario de 2012. Se usaron las mismas unidades primarias de muestreo (predios) y el mismo número de cabras por predio según el procedimiento descrito por Segura y Honhold (2000), considerando 56% como prevalencia (Jurado et al., 2020), un nivel de confianza de 95% y un error permisible de 5%. El número de sueros a ser muestreado por predio se obtuvo según el procedimiento de Elbers et al. (1995) usando un coeficiente de correlación intraclase de 0.4 (Carvelli et al., 2019). El tamaño de muestra fue corregido por efecto del diseño (Segura y Honhold, 2000) y la distribución de las muestras de suero se indica en el Cuadro 1.
Detección de Anticuerpos
Se utilizó un kit comercial de ELISA de competición (ID.vet, Francia) para la detección de anticuerpos contra el virus de Lengua azul. El kit presenta una sensibilidad de 100% (99.49-100%) y especificidad diagnóstica de 100% (99.84-100%) y fue utilizado siguiendo las indicaciones incluidas en el kit por el fabricante. Se consideró como resultado negativo porcentajes de competición (S/N%) superiores o iguales a 40% y positivo cuando fue inferior al 40%.
Análisis Estadístico
La prevalencia del VLA fue estimada mediante la proporción de animales seropositivos sobre el total de animales muestreados. Se calculó el intervalo de confianza de 95% de la prevalencia de acuerdo con el procedimiento de Wald y se realizó un análisis monovariado de asociación de la prevalencia con la edad de las cabras (≤11, 12 a 24, ≥25 meses) y con la altitud (msnm) de la zona de crianza (<1000, 1001 a 2000, >2001 msnm) usando la prueba del Chi cuadrado de Pearson como estadístico de contraste y un nivel de significancia de 0.05. Para el análisis de los datos se usó el programa Stata 14.0 (Stata Corp, 2015).
RESULTADOS
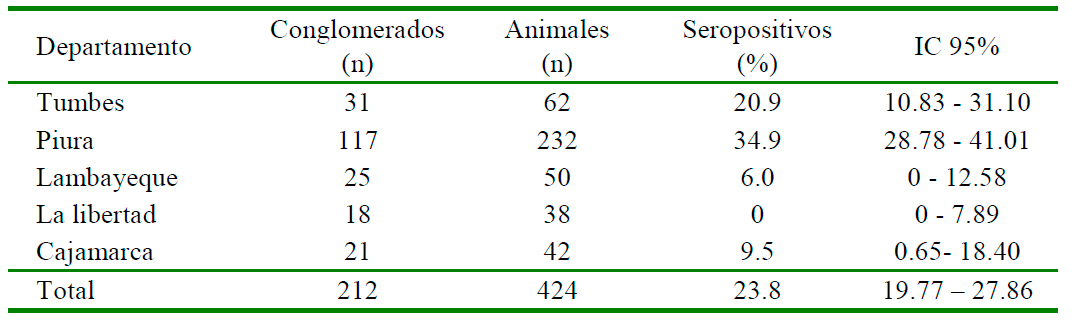
La seroprevalencia global de anticuerpos contra el VLA en cabras en la zona del estudio fue de 23.8% (IC 95%: 19.77 - 27.86%). La mayor prevalencia se observó en las cabras del departamento de Piura 34.9% (81/ 232), seguido Tumbes (20.9%, 13/62), Cajamarca (9.5%, 4/42) y Lambayeque (6%, 3/50). No hubo casos positivos en las cabras de La Libertad (Cuadro 2, Figura 1). En el departamento de Piura, las provincias con mayor seroprevalencia fueron Huancabamba (94%, 15/16), Ayabaca (85%, 34/40), Morropón (50%, 8/16), Piura y Sullana.
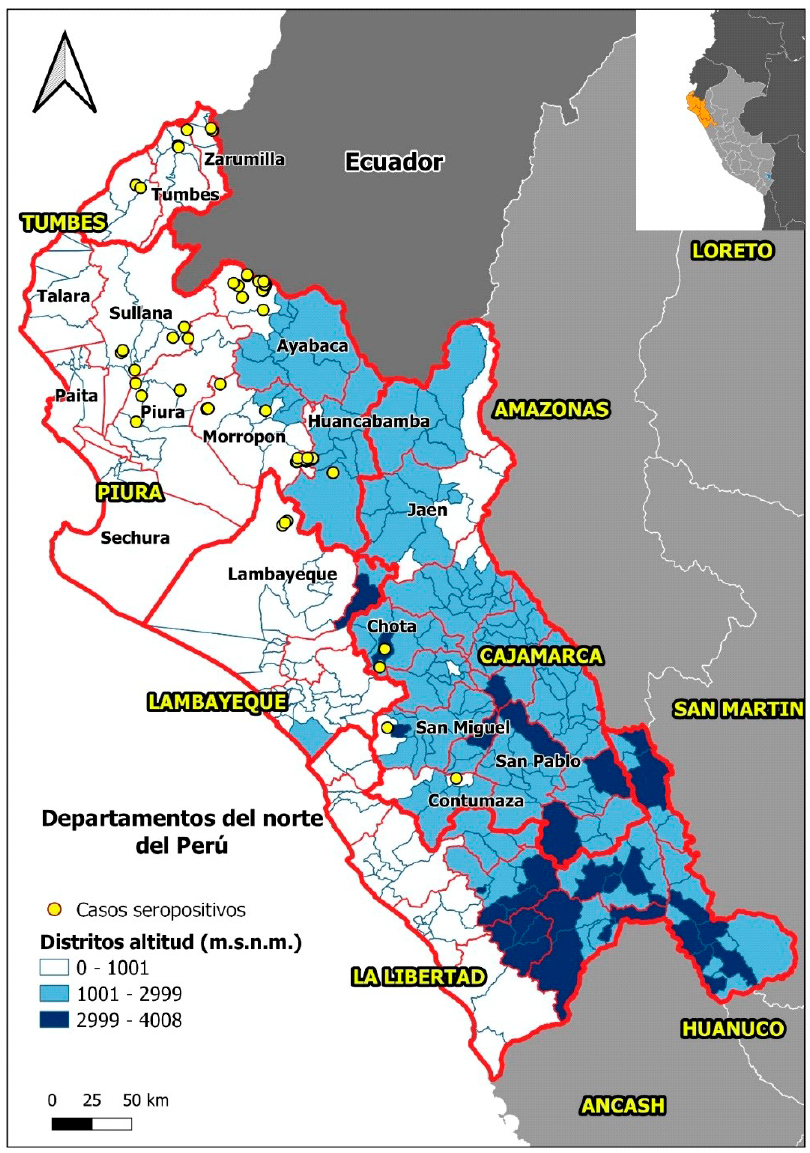
Figura 1 Departamentos del norte del Perú con presencia de cabras seropositivas al virus de Lengua azul (2017)
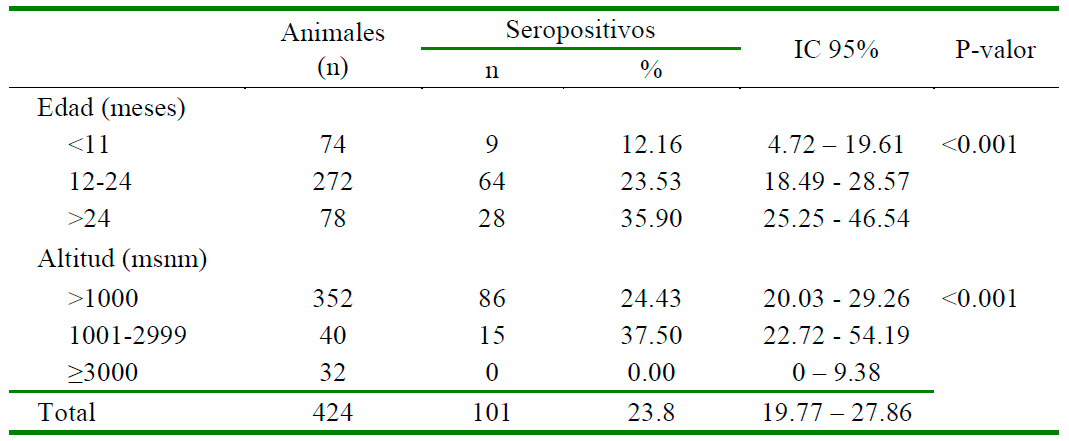
Los seroprevalencias según el grupo etario y la altitud de las zonas de crianza se muestran en el Cuadro 3. Se encontró una asociación significativa (p<0.05) entre seropositividad y grupo etario, siendo que los animales con mayor edad tienden a estar más afectados. Por otro lado, rebaños en alturas superiores a los 3000 msnm fueron negativas al VLA (p<0.05).
DISCUSIÓN
La seroprevalencia global de 23.8% del VLA es alta e importante ya que muestra una amplia difusión del virus en poblaciones de cabras criadas en ecosistemas que van desde zonas áridas con bosques secos, otras con climas templados con abundante vegetación y zonas con temperaturas frías en las vertientes de los Andes. Durante el muestreo, las cabras no presentaron signos clínicos compatibles con Lengua azul indicando que la infección en estas poblaciones de cabras es subclínica.
El VLA es endémico en zonas tropicales y subtropicales, zonas donde se presentan las condiciones bióticas y abióticas que propician la transmisión viral (Purse et al., 2005; MacLachlan, 2011; MacLachlan et al., 2015). Los estudios serológicos de VLA en América Latina no siempre se han asociado con la enfermedad clínica, con la excepción de Brasil, donde se han informado casos clínicos en ovejas, ciervos y cabras (Clavijo et al., 2002; Álvarez-Balaro et al., 2014; Guimarães et al., 2017). Los trabajos citados afirman que la manifestación clínica inusual de la enfermedad puede deberse a factores como la introducción de razas o de otros serotipos patógenos, así como cambios en la humedad, precipitaciones, velocidad del viento y variación de la temperatura, entre otros, debido al calentamiento global y el cambio climático.
Los resultados indican que 34.9% (81/ 232) de las muestras de cabras colectadas en el departamento de Tumbes presentaron anticuerpos contra el VLA seguido de Tumbes (20.9%, 13/62). En el caso del departamento de Piura, las provincias de Ayabaca, Huancabamba y Morropón corresponden a la zona andina de Piura con altitudes que van desde menos de 1000 a más de 3000 msnm, con clima cálido, templado y frío, respectivamente, durante el invierno (INEI, 2012; Figura 1) y donde se concentra la mayor población ganadera y una vegetación ideal para el desarrollo y reproducción de mosquitos vectores de arbovirus (Méndez et al., 2009). Piura, por ser el departamento con mayor población de cabras se muestreó un mayor número de predios (n=117), y esto pudo haber influenciado la mayor positividad encontrada. Por otro lado, las cabras al ser criadas en forma extensiva recorren grandes distancias en busca de pasturas compartiendo el espacio con otras especies de animales (Temoche, 2019).
Las muestras obtenidas en 6 de los 21 predios distribuidos en 18 distritos de Cajamarca presentaron una positividad de 9.5% (4/42) de anticuerpos. Las muestras positivas fueron de cabras criadas en altitudes entre 1291 a >2900 msnm, sugiriendo que la baja prevalencia podría deberse a ciertas condiciones climáticas, épocas del año o poca población de cabras en estas áreas. Resultados similares en cuanto a porcentaje de seropositividad y condiciones ecológicas fueron hallados por Ravishankar et al. (2005) en ovejas y cabras en la región de Karala, India.
Lambayeque es otro departamento donde solo se encontró 6% (3/50) de muestras seropositivas en 2 de los 25 predios muestreados. Las muestras positivas fueron de cabras de los distritos de Olmos y Motupe donde se desarrolla la agricultura en base a irrigaciones. No se dispone de información respecto al historial de los rebaños con animales seropositivos, pero es posible que sean animales introducidos de otras localidades con fines de mejoramiento o resultado de infecciones esporádicas asociadas a cambios climáticos que hicieron posible la incursión de los mosquitos vectores del virus. Por otro lado, en el caso de La Libertad, el mayor porcentaje de la ganadería se desarrolla en forma extensiva y semi-extensiva, entre 2700 a 4000 msnm (INEI, 2012) donde la altitud, la temperatura y el tipo de crianza podrían constituir barreras para los mosquitos vectores del VLA.
La prevalencia global de 23.8% encontrada en este estudio fue inferior al 56% de seropositividad al VLA obtenido por Jurado et al. (2020) en ovinos de pelo en San Ramón (Junín) y 46% por Navarro et al. (2019) en Pucallpa (Ucayali, Perú). El norte peruano, a pesar de su proximidad a la línea ecuatorial, la temperatura y humedad relativa muestran oscilaciones variables que dependen de la época del año, del fenómeno de El Niño y de los fuertes fríos provenientes de la Cordillera de los Andes (MINAGRI, 2015). Estas condiciones contribuirían a una discontinuidad en la presencia del vector, como sugieren Portela et al. (2015). Por otro lado, las condiciones ecológicas en las zonas tropicales son más estables y favorables para la multiplicación y circulación del Culicoides.
Se observó una asociación significativa (p <0.05) entre la prevalencia de VLA con el grupo etario de las cabras y la altitud de crianza, siendo el porcentaje de positivos mayor en las cabras de 25 meses en comparación a los de 11 meses de edad (Cuadro 3). Esta asociación se explica debido a que a mayor edad la probabilidad de ser infectados o reinfectados se incrementa. Lo mismo fue observado por Yavari et al. (2018), donde la seroprevalencia fue mayor en ovinos con edades mayores a 2 años. Por otro lado, Elmahi et al. (2020) encontraron que cabras de 6-11 meses resultaron más susceptibles a la infección por el VLA (93.9%) que las de mayor edad (85.5%). En este caso, una posible explicación podría ser la pérdida temprana de la inmunidad pasiva o el tipo de crianza donde los animales jóvenes son confinados por protección de predadores.
Se encontró una asociación significativa (p<0.05) entre la seropositividad y la altitud de crianza. La mayor parte [37.5 (15/40)] de las cabras seropositivas se encontraron entre 1000 y 2900 msnm; no encontrándose animales infectados por encima de los 3000 msnm (Cuadro 3). No hay información publicada en el país con la cual contrastar estos resultados; sin embargo, datos de otras latitudes parecen confirmar un efecto negativo de la altitud sobre LA. Así, Pioz et al. (2012), usando modelos simultáneos autoregresivos con errores espaciales, encontraron que la altitud, particularmente en los rangos 222 a 358 y 359 a 1915 msnm, afectó negativamente la velocidad de dispersión del VLA serotipo 8 en la epizootia de 2007 en Francia. Los autores atribuyen este resultado a la influencia negativa de la altura sobre la abundancia y actividad del vector. Por su lado, Abera et al. (2018), usando regresión logística múltiple, hallaron OR ajustados de 5.69 y 2.35, estadísticamente significativos, de zonas bajas y medias, respectivamente, comparadas con zonas altas, con respecto a la seroprevalencia de VLA en cabras y ovejas de Etiopía occidental. Un estudio similar realizado en la Llanura Tibetana de China, donde la elevación promedio es de 4000 msnm, con veranos cortos e inviernos largos con temperaturas de 0 °C, y donde los Culicoides son estacionales y su actividad indica en primavera e incrementa en verano, mostró seroprevalencias de 20.3% en ovejas y 17.3% en yaks ( Jian-Gang-Ma et al., 2017).
No se dispone de muchos reportes de seroprevalencia de VLA en cabras en América Latina. En Río de Janeiro, Brasil, se encontró seropositividad de 44% en cabras de apariencia normal (Cunha et al., 1988), en tanto que Portela et al. (2015) encontraron prevalencias de 7.4% en Ecuador, y Gibbs et al. (1983) reportaron entre 40 a 100% en países de la zona del Caribe. En otros países con alta población de cabras como China, Egipto, India, Irán y Sudán, la exposición a VLA varía entre 33 y 100% (Mozaffari et al., 2014; Karam et al., 2018; Elmahi et al., 2020), con variaciones según las regiones (Ravishankar et al., 2005). Ante el inminente calentamiento global, enfermedades emergentes como el arbovirus Lengua azul podrían afectar la salud de los rumiantes criados en zonas interandinas y andinas ocasionando severas pérdidas económicas, por lo que se considera necesario realizar los estudios de serotipificación del virus, así como la vigilancia entomológica de Culicoides spp en el país.
CONCLUSIONES
La seroprevalencia del virus de Lengua azul (VLA) en cabras sin signos clínicos de enfermedad de los departamentos de la Región Norte del Perú fue de 23.8% (CI 95%, 19.77-27.86).
El porcentaje de animales seropositivos fue mayor en las provincias de Huancabamba, Ayabaca y Morropón, Piura.
Las muestras de cabras del departamento de La Libertad fueron seronegativas del VLA.
Se evidenciaron asociaciones significativas entra la prevalencia de anticuerpos contra VLA con la edad de las cabras y con la altitud de las crianzas.












 uBio
uBio