INTRODUCCIÓN
El parvovirus canino tipo 2 (PVC-2) es el agente infeccioso más común en perros con diarrea aguda. El PVC-2 comúnmente infecta a cachorros de 6 semanas a 6 meses de edad; sin embargo, infección en perros adultos ha sido reportada (Decaro et al., 2012; Rolim et al., 2014). Los signos clínicos típicos de la enfermedad son: depresión, pérdida de apetito, vómito, diarrea catarral a sanguinolenta y leucopenia (Decaro et al., 2008a); no obstante, las manifestaciones clínicas de la infección pueden ser altamente variables, debido principalmente a la presencia de títulos de anticuerpos IgG en los perros afectados. Títulos bajos predisponen a una enfermedad más severa, títulos medios previenen la enfermedad, pero no la infección, y títulos altos previenen tanto la infección como la enfermedad (De Cramer et al., 2011; Hernandez-Blanco et al., 2015).
La enfermedad es causada por tres tipos de variantes genéticas del PCV-2 (2a, 2b y 2c), los cuales se encuentran circulando alrededor del mundo (Miranda y Thompson, 2016). El genotipo más reciente es PVC-2c, donde varios estudios han demostrado que este aislado puede evadir la respuesta inmune, afectando perros vacunados, tanto cachorros como adultos (Decaro et al., 2008b; Sutton et al., 2013).
Aunque ha sido reportado que la principal razón para una falla de la vacunación es la interferencia de anticuerpos derivados maternos (ADM), no está del todo claro si las vacunas comerciales, las cuales contienen genotipos distintos al PVC-2c, puedenconferir protección cruzada contra estesubtipo genético (Wilson et al., 2014). En un estudio de campo, Decaro et al. (2008b), identificaron perros infectados por PVC-2c con presencia de signos clínicos y en algunos casos con mortandad. Estos perros habían sido previamente inmunizados con una vacuna conteniendo la variante genética más antigua que es PVC-2. Sin embargo, en otro estudio se demostró, que perros que habían sido vacunados con las variantes 2 y 2b desarrollaron títulos de anticuerpos IgG protectores contra la infección por PVC-2c (Larson y Schultz, 2008).
En este estudio se reporta que perros que habían desarrollado concentraciones altas de títulos de anticuerpos IgG en contra de PVC-2 a través de vacunación y en un caso por previa-infección, no fueron protegidos posteriormente contra la infección de PVC2c y presentaron síntomas de enfermedad aguda.
DESCRIPCIÓN DEL CASO
Se registró un brote de PCV-2 en un criadero de perros de raza Chihuahua, ubicado en la ciudad de Toluca, estado de México. La zona se encuentra a una altitud de 2680 m y presenta un promedio de temperatura ambiental de 15 °C.
Los perros eran rutinariamente vacunados a los 5 meses de edad contra PVC-2. Asimismo, en el criadero se monitoreaba anualmente el estado de inmunización de los perros mediante pruebas de titulación de anticuerpos IgG contra parvovirus canino y otras infecciones virales. En el caso de parvovirus se utilizaba la técnica de inhibición de la hemoaglutinación.
Los rangos de los títulos de anticuerpos IgG que se identificaban en la población de perros fueron de 1:16 hasta 1:4098, mientras que los títulos IgG más frecuentes observados fueron 1:128. Cinco perros, cuyas características se presentan en el Cuadro 1 fueron afectados. En los registros se observó que previo al brote más reciente de infección, los perros A y B habían padecido una infección por parvovirus canino dos años antes a pesar de que habían sido vacunados. Estos dos perros en su último monitoreo de títulos de anticuerpos IgG contra PVC-2 tuvieron 1: 4096 y 1: 1024, respectivamente, mientras que los perros C y D tenían títulos de 1: 2048 en ambos casos; y el perro E tenía títulos de 1: 256. De acuerdo con la literatura, títulos de anticuerpos IgG >1:80 son considerados como protectores contra la enfermedad (Nandi y Kumar, 2010); por lo tanto, se consideró que los cinco perros afectados tenían títulos de anticuerpos IgG protectores contra la enfermedad.
Cuadro 1 Información general de los perros, de las pruebas de PCR y de los resultados de la inhibición de la hemoaglutinación
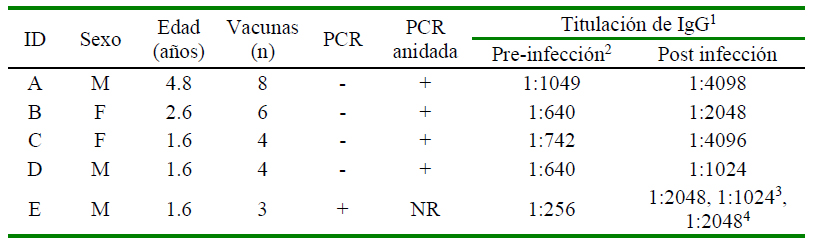
1 Técnica de inhibición de la hemoaglutinación
2 Datos obtenidos de los registros del criadero
3 Títulos de anticuerpos obtenidos en el segundo muestreo realizado tres días después de que se observaron los signos clínicos
4 Títulos de anticuerpos obtenidos en el tercer muestreo realizado cinco días después de que se observaron los signos
NR = no realizada
Los perros A, C y E comenzaron con un cuadro entérico presentando signos clínicos leves de la enfermedad, donde los dos primeros (A y C) mostraron una mejoría a las 48 horas de las primeras manifestaciones clínicas. Los signos clínicos en el perro E, no obstante, se fueron agudizando, e incluyeron vómito, diarrea sanguinolenta, mucosas pálidas, fiebre (40.1 °C), deshidratación, letargia y leucopenia, por lo que fue hospitalizado durante cinco días y recibió terapia de sostén y de fluidos. Al examen coproparasitológico no se identificaron parásitos y los exámenes de bioquímica sanguínea no presentaron cambios significativos. Por otro lado, los perros B y D no presentaron signos clínicos aparentes de la enfermedad, a excepción de una depresión leve.
Se hicieron hisopados rectales en los cinco perros para diagnosticar y caracterizar genéticamente al PVC-2. Las muestras fueron procesadas por la técnica de PCR. Se colectaron muestras de sangre (2 ml) para determinar los títulos de anticuerpos IgG durante la infección mediante la técnica de inhibición de la hemoaglutinación, según Carmichael et al. (1979). Estas muestras fueron tomadas el segundo día cuando los signos clínicos fueron obvios. En el caso del perro E se tomaron muestras adicionales el día tres y cinco.
Previamente se diseñaron los cebadores ParvoInt2FB (5’-TCAAGCAGATGGTGATCCAAG-3’) y ParvoInt2CR (5’-GGTACATTATTTAATGCAGTTA-3’) para amplificar un fragmento de 275 pb del gen VP2. Dicho fragmento se encuentra localizado entre el nucleótido 1107 y el 1382 (GenBank, número de acceso FJ0051962c). Estos cebadores junto con 100 ng de ADN de cada muestra fueron procesadas por PCR punto final utilizando el siguiente protocolo: 2 µl de ambos cebadores a una concentración de 20 µM, 12.5 µl of GoTaq® Green Máster Mix (Promega, USA), el cual contiene la enzima ADN polimerasa y el buffer de reacción (pH 8.5), 400 µM de cada uno de los dinucleótidos dATP, dGTP, dCTP, dTTP, y 1.5 mM de MgCl2 . Asimismo, 28.5 µl de agua libre de nucleasas fueron adicionados para obtener un volumen final de 50 µl. Las condiciones para las reacciones de PCR fueron las siguientes: un ciclo a 94 °C por 5 min, 35 ciclos de 94 °C por 30 s, 52 °C por 1 min, 72 °C por 1 min, y una extensión final a 72 °C por 5 min.
Con este procedimiento solo el perro E fue diagnosticado positivo para PVC-2. Por lo tanto, las muestras negativas fueron reanalizadas mediante un PCR anidado con los siguientes cebadores: ParvoExt1F (5’- ATGAGTGATGGAGCAGTTTCA-3’) y ParvoExt3r (5’AGGTGC-TAGTTGAGATTTTTCATATAC-3’), localizados en los nucleótidos del 1-20 y 1712-1240 del gen VP2 (GenBank, número de acceso FJ0051962c). Dichos iniciadores amplifican un fragmento de 1740 pb. Una vez realizada la amplificación, 1 µl de la reacción de amplificación fue utilizado como templado de ADN para realizar el proceso de amplificación anidada utilizando las condiciones de PCR descritas previamente para el PCR de punto final. Los amplificados de todas las muestras se observan en la Figura 1.
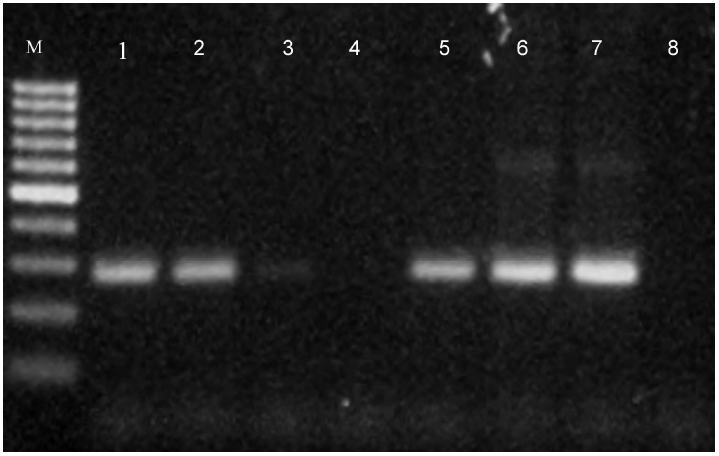
Figura 1 Electroforesis de las pruebas de PCR. M= Marcador de peso molecular. Las columnas 1, 2, 3, 5 y 6 pertenecen a las amplificaciones de los perros D, B, A, C y E, respectivamente. La columna 7 es el control positivo y las columnas 4 y 8 son los controles negativos
Los fragmentos amplificados de cada muestra fueron utilizados para realizar la genotipificación de los virus, utilizando la secuenciación de Sanger como se ha descrito en Gamiz et al. (2011) para genotipificar otros virus que afectan a los perros. Las secuencias obtenidas fueron editadas eliminando los nucleótidos reportados de los extremos, debido a que se observaban inconsistencias. Un fragmento de 250 pb sin ningún tipo de inconsistencia a su lectura fue obtenido, y fue comparado con las secuencias disponibles en el GenBank para determinar su similitud con secuencias de diferentes variantes de PVC2. En todos los casos la secuencia obtenida tuvo alta similitud con secuencias reportadas para PVC-2c (Figura 2).

Figura 2 Alineación de los 230 nucleótidos secuenciados que pertenecen a un fragmento del gen VP2 de las muestras del parvovirus canino. La secuencia obtenida en este trabajo (PVC-2c Edomex) fue comparada con secuencias reportadas en el GenBank: KT162021.1 (CPV-2), KT162028.1 (CPV-2a), KT162046.1 (CPV-2b) y KF539790.1 (CPV-2c). Los nucleótidos remarcados en rojo representan las etiquetas que permiten la genotipificación de las variantes del PVC-2
DISCUSIÓN
El perro E presentó signos clínicos de enfermedad aguda de PVC-2, y fue identificado como positivo por PCR punto final, mientras que las muestras de los otros cuatro perros con signos leves de la enfermedad solo resultaron positivas cuando se procesaron por PCR anidada, probablemente debido a que las muestras obtenidas tenían una menor carga viral que la muestra del perro E. Estos resultados pueden asociarse a diversos reportes que han sugerido que la severidad de la enfermedad está relacionada a los títulos de anticuerpos IgG contra PVC-2 presentes en los perros afectados (Riedl et al., 2015). Sin embargo, esto es controversial, debido a que algunos autores han reportado que perros con títulos 1:320 presentan signos leves de la enfermedad, mientras que otros estudios reportan que títulos 1:64 son totalmente protectores contra la infección y la enfermedad (Elia et al., 2005; De Cramer et al., 2011).
Aunque la literatura es clara con respecto al papel interferente que juegan los anticuerpos derivados maternos (ADM) durante la vacunación, no se dispone de datos precisos sobre los títulos necesarios para favorecer dicha interferencia. Elia et al. (2005) sugieren, no obstante, que títulos >1:10 hasta >1:80 son interferentes con la vacunación.
La concentración de títulos de anticuerpos IgG contra PVC-2 se encontraban en valores protectores, antes y durante la infección en los cinco perros (Cuadro 1). En el criadero, los perros fueron vacunados a los 5 meses de edad, por lo tanto los ADM no pudieron interferir con respuesta a la vacunación, y más bien habían desarrollado títulos de anticuerpos IgG protectores contra PVC-2.
Este hallazgo indica que perros vacunados o que anteriormente han estado infectados con cepas de campo, y a pesar de que puedan desarrollar títulos de anticuerpos IgG protectores, son susceptibles a infectarse o re-infectarse por PVC-2, rompiendo con el paradigma que indica la literatura «perros que han sido previamente infectados con cepas de campo desarrollan títulos de anticuerpos protectores suficientes para considerarse protegidos de por vida, por lo que se considera que la reinfección en PVC-2 no es posible» (Lechner et al., 2010).
Dada la evolución de PVC-2 y a múltiples variantes existentes como 2, 2a, 2b, y 2c (Miranda y Thompson, 2016); es probable que los títulos protectores de anticuerpos IgG que se desarrollan ya sea por vacunación o por previas infecciones no sean capaces de prevenir futuras infecciones como en el caso de estos cinco perros reportados, en los cuales fue identificado por genotipificación que fueron infectados por PVC-2c. Otros estudios han indicado que probablemente esta variante puede evadir la respuesta inmune adquirida por la vacunación con otras variantes de PVC-2 (Decaro y Buonavoglia, 2012).
Estos hallazgos son sumamente relevantes tanto para los clínicos de perros como para los dueños, debido a que el principal método de control de la enfermedad es la vacunación (Decaro y Buonavoglia, 2012). No obstante a que en México se ha reportado que la principal variante de PVC es la 2c, no existen vacunas comerciales disponibles con esta genovariante (Faz et al., 2019). Un estudio realizado por Wilson et al. (2014), sugiere que las vacunas desarrolladas con las variantes 2b inducen reacción inmunogénica cruzada contra PCV-2, PCV-2a y PCV-2c en cachorros; sin embargo, Decaro et al. (2008b) indica que las vacunas existentes no inducen reacción cruzada inmunogénica contra CPV2c. Si bien es posible que las vacunas no protejan totalmente a los perros contra PVC-2c, se reporta que la vacunación puede ayudar a disminuir la severidad de la enfermedad (Decaro et al., 2005; Elia et al., 2005). Sin embargo, es probable que la concentración de los títulos de anticuerpos IgG no esté relacionada específicamente a la severidad de la enfermedad producida por la infección con PVC-2c, como pudo observarse en este estudio, donde el perro E presentaba títulos de anticuerpos de 1:256 previo a la infección y sin embargo desarrolló signos clínicos severos de la enfermedad.
El presente reporte demuestra que perros con títulos de anticuerpos IgG protectores contra PVC-2 desarrollados ya sea por vacunación o por infecciones previas, no fueron protegidos contra la infección de PVC2c, y que ellos pueden presentar cuadros clínicos leves a severos de la enfermedad. Sin embargo, es necesario realizar estudios para entender las posibles razones, así como estudios para determinar si las vacunas desarrolladas con las variantes 2, 2a y 2b protegen contra las diferentes sub-variantes del genotipo 2c que están circulando en México. Esto podría ayudar a determinar si es necesario el desarrollo de vacunas que contengan las diferentes variantes genéticas de PVC-2.












 uBio
uBio 


