INTRODUCCIÓN
Los equinos en pastoreo consumen forraje entre 12 a 16 horas del día, en periodos alternosde2 a 3 horas (Venable et al., 2017). El consumo de forraje se restringe en confinamiento, por tanto, se suplementa con alimentos concentrados para suplir las demandas energéticas y nutritivas (Martínez, 2008). Tradicionalmente, los concentrados son elaborados con altos porcentajes de cereales, como el maíz y la cebada (Garg et al., 2004), a pesar de la existencia de otras fuentes alternativas que ofrece el trópico y que pueden reducir los costos de producción, como son los subproductos agroindustriales, que actualmente se han venido incorporando a los alimentos balanceados para animales ante el elevado costo de los cereales (Arrieta et al., 2007; Sohail et al., 2017).
Diversos estudios han demostrado efectos terapéuticos del arroz y sus subproductos como el salvado o el arroz integral (Ling et al., 2001; Xia et al., 2003). Adicionalmente, el arroz blanco o pulido contiene carbohidratos, trazas de yodo, hierro, magnesio, fósforo y cantidades pequeñas de proteínas y grasas, en tanto que el arroz con cáscara contiene los ácidos palmítico, oleico, linoleico y en menor cantidad ácidos esteárico y linolénico (Kim et al., 2012). De forma similar, el salvado de arroz posee el máximo contenido de energía, proteína, vitaminas del complejo B, vitamina E (α-tocoferol y tocotrienol), γ-orizanol, γ-ácido aminobutírico (GABA), vitamina K, fósforo, además de ácido glutámico y aspártico, y aminoácidos neurotransmisores (FAO, 2018). Martínez et al. (2007), asimismo, reportó que el exceso del aminoácido glutámico interviene en la secreción de la hormona liberadora de gonadotropina (GnRH), estimulando la liberación de LH y FSH. Igualmente, el ácido aspártico como neurotransmisor del sistema nervioso participa en la liberación de GnRH, LH y hormona del crecimiento (Foster et al., 2016).
La información científica del empleo de subproductos del arroz en la dieta equina es relativamente escasa. Los estudios en caballos se han realizado sobre el efecto de las enfermedades endocrinas y la respuesta metabólica a la restricción o exceso de los alimentos (McManus y Fitzgerald, 2000; García et al., 2013; Burns, 2016). Adicionalmente, se han utilizado aceites de arroz y maíz en dietas de equinos para evaluar los efectos anti-ulcerogénicos en el estómago (Cargile et al., 2004; Frank et al., 2005; Martínez et al., 2016). En este aspecto, Canibal et al. (2008) en ponis suplementados con aceite de arroz registraron un aumento del crecimiento del folículo pre-ovulatorio.
Este estudio tuvo como objetivo determinar el coeficiente de digestibilidad aparente del heno Angleton (Dichanthium aristatum) y de un concentrado elaborado con subproductos de arroz, y su impacto sobre el crecimiento del folículo preovulatorio y concentración de analitos sanguíneos como colesterol total (CT), triglicéridos (TG), glucosa (Glu), progesterona (P4), estradiol (E2), hormona folículo estimulante (FSH) y hormona luteinizante (LH).
MATERIALES Y MÉTODOS
Para el manejo y sujeción de los animales se cumplió con la Declaración Universal de los Derechos de los Animales del Council for International Organizations of Medical Sciences (CIOMS), de la Organización Mundial de la Salud (OMS), de la United Nations Educational, Scientific and Cultural Organization (UNESCO) y el Estatuto Colombiano de Protección Animal, ley 84 de octubre 27 de 1989 (MADR, 2014). Los animales no fueron sometidos a padecimientos innecesarios durante la manipulación en la colecta de las muestras o el estudio ecográfico transrectal.
El trabajo fue desarrollado en una región intertropical de Colombia (4°15' N y 75°30´ O), a 1285 msnm, con clima clasificado como Ecuatorial o Tropical Húmedo (AF), según el sistema Köppen-Geiger. La zona presenta una temperatura promedio máxima de 28 °C y mínima 18 °C, y precipitación pluvial promedio de 2860 mm. La zona del estudio se encuentra cercana a una extensa región agrícola destinada al cultivo de arroz a nivel industrial.
Animales
Un grupo de siete (7) yeguas criollas colombianas, adultas, edad 5±1 años, peso promedio 320±15 kg, condición corporal 4/9 (Henneke, 1983), multíparas, no gestantes, clínicamente sanas y sin historial de problemas reproductivos, fueron seleccionadas por conveniencia. Todas las yeguas fueron desparasitadas con ivermectina vía oral y estabuladas para la fase experimental. La dieta fue a base de heno de gramínea y concentrado a base de subproductos de arroz, suplemento mineral y agua potable a voluntad.
Dietas
La fase experimental estuvo constituida por dos periodos, cada uno con 75 días de duración. En cada periodo fue evaluada una dieta experimental sobre el mismo grupo de animales. Se estableció un intervalo de 15 días entre periodos experimentales para eliminar el efecto residual entre tratamientos (Pearson et al., 2001). En el tratamiento 1 (T1), la dieta estuvo constituida exclusivamente por heno de Angleton (Dichanthium aristatum) ofrecido a voluntad; en el tratamiento 2 (T2), los animales fueron alimentados con heno de Angleton a voluntad y un suplemento concentrado elaborado con subproductos de arroz, con un periodo previo de cinco (5) días de adaptación a la nueva dieta, conforme lo recomendado por Quadros et al. (2004). La cantidad diaria de suplemento concentrado ofrecido correspondió al 1% del peso corporal, el cual fue dividido en dos raciones iguales que se distribuyeron en el comedero de cada animal a las 08:00 y 15:00 h. Los ingredientes del suplemento y la composición química del heno y el suplemento se describen en el Cuadro 1.
Cuadro 1 Ingredientes y composición química del heno de Angleton (Dichanthium aristatum) y del suplemento concentrado a base del subproducto del arroz
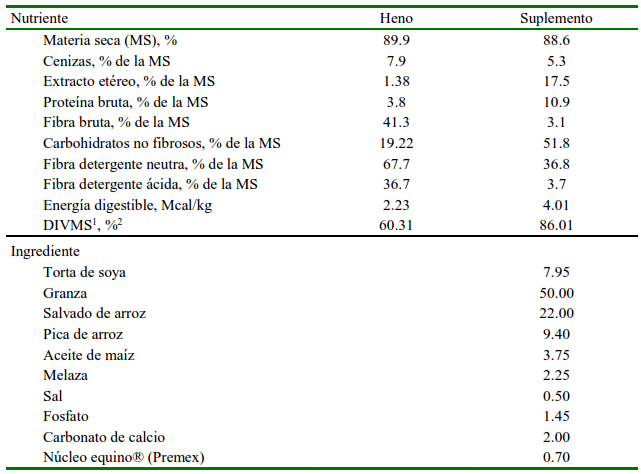
1 DIVMS = digestibilidad in vitro de la materia seca
La cantidad de alimento ofrecido y rechazado por cada animal fue registrada diariamente para determinar por diferencia la cantidad de alimento consumido. Muestras semanales del alimento ofrecido y rechazado por animal fueron colectadas y almacenadas a -10 ºC para cada periodo experimental. Al final del ensayo, las muestras fueron analizadas para determinar los contenidos de materia seca (MS) (AOAC 930.15), proteína cruda (PC) (AOAC 984.13), fibra cruda (FC) (AOAC 978.10), extracto etéreo (EE) (AOAC 930.09) y cenizas (CNZ) (AOAC 942.05). Las concentraciones de fibra detergente neutra (FDN) y fibra detergente ácido (FDA) fueron analizadas según lo descrito por Van Soest et al. (1991). La cantidad de carbohidratos no fibrosos (CNF) fue determinada por diferencia (100-[%FDN+%PC+%EE+%CNZ]).
Folículo Preovulatorio
Se realizaron aproximaciones con un macho entero con el fin de inducir y observar la manifestación de estro, considerándose el día 0 el inicio de este. Se hizo el seguimiento ultrasonográfico diario (Aquila Vet(r), modo B, transductor lineal 6MHz) con un transductor transrectal, midiendo el diámetro inicial y final (mm) del folículo preovulatorio, así como el número de días de crecimiento y crecimiento diario hasta la ovulación. Se valoraron un total de 28 fases de celo; es decir, cuatro (4) ovulaciones por yegua durante los periodos de evaluación de las dietas experimentales (T1 y T2).
Laboratorio Clínico
Desde el día 0 (inicio del estro) hasta la ovulación en T1 y T2 se tomaron muestras diarias (entre 06:00 a 07:00). de sangre por punción de la vena yugular. Las muestras fueron centrifugadas por 15 min a 3000 rpm, para colectar el suero y almacenarse a -20 °C. Se determinó Glu, CT y TG a través de un analizador fotométrico de química sanguínea (Rayto RT-1904CV(r)).
Adicionalmente, se determinaron los niveles de FSH, LH, E2 y P4 a través de kits de ELISA comercial (AccuBind(r), Monobind Inc.), con previa validación y determinación de valores para uso en yeguas. Las placas de ELISA fueron analizadas sobre un lector convencional de longitud de onda de 405-630 nm (Chromate(r) 4300, Awareness Technology, USA). El test de ELISA tuvo una sensibilidad y un coeficiente de variación intra e inter-ensayo de 0.006 mUl/ml, 3.8% y 8.4% para FSH; 0.003 mUl/ml, 3.9% y 10.8% para LH; 8.2 pg/ml, 8.5% y 3.8% para E2 y 0.105 ng/ml, 3.8%, 7.5% para P4.
Coeficiente de Digestibilidad Aparente
Muestras de heces (200 g) fueron colectadas del recto de cada yegua, dos (2) veces al día durante cinco (5) días en la última semana de cada periodo experimental, iniciando el primer día a las 8:00 y 13:00 h, el segundo a las 9:00 y 14:00 h, así sucesivamente hasta el último día con colecta a las 12:00 y 17:00 h, para disminuir el efecto de la variación diurna (Soncin et al., 2009). Las muestras de cada animal se mezclaron y se tomó una alícuota correspondiente al 10% del peso de la muestra compuesta. Cada alícuota se almacenó en bolsa plástica debidamente rotulada e identificada y se almacenó a 10 ºC.
Las muestras fueron descongeladas a temperatura ambiente y homogenizadas para determinar el contenido de MS, PB, EE, FB, CNF, FDN y FDN. El coeficiente de digestibilidad aparente (CDA) fue determinado por el método indirecto, usando como indicador interno las cenizas insolubles en ácido clorhídrico (CIA) (Soto y Rojas, 2016). Una vez obtenido el porcentaje de cenizas ácido insoluble de las dietas y de la materia fecal, se determinó la digestibilidad aparente expresada en forma porcentual (Soto y Rojas, 2016) según la fórmula siguiente:
Análisis Estadístico
El diseño experimental estuvo constituido por siete (7) repeticiones por tratamiento durante cuatro (4) ciclos de celo por yegua. Las medias de las variables de digestibilidad y parámetros reproductivos fueron analizadas bajo un diseño de sobre cambio (chageover) de acuerdo con el siguiente modelo matemático: Yijkl = µ + τi + SUBj + εij i=1, ....a; j=q, ..., n, donde Yij = observación en el sujeto (animal)j con el tratamiento i, m = Media general, τi = Efecto fijo del tratamiento i, SUBj = efecto aleatorio del sujeto (animal)j con media cero y varianza σ2 s, ε ij = error aleatorio con media 0 y varianza σ2 , a = número de tratamientos; n = número de sujetos.
Los análisis estadísticos se realizaron usando el programa Statystical Analisys System (SAS v. 9.4 para Windows) y las medias de tratamientos se compararon considerando un nivel de significancia del 5%.
RESULTADOS
El consumo de materia seca y los coeficientes de digestibilidad aparente de las variables MS, PB, EE, FB, CNF, FDN, FDA del heno Angleton suministrado ad libitum (T1) y del concentrado elaborado con subproductos del arroz (T2) se presentan en el Cuadro 2. El suplemento a base de subproductos de arroz permitió un incremento significativo en el consumo de materia seca y en la digestibilidad de la PB, EE, FB y FDA. Los coeficientes de digestibilidad de la MS y la FDN fueron equivalentes entre las dietas experimentales.
Cuadro 2 Consumo de materia seca (CMS) y digestibilidad aparente de las dietas experimentales ofrecidas a yeguas

a,b Letras diferentes en una misma línea indican diferencia estadística significativa (p<0.05)
Los valores del seguimiento folicular por ultrasonografía, descritas en las variables días de crecimiento del folículo pre-ovulatorio (DCFP) (día cero o inicio de la manifestación del estro hasta la ovulación), diámetro inicial del folículo dominante (DIFP), diámetro final del folículo ovulatorio (DFFO), crecimiento diario del folículo pre-ovulatorio (CDFP) y analitos metabólicos y hormonales sanguíneos de las yeguas criollas colombianas que consumieron ambas dietas (T1 y T2) se presentan en el Cuadro 3.
Cuadro 3 Variables determinadas en el seguimiento ultrasonográfico de los folículos preovulatorios y analitos sanguíneos de las yeguas criollas colombianas sometidas dos dietas
| Heno de Angleton (T1) | Heno de Angleton + concentrado (T2) | Valor referencial1 | |
|---|---|---|---|
| Días crecimiento folículo preovulatorio (DCFP) | 4.3 ± 0.67a | 3.8 ± 0.44b | |
| Diámetro (mm) inicial folículo preovulatorio (DIFP) | 28.5 ± 3.01a | 35.9 ± 1.33b | |
| Diámetro (mm) final folículo ovulatorio (DFFO) | 37.3 ± 2.0a | 43.6 ± 1.34b | |
| Crecimiento diario (mm) folículo preovulatorio (CDFP) | 2.7 ± 0.52a | 2.8 ± 0.37b | |
| Analitos | |||
| Colesterol total, mg/dl | 97 ± 8.54 a | 102 ± 6.08 a | 70-142 |
| Triglicéridos, mg/dl | 5.3 ± 7.9 a | 5.6 ± 16.09 a | 25.69 ± 10.62 |
| Glucosa, mg/dl | 83 ± 6.81 a | 79 ± 4.04 a | 62.2-114 |
| FSH, mUI/ml | 0.10 ± 0.15 a | 0.24 ± 0.37b | No reporta |
| LH, mUI/ml | 0.14 ± 0.14a | 0.40 ± 0.18b | No reporta |
| Progesterona, ng/ml | 0.87 ± 0.77a | 0.79 ± 0.5b | 0.25 ± 0.3 |
| Estradiol, ng/ml | 67.71 ± 23.99a | 78.89 ± 4.26b | 52.25 ± 18.24 |
a,b Letras diferentes en la fila muestran diferencias significativas (p<0.05)
La dieta T2 presentó mejores resultados (p<0.05) en todas las variables consideradas en el seguimiento ultrasonográfico (Cuadro 2). Los folículos fueron de mayor tamaño y requirieron menos días para alcanzar la ovulación al presentar una tasa de crecimiento diario más elevada. Los analitos metabólicos no mostraron diferencias entre tratamientos, pero en el caso de los analitos hormonales los valores en T2 fueron significativamente mayores, a excepción de P4.
DISCUSIÓN
El estado energético de la yegua es fundamental para asegurar el éxito reproductivo. La dieta que incluyó suplemento a base de arroz permitió un mayor consumo de materia seca y, por consiguiente, un mayor consumo de energía. Según Kubiak et al. (1987), las yeguas que llegan a la temporada de reproducción con una condición corporal optima (5-7) comienzan a ser servidas antes que las yeguas con una condición corporal baja (menos de 5). El mayor aporte de lípidos (Cuadro 1) contribuyó a mejorar la palatabilidad de la dieta y consecuentemente el consumo de materia seca (Cuadro 2).
La mayor digestibilidad del EE es evidencia de un mayor aporte energético de la dieta T2. De acuerdo con Kubiak et al. (1987), dietas con alta energía acortan el intervalo hasta la primera ovulación en yeguas delgadas en comparación con aquellas yeguas que consumen una dieta baja en energía. Los mayores coeficientes de digestibilidad de la dieta T2 es un indicativo de mayores tasas de digestión enzimática y microbiana a nivel cecal. De acuerdo con Richardson y Murray (2016), la fermentación cecal puede proveer hasta el 30% del requerimiento diario de energía en los equinos a través de la producción de ácidos grasos volátiles.
El T1 aportó una limitada cantidad de proteína (3.8%) y una alta proporción de FDN (67.7%). Altos contenidos de carbohidratos estructurales son asociados a menores tasas de consumo, baja digestibilidad y menor aporte energético (Van Soest et al., 1991). De acuerdo con el NRC (2007), las dietas para yeguas reproductoras deben aportar entre 8 a 10% de PB. La dieta T1 estuvo indudablemente por debajo del nivel proteico requerido, pero al parecer no afectó su desempeño reproductivo pues el peso y la condición corporal fue similar al final del tratamiento y permitió hacer el seguimiento folicular.
El coeficiente de digestibilidad aparente de MS y EE en T2 fue menor a estudios realizados por García et al. (2013) y Arrieta et al. (2007) al adicionar aceite del salvado y pica de arroz al concentrado, respectivamente. Sin embargo, el coeficiente de FB, FDN, FDA fue mayor comparado a esos trabajos, aunque con algunas diferencias para el coeficiente de la PB. Por tanto, se podría considerar que en T2 se presentó un efecto asociativo de componentes nutricionales, ya que el heno Angleton aportó mayor porcentaje de FB, FDN, FDA y el concentrado un importante porcentaje de PB, EE, CNF, reflejándose en un aceptable e incrementado coeficiente de digestibilidad aparente los componentes de la dieta.
El concentrado con subproductos del arroz mejoró la digestibilidad del heno como si se tratara de un efecto enriquecedor y la PB incrementó su asimilación debido a que la proteína del arroz y su salvado es altamente digestible y fuente de ácidos grasos esenciales (Han et al., 2015). La literatura menciona la incorporación de otros subproductos en la suplementación de los equinos, como la harina de linaza cuya composición química presenta MS (88%), PB (16%), FDN (24%), FDA (8%) y la canola con MS (90%), PB (13%), FDN (13%), FDA (4%) (Oliveira et al., 2001; Soncin et al., 2009). Sin embargo, el uso de los subproductos de arroz en este estudio se empleó por la disponibilidad de la materia prima, al ser una región bioclimatológica óptima para el cultivo de este cereal.
Otros estudios sobre la suplementación de yeguas para optimizar parámetros reproductivos han utilizado varios subproductos derivados del arroz y de otros cereales. Así, Canibal et al. (2008) agregaron aceite de arroz a ponis, reportando un DFFO 34.2 ± 3.4 mm. Igualmente, Soncin et al. (2009) suplementaron yeguas con semillas de linaza integral, encontrando 7.4 ± 1.5 días de duración del estro y un DFFO de 39.2 ± 2.7 mm. Por otro lado, Amal et al. (2013) observaron folículos con diámetro de 34.9 ± 0.13 mm al adicionar una fuente de minerales a la dieta, en tanto que Kelley et al. (2014) añadiendo lisina, notaron un DIFP de 30.2 ± 1.2 mm en las yeguas jóvenes y de 26.3 ± 1.3 mm en las adultas. Los valores del DIFP, DFFO, CDFP obtenidos con la dieta T2 fueron mejores a los valores reportados, y además se evidenció una disminución en DCFP.
Las evidencias indicaron que los valores de FSH y HL en T2 alcanzaron niveles que superaron el doble de los obtenidos en T1. Asimismo, el colesterol sérico se mantuvo elevado dentro de los niveles de referencia en ambos tratamientos, ratificando su papel de precursor hormonal de E2 y P4.
CONCLUSIÓN
La suplementación con concentrado a base de subproductos de arroz a yeguas criollas colombianas estabuladas incrementó el diámetro y la tasa de crecimiento del folículo preovulatorio, además de mejorar la digestibilidad aparente de la ración fibrosa de la dieta, en comparación con una dieta de solo heno, constituyéndose como una alternativa en la formulación para dietas equinas.












 uBio
uBio 



