INTRODUCCIÓN
El pez "Paco" (Piaractus brachypomus) es una especie rústica de crecimiento rápido, buena calidad de carne y aceptada en el mercado, por lo que es considerada una especie potencialmente productiva (Mesa-Grande y Botero-Aguirre, 2007). La diversidad genética en las granjas acuícolas destinadas a la producción de alevinos ha disminuido, obligando a establecer protocolos de criopreservación de semen para intercambio y aprovechamiento de material genético entre productores (Fresneda et al., 2004; Suarez et al., 2019). En este sentido, la caracterización de los parámetros seminales (López-Hernández et al., 2018) permite seleccionar donadores de gametos para la criopreservación y reproducción fuera de su estación reproductiva (Cruz Casallas et al., 2006b).
Se tiene el interés de aumentar la producción del pez paco; sin embargo, su reproducción estacional impide disponer alevinos durante todo el año (Criscuolo-Urbinati et al., 2012). Su reproducción en cautiverio es difícil, siendo necesario utilizar hormonas para el desove de las hembras y la obtención de esperma en machos (Chaves-Moreno et al., 2011) a fin de obtener embriones en incubadoras hasta la fase de alevinos.
La criopreservación de semen en peces es importante en la acuicultura para la conservación genética de especies productivas en vías de extinción, para la reserva seminal en épocas no reproductivas y para el intercambio genético (Carolsfeld et al., 2003; Nascimento et al., 2010; Ramírez-Merlano et al., 2010; Pineda-Santis et al., 2015; Restrepo-Betancur et al., 2017). Por otro lado, la fertilidad pos-descongelación es baja con respecto al semen fresco, siendo necesario el desarrollo de protocolos de congelación-descongelación (Navarro et al., 2004; Cruz-Casallas et al., 2006a) que eviten el daño a nivel celular por la formación de cristales intra y extracelulares, mediante el uso de aditivos como los antioxidantes (Rodríguez y Nivia, 2017).
La yema de huevo ha sido utilizada como diluyente de semen en la criopreservación de semen (Trimeche et al., 1997; Bathgate et al., 2006; Kulaksýz et al., 2010; Belala et al., 2016; Anzar et al., 2019; Torres et al., 2022) por su acción protectora no permeable, al formar una película protectora en la superficie de la membrana del espermatozoide (Quinn et al., 1980) por las lipoproteínas de baja densidad (LDL) (Bergeron y Puttaswamy, 2006; Qiao-Xiang et al., 2011), así como por el contenido de colesterol (Müller et al., 2008) que estabilizan o previenen el daño en la membrana espermática (Cabrita et al., 1998). Es decir, la yema de huevo es indispensable en la congelación de semen en peces (Rusco et al., 2019), pero con efectos variables en semen dependiendo de la especie (Babiak et al., 2001; Chauhan y Anand, 1990; Lahnsteiner et al., 2000; Maria et al., 2006; Jodun et al., 2007; Ramirez-Merlano et al., 2011; Yildiz et al., 2013). Con estos antecedentes, el objetivo del estudio fue determinar el efecto de la yema de los huevos de gallina y codorniz como diluyente sobre la calidad de semen de paco (Piaractus brachypomus) pos-descongelación.
MATERIALES Y MÉTODOS
Animales Experimentales
El estudio se realizó en el Instituto de Investigación de la Amazonia Peruana (IIAP), localizado en el distrito de Tambopata, provincia de Tambopata, Región de Madre de Dios, a una altitud de 139 msnm. Se utilizaron 15 pacos (Piaractus brachypomus) machos distribuidos en tres grupos (control, yema de huevo de gallina y yema de huevo de codorniz, cada grupo con cinco peces). Los peces tenían un peso de 3.7 ± 0.51 kg, se encontraban sexualmente maduros y con liberación seminal de la papila urogenital al masaje de la región ventral. Además, se tuvo tres hembras donadoras de ovocitos. El experimento tuvo una duración de 30 días y los peces fueron mantenidos en piletas de cemento durante 24 horas y en ayunas, antes de la aplicación de la hormona. Se hizo recambio de agua diariamente y en ayunas.
Colecta de Gametos
Se administró 2.5 mg/kg de extracto de hipófisis de carpa (EHC) (Chemical Laboratories, USA) diluido con suero fisiológico divididos en dos fracciones de 50% y aplicadas a nivel de la aleta pectoral de los machos con un intervalo de 12 horas. Previo a la colecta, se cubrió la cabeza de los peces con una toalla húmeda y se retiró el exceso de agua de la zona ventral alrededor del poro genital y con un masaje ventro-craneal se procedió a la colecta de semen en tubos Falcon de 15 ml.
Las hembras fueron inducidas con EHC a una dosis de 5 mg/kg peso vivo. En la primera dosis se aplicó el 10% y luego de 12 horas el 90% restante a nivel de la aleta pectoral. El desove se realizó entre 6 a 8 horas de la segunda dosis a través de un masaje ventro-craneal (Fresneda et al., 2004).
Calidad Seminal
El semen colectado se mantuvo a la temperatura del agua del estanque (28 °C) durante la evaluación, sin exceder los 30 minutos. Se determinó el volumen y color de manera subjetiva, descartando las muestras contaminadas con heces o activadas con orina o agua del estanque.
Las características microscópicas evaluadas (Fresneda et al., 2004; Cruz-Casallas et al., 2006a) fueron:
Motilidad masal, estimada subjetivamente con un microscopio a 10X previa activación seminal con la solución activadora (agua destilada con bicarbonato de sodio al 1%) en una proporción de 20 µl de semen con 180 µl de solución activadora.
Tiempo de activación. Fue calculado inmediatamente al contacto con la solución activadora en una proporción de 20 µl de semen con 180 µl de solución activadora. Fue expresado en minutos hasta el cese del 100% de movimiento.
Concentración espermática. Fue calculada en la cámara de Neubauer con una dilución de 1:200 con NaCl 0.9%, expresado en 109/ml.
Vitalidad. Fue realizada mediante la tinción Eosina-Nigrosina, considerándose los espermatozoides coloreados como muertos y los no coloreados como vivos. Se expresó en porcentaje.
Crioprotectores y Congelación
En la solución crioprotectora con yema de huevo de gallina se utilizó 5% de Dimetilsulfoxido (DMSO), 5.5% de glucosa y 15% de yema de huevo de gallina llevado a 100 ml de agua destilada (Fresneda et al., 2004). La yema de huevo de gallina fue reemplazada por yema de huevo de codorniz en la segunda solución. El semen fue diluido en 1:4 (semen: dilutor). Para el semen fresco se usó solamente la solución activadora en el momento de la fertilización.
La temperatura del semen colectado fue bajada desde 28 °C hasta 4 °C, momento en que se mezcló con las soluciones crioprotectoras con un tiempo de equilibrio de 30 minutos. El semen diluido fue envasado en pajillas de 0.5 ml y selladas con ácido polivinílico. La congelación se realizó con vapores de nitrógeno a 5 cm sobre el nivel del nitrógeno líquido por 15 minutos e inmersión directa de las pajillas en el nitrógeno líquido (Navarro et al., 2004). Se tomó en consideración las muestras de semen con motilidades mayores a 80%.
Fertilidad
Las pajillas fueron descongeladas a 37 °C por 30 s. La pajilla de 0.5 ml fue colocado sobre 4 g de ovocitos por repetición. Los ovocitos estuvieron secos para evitar la activación seminal antes de la aplicación de la solución activadora. Como medio de fertilización se usó la solución activadora (5 ml) por un periodo de 3 min por cada repetición. Las muestras fertilizadas fueron llevadas a incubadoras con ingreso de agua ascendente donde se lavó el semen sobrante a una temperatura de 28 °C (Verdi Olivares et al., 2014; Mesa-Grande y Botero-Aguirre, 2007). Se realizaron 15 repeticiones de fertilidad por cada tratamiento (15 repeticiones para yema de huevo de gallina, 15 para yema de codorniz y 15 para el semen fresco [control]). La fertilidad se evaluó a las 6 h de ser colocadas en la incubadora con una muestra al azar de huevos y fue expresada en porcentaje (Navarro et al., 2004). Todos los insumos usados fueron de Sigma Chemical (USA).
Análisis Estadístico
Los datos fueron expresados en promedio ± desviación estándar. Las características microscópicas fueron transformadas a valores angulares (arcoseno de la raíz de p) y luego los promedios de las variables fueron comparados mediante la prueba t Student (p<0.05) prueba paramétrica pues los datos transformados cumplieron los supuestos de normalidad (Shapiro Wilk) y homogeneidad de varianzas (de Levene). Los datos de fertilidad fueron sometidos a la prueba de Chi cuadrado. Todos los análisis fueron realizados con el programa estadístico de R con el paquete RCmdr (RCore Team, 2020).
RESULTADOS Y DISCUSIÓN
Los parámetros macro y microscópicos del semen fresco se describen en el Cuadro 1. El volumen varió entre 2.5 y 6.0 ml, mientras que la concentración espermática varió entre 28.0x109 y 37.6x109/ml.
Cuadro 1 Parámetros espermáticos macro y microscópicos de semen fresco de paco (Piaractus brachypomus) en Tambopata, Madre de Dios, Perú
| Media ± DE | |
|---|---|
| Color | Blanco lechoso |
| Volumen (ml) | 4.1 ± 1.0 |
| Concentración (109/ml) | 33.2 ± 2.9 |
| Motilidad (%) | 87.5 ± 5.4 |
| Vitalidad (%) | 70.1 ± 2.2 |
| Tiempo de activación (min) | 5.8 ± 0.8 |
El volumen promedio obtenido (4.1 ml) probablemente haya sido influenciado por el uso de la EHC (Viveiros et al., 2002; Fresneda et al., 2004) y representa un valor intermedio a lo reportado por otros investigadores. Navarro et al. (2004) y Suarez et al. (2019) reportaron volúmenes mayores, mientras que Nascimento et al. (2010) y Fresneda et al. (2004) obtuvieron volúmenes de semen menores a lo encontrado en el presente estudio. Asimismo, la concentración espermática fue menor a lo reportado por Nascimento et al. (2010) pero similar a lo mencionado por Fresneda et al. (2004). Otros factores que podrían causar la variabilidad entre los resultados del estudio y los reportados por otros investigadores se encuentran relacionados a la alimentación, la edad, tipo y dosis de hormona, método de colección seminal y época del año (Navarro et al., 2004; Nascimento et al., 2010; Alcántara et al., 2016).
Los parámetros microscópicos pos-descongelación por efecto de la yema de huevo de codorniz o gallina se muestran en el Cuadro 2. La motilidad es el único parámetro que fue afectado por el tipo de yema en el dilutor (p<0.05). Por otro lado, los parámetros seminales tuvieron mayor variabilidad por efecto de la yema de huevo de gallina respecto a la yema de huevo de codorniz, probablemente debido a diferencias en la composición de ambas yemas, aunque estos resultados son concordantes a los reportados por Bozkurt et al. (2014) para la carpa.
Cuadro 2 Parámetros espermáticos microscópicos de semen de paco (Piaractus brachypomus) pos-descongelación por efecto de la yema de huevo en el diluyente (Tambopata, Madre de Dios, Perú)
| Dilutor con yema de huevo de codorniz (Media ± DE) | Dilutor con yema de huevo de gallina (Media ± DE) | Valor p | |
|---|---|---|---|
| Motilidad (%) | 14.8b ± 0.66 | 18.8ª ± 1.11 | 0.015 |
| Vitalidad (%) | 31.0 ± 2.07 | 28.8 ± 4.13 | 0.647 |
| Tiempo de activación (min) | 1.4 ± 0.06 | 1.3 ± 0.10 | 0.570 |
a,b Medias con letras diferentes en la misma fila son estadísticamente diferentes a la prueba t (p <0.05)
Los valores pos-descongelación fueron menores a lo esperado, posiblemente debido al empleo de 5% de DMSO, considerando que Carolsfeld et al. (2003) recomienda 10%, pudiendo generar una menor protección disminuyendo la motilidad, tiempo de activación y fertilidad (Cruz-Casallas et al., 2006a). La baja vitalidad en el semen pos-descongelación fue similar a la reportada por Navarro et al. (2004), la cual se debería a daños que ocurren en la membrana espermática durante la congelación (Lahnsteiner et al., 1996), alteraciones en la permeabilidad de la membrana mitocondrial (Figueroa et al., 2016) y daño del ADN (Ekici et al., 2022).
El tiempo de activación en semen fresco fue superior a lo reportado por Fresneda et al. (2004) y Suarez et al. (2019) disminuyendo de 5.8 minutos en semen fresco a 1.4-1.3 minutos por efecto de yema de huevo de codorniz y gallina, respectivamente. En general, los resultados pos-descongelación tuvieron cierta variación con otros reportados en la literatura (Fresneda et al., 2004; Navarro et al., 2004; Ramírez-Merlano et al., 2011), pero sin que hayan influenciado los resultados de fertilidad.
La motilidad en semen fresco fue similar a otros reportes (Fresneda et al., 2004; Navarro et al., 2004; Suarez et al., 2019), pero la motilidad pos-descongelación fue menor a lo reportado por Fresneda et al. (2004), Nascimento et al. (2010) y Ramírez-Merlano et al. (2011), aunque similar al valor obtenido por Galo et al. (2019) en Piaractus mesopotamicus. La motilidad pos-descongelación fue mejor con el dilutor con yema de huevo de gallina (18.8%) que con el de yema de codorniz (14.8%) (p<0.05), aunque la diferencia con el semen fresco fue notoria. La yema de huevo puede haber afectado los niveles de glucosa (Babiak et al., 2001), así como por su contenido de lipoproteínas de alta densidad y minerales que reducen la motilidad (Moussa et al., 2002). No obstante, se observan reportes donde la yema de huevo afecta significativamente y otros donde no la afecta, dependiendo en ciertos casos de la especie animal (Maria et al., 2006; Jodun et al., 2007; Yildiz et al., 2013; Anzar et al., 2019).
De hecho, Lahnsteiner et al. (1996) demostraron que la adición de yema de huevo (0 vs. 7%) y sacarosa al diluyente junto con agentes crioprotectores con propiedades penetrantes en la célula mejoraban significativamente la calidad del esperma, incrementando la motilidad. Más recientemente, Torres et al. (2022) adicionando 5, 10 y 12% de yema de huevo, demostraron que era suficiente un 5% para proteger la membrana plasmática de los espermatozoides criopreservados de semen del pez Prochilodus brevis.
La mejor motilidad obtenida con el uso de yema de huevo de gallina en comparación con la yema de huevo de codorniz (Cuadro 2) fue semejante al estudio de Kulaksýz et al. (2010) en semen de ovinos. Las diferencias en motilidad obtenidas con la yema de huevo pueden estar relacionadas a las diferencias en la membrana plasmática de los espermatozoides y a la composición del plasma seminal de cada especie (Sun et al., 2019). Por otro lado, también podría deberse a que la yema de gallina tiene mayor porcentaje de colesterol (Bathgate et al., 2006) y sus LDL (lipoproteínas de baja densidad) podrían mejorar las tasas de motilidad (Bergeron y Puttaswamy, 2006).
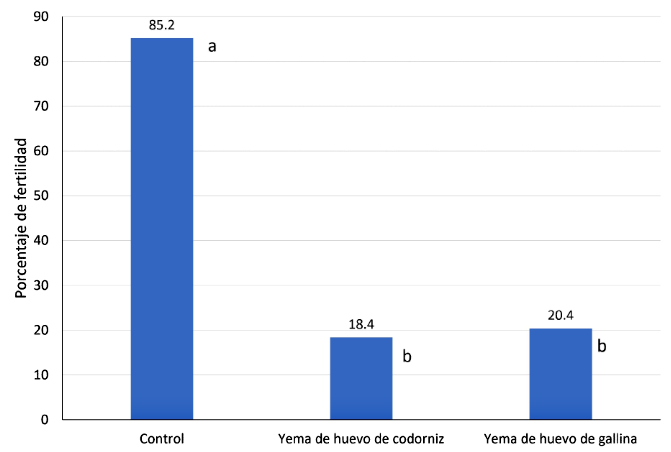
No se encontraron diferencias significativas en la prueba de fertilidad (Figura 1) de semen descongelado de paco al emplear la yema de huevo de codorniz o de gallina; sin embargo, las fertilidades fueron significativamente menores que la fertilidad obtenida con el grupo control (p<0.05). La fertilidad pos-descongelación fue inferior a lo mencionado por otros autores (Fresneda et al., 2004; Navarro et al., 2004; Ramírez-Merlano et al., 2011). Según Babiak et al. (2001) el uso de yema de huevo no necesariamente tiene una influencia significativa en la fecundación, aunque se menciona la posibilidad de que la yema de huevo podría disminuir la fertilidad en algunas especies por la interacción de sus componentes con el plasma seminal (Chauhan yAnand, 1990), y esto podría haber ocurrido en el presente estudio.
CONCLUSIONES
El movimiento de los espermatozoides depende de la energía liberada por el ATP proporcionado por las mitocondrias (Cosson et al., 1995). Cualquier daño a las mitocondrias, como sucede en la criopreservación, tiene un efecto negativo sobre la motilidad (Figueroa et al., 2016) y como consecuencia sobre el potencial de fertilización de los espermatozoides (Gallego et al., 2013).
La motilidad fue el único parámetro del semen crioconservado de paco (Piaractus brachypomus) que mejoró con la adición de yema de huevo de gallina, mientras que la vitalidad y el tiempo de activación no fueron afectados por el tipo de yema.
La crioconservación redujo drásticamente los parámetros seminales respecto al semen fresco.
Se requieren más estudios para demostrar las bondades de la yema de huevo frente a otros dilutores sobre la motilidad y fertilidad de los espermatozoides crioconservados de paco.












 uBio
uBio