INTRODUCCIÓN
La producción de pequeños rumiantes es fuente importante de alimentación y sustento económico de muchas regiones, habiendo una población de 1202 millones de ovinos en el mundo (FAO, 2019). La población ovina colombiana en 2019 fue de 1 629 120, y en la región de Tolima de 28 132 ejemplares (ICA, 2019). La producción ovina es considerada de baja rentabilidad (Hernández-Cortázar et al., 2014; Morris, 2017; Díaz-Sánchez et al., 2018), siendo el parasitismo gastrointestinal una de las principales causas que afectan la rentabilidad, dado que genera grandes pérdidas por la disminución en la producción, morbilidad y mortalidad de los animales(Miller et al., 2012; Mohammed et al., 2016; Sánchez et al., 2019).
Una de las estrategias de control más comunes en los casos de helmintiasis ovina es el uso de fármacos que en algunos rebaños también son empleados como profilácticos (Medina et al., 2014; Selemon, 2018). A pesar de que los antihelmínticos generan un control efectivo de los parásitos gastrointestinales, el uso inadecuado e indiscriminado de estos fármacos ocasiona un aumento de nematodos resistentes a ellos (Mphahlele et al., 2019), entre otras razones por el prolongado uso del mismo principio activo y por la subdosificación (Márquez, 2014; Mphahlele et al., 2019). Esto hace que aumente la frecuencia de presentación de individuos resistentes generando la pérdida de eficacia antihelmíntica y aumentando las tasas de morbimortalidad de los animales. El Haemonchus spp es, por otro lado, uno de los endoparásitos más patógenos reportado en explotaciones de rumiantes menores (Márquez, 2014; Kotze y Prichard, 2016).
La resistencia antihelmíntica es globalmente reportada, habiendo muchos reportes en las Américas (Torres-Acosta et al., 2012). En Colombia, se han realizado pocas evaluaciones de resistencia antihelmíntica que han incluido gran parte de la población ovina (Gárcia et al., 2016); sin embargo, se han desarrollado estudios regionales en granjas ubicadas en Córdoba (Buitrago et al., 2017), Cundinamarca, Valle del Cauca (Gárcia et al., 2016) y Antioquia (Zapata-Torres et al., 2015; Chaparro et al., 2017), evidenciando resistencia a los principales compuestos que se encuentran en el mercado. Lamentablemente, este tipo de información no se encuentra disponible para la región de Tolima. Por tanto, el objetivo del presente estudio fue determinar el grado de resistencia antihelmíntica en producciones ovinas de la región del valle cálido del Alto Magdalena, calculando el porcentaje de efectividad de antihelmínticos más utilizados en la región.
MATERIALES Y MÉTODOS
Área de Estudio
La evaluación de resistencia antihelmíntica se llevó a cabo en predios ubicados en cuatro regiones geográficas del valle cálido del Alto Magdalena, departamento del Tolima, Colombia, por debajo de los 1000 msnm. Los municipios incluidos fueron los de Armero Guayabal, Ambalema, Venadillo, Coello, Espinal, Guamo, Saldaña, Ortega, Coyaima y Natagaima (Figura 1). Las áreas de estudio presentan temperatura ambiente de 26 a 28 °C y una precipitación media anual entre 1000 y 2000 mm, con un régimen de lluvias bimodal, distribuido marzo -abril y septiembre - noviembre.
Población
El tamaño de muestra se determinó siguiendo la fórmula de proporciones para poblaciones finitas, con un nivel de confianza de 95%, proporción del 50% y un valor p=0.05, estimado a partir de reportes de resistencia en Colombia (Márquez, 2014), obteniendo un total de 380 animales en el ensayo de resistencia Los animales del estudio no fueron discriminados por la etapa productiva, raza, sexo, ni edad, pero se tuvo en cuenta que no hubieran recibido tratamiento antihelmíntico en los últimos 30 días y que presentaran conteos ≥ 200 HPG. Los animales fueron seleccionados en 13 predios de características disímiles de condiciones de manejo y sistemas de producción, con el fin de garantizar una mayor variabilidad para el análisis comparativo de eficacia (Figura 1). Los criterios de inclusión para la selección del predio fueron que tuvieran un número mínimo de 40 animales y que esta población fuera igual durante el tiempo del estudio. Los animales en cada predio fueron distribuidos en cuatro grupos de tratamiento antiparasitario (febendazol, ivermectina, moxidetina, levamisol) y en un grupo control no dosificado.
Se obtuvo la aprobación para la ejecución de la investigación por el Comité de Ética de la Universidad del Tolima, según Acta N°2.3-214 del 16 de octubre de 2014, en el marco del Proyecto ''Innovación y gestión técnico-científica para el desarrollo de la cadena ovino caprina del departamento del Tolima'', considerando las indicaciones descritas en la Ley 84 del 27 de diciembre de 1989. Se explicó el propósito del estudio a cada responsable de los predios en estudio y luego se les solicitó la firma del consentimiento informado.
Carga Parasitaria
Las muestras fueron colectadas directamente del recto de los animales en el día 0y el día 14 pos-tratamiento, se depositaron en frascos tapa rosca debidamente identificados y se transportaron bajo refrigeración hasta el Laboratorio de Parasitología Veterinaria de la Universidad del Tolima, donde se realizó un análisis cuantitativo de la carga parasitaria mediante la técnica McMaster, descrita en la guía RVC/ FAO (FAO, 2010). Para ello, se realizó un homogenizado con 3 g de materia fecal y 42 ml de solución saturada de azúcar, que fue filtrado a través de un tamiz metálico calibre 100. Se utilizó la cámara de McMaster para el conteo de huevos mediante observación directa al microscopio óptico binocular (Leica DM 500 LED) bajo un aumento de 10x. El cálculo de huevos por gramo de heces (HPG) se realizó, como lo describe la guía, a partir del resultado del conteo y empleando un factor de multiplicación de 50 (Coles et al., 1992; FAO, 2010). Los ovinos que arrojaron un conteo de HPG e"200 en la muestra del día 0 fueron incluidos en los grupos del estudio.
Test de Reducción del Recuento de Huevos Fecales (TRRH)
Se llevó a cabo siguiendo las directrices de la Asociación Mundial para el Avance de Parasitología Veterinaria (WAAVP, por sus siglas en inglés) (Coles et al., 1992, 2006). En cada predio, los animales se estratificaron de acuerdo con el recuento de huevos por gramo de materia fecal (HPG) y se asignaron aleatoriamente siete animales por grupo de tratamiento. Los tratamientos fueron suministrados a las dosis recomendadas para uso en campo: fenbendazol 10% (FBZ; 5 mg/kg, vo, MSD Animal Health), ivermectina al 1% (IVE; 0.2 mg/kg, sc, Injektion, Merial Vet. Norden A/S), moxidectina (MOX; 0.2 mg/kg, sc, Vet Scan Salud Animal A/S) y levamisol (LEV; 7 mg/kg, sc, Chemvet DK COMO).
El porcentaje de reducción de conteo de huevos de nematodos se determinó mediante la fórmula: %PRCH = 100(1-[xt]/ [xc]), donde, xt es la media aritmética del conteo de huevos para el grupo tratado y xc la del grupo control. Adicionalmente se calculó el límite inferior del intervalo de 95% de confianza para el porcentaje de reducción empleando la ecuación: Linf-IC95% = 100{(1-[xt]/[xc]) exp(2.1VY2)}, donde Y2 es la varianza de la reducción (Coles et al., 1992). Según establece la WAAVP se encuentra resistencia al antihelmíntico si %PRCH es menor al 95% y el Linf-IC95% es menor de 90%. Asimismo, en caso de que solo uno de los dos parámetros sea mayor, el resultado es considerado como sospechoso de resistencia.
Larvas L3
La obtención de larvas se realizó el día 14 siguiendo la metodología descrita en la guía RVC/FAO (FAO, 2010). Para los cultivos larvarios no se discriminó por individuo sino por grupo de tratamiento y de control, mezclando todas las muestras de heces de cada grupo. Se identificaron 50 especímenes por cultivo, empleando claves taxonómicas como el tamaño total del nematodo y de la cola de la vaina, tamaño y forma del esófago, cantidad y forma de las células esticosomales y cuerpos refringentes, identificadas mediante observación directa al microscopio en aumento de 20 y 40X (Van Wyk et al., 2013), a fin de determinar las especies de nematodos que fueron resistentes al tratamiento.
Encuesta
En cada predio se desarrolló un cuestionario al propietario o encargado con preguntas Sí/No que eran relevantes al manejo de la producción como tipo de pastoreo, tipo de vermífugo, periodicidad de uso de vermífugos, rotación de compuestos, evaluación FAMACHA(c) para desparasitar, rotación de pasturas con otras especies animales y disponibilidad de asesoría profesional, variables que puedan tener relación con la presentación de resistencia antihelmíntica.
Análisis Estadístico
El diseño experimental corresponde a un estudio de tipo descriptivo con muestreo no probabilístico de asignación aleatoria. El %PRCH y el límite inferior del intervalo de confianza al 95% se calcularon empleando el software FreeMat v. 4.1 y los datos se procesaron en el programa MS Excel(r). Adicionalmente se empleó la prueba de Bartlett para establecer la homogeneidad de las varianzas. Los promedios de recuentos de huevos de nematodos se compararon mediante un análisis de varianza asociado a una prueba de comparaciones múltiples. Se consideró un valor de p<0.05 para establecer diferencias entre grupos. La asociación entre las variables de la encuesta y la resistencia antihelmíntica se realizó mediante análisis bivariado empleando la prueba de independencia de Chi cuadrado con la corrección por continuidad de Yates, en el paquete Epi Info v. 6.
RESULTADOS
Recuento de huevos de nematodos en materia fecal
Los ovinos que presentaron conteos e"200 fueron distribuidos de manera homogénea en los grupos de manera que la carga parasitaria fue similar entre grupos en el día 0 (p=0.973) (Cuadro 1). Sin embargo, en el día 14 pos-tratamiento se evidencia una diferencia favorable en los grupos tratados con levamisol y moxidectina, comparado con el grupo control.
Cuadro 1 Promedio (± DE) de huevos de nematodos gastrointestinales por gramo de heces (HPG) en ovinos antes y después del tratamiento
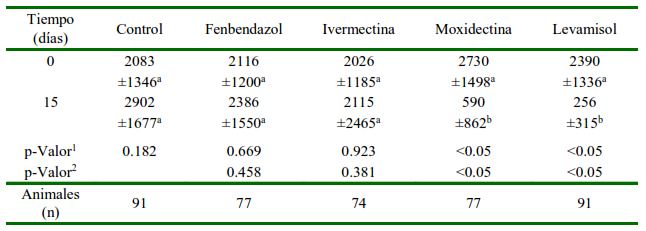
a,b Letras diferentes dentro de columnas y flas indican diferencias entre el día 0 y día 15 pos-tratamiento (p-Valor1) y entre los grupos tratados comparados con el grupo control (p-Valor2)
Resistencia antihelmíntica
El ensayo de reducción de conteo de huevos mostró eficacia disminuida a los fármacos de uso frecuente en la región como el levamisol, fenbendazol e ivermectina. En 91% de las granjas se presentó resistencia antihelmíntica hacia el fenbendazol, 89% a ivermectina y 46% a levamisol (Cuadro 2). Adicionalmente, el análisis de datos reveló que 77% de los predios presentaban multiresistencia; es decir efectividad reducida a más de un antihelmíntico, mostrando en su mayoría resistencia a tres o más compuestos (Cuadro 3).
Cuadro 2 Porcentaje de predios ovinos resistentes, susceptibles y sospechosos a antihelmínticos (Tolima, Colombia)
| Control | Fenbendazol | Ivermectina | Moxidectina | Levamisol | |
|---|---|---|---|---|---|
| Animales (n) | 91 | 77 | 63 | 77 | 91 |
| Predios (n) | 11 | 11 | 9 | 11 | 13 |
| Predios con susceptibilidad antihelmíntica (%) | - | 9 | 11 | 36 | 46 |
| Previos con sospecha de resistencia antihelmíntica (%)0 | - | 0 | 0 | 9 | 8 |
| Predios con resistencia antihelmíntica (%) | - | 91 | 89 | 55 | 46 |
Cuadro 3 Porcentaje de efectividad antihelmíntica por predio ovino (Tolima, Colombia)
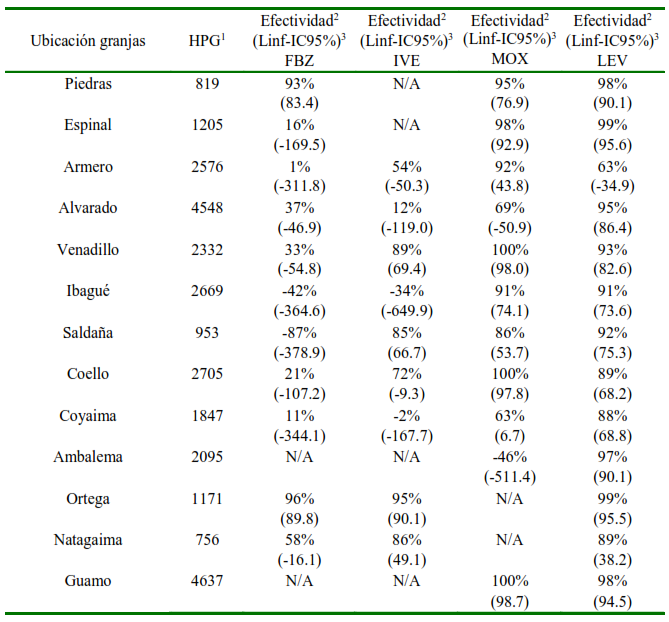
Fenbendazol 10% (FBZ); Ivermectina al 1% (IVE); Moxidectina (MOX); Levamisol (LEV)
1 Huevos por gramo de materia fecal
2 Porcentaje de efectividad de cada fármaco empleando la fórmula de Coles et al. (1992)
3 El límite inferior del intervalo de confianza al 95% (Linf-IC95%). N/A No analizado
Población de larvas pos-tratamiento
La población de larvas sobrevivientes en los tratamientos con los cuatro antihelmínticos fueron en su mayoría Haemonchus spp y Trichostrongylus spp. La Figura 2 muestra la proporción de cada especie larval por antihelmínticos.
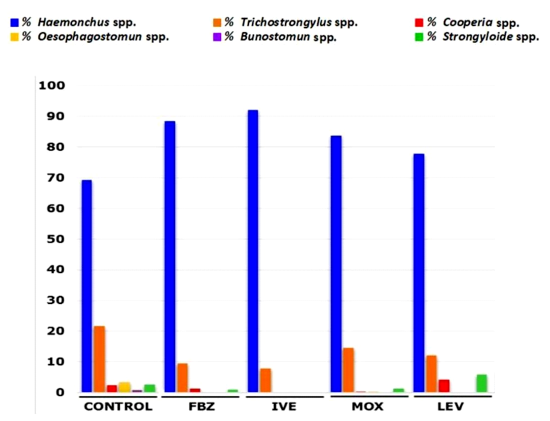
Figura 2 Proporción de larvas L3 de nematodos gastrointestinales en ovinos a los 15 días de tratamiento antihelmíntico (Tolima, Colombia)
Encuesta de la población de estudio
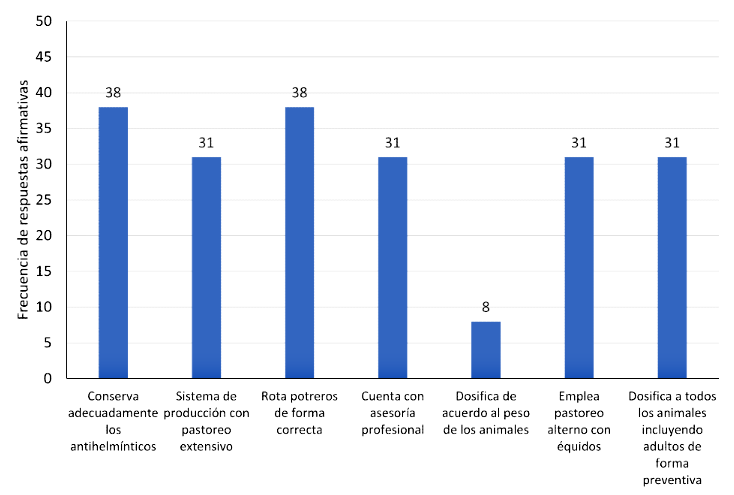
De las 14 variables analizadas por Chi cuadrado (Figura 3), siete mostraron una alta asociación con la presencia de resistencia antihelmíntica en el predio (p<0.05), siendo evidente en factores de riesgo como: vermifugar todos los animales incluyendo adultos de forma preventiva cada dos meses, no conservar adecuadamente los antihelmínticos, no contar con asesoría profesional, no dosificar el vermífugo de acuerdo con el peso vivo de los animales y una rotación incorrecta de los potreros. Por otra parte, sistemas de producción donde se pastorea con rotación con otras especies, principalmente équidos y pastoreo en grandes áreas, evidenciaron bajo nivel de resistencia a los vermífugos. La Figura 4 presenta las variables que mostraron asociación con la resistencia antihelmíntica en los predios y los valores p para cada pregunta de la encuesta.
DISCUSIÓN
Los promedios de recuentos de huevos en materia fecal al día 0 estuvieron entre 1161 y 2730 HPG, rango similar a lo reportado en los departamentos de Córdoba (1235 -2307 HPG) (Buitrago et al., 2017), Cundinamarca y Valle del Cauca (620-3750 HPG) (Gárcia et al.,2016) y Antioquia (178-2856)(Chaparro et al., 2017). No obstante, Zapata-Torres et al. (2015) documentaron rangos mayores para la zona de Antioquia (7027-8768 HPG). Los resultados indican que los animales del estudio presentaban una alta infestación parasitaria, similar a lo que se encuentra en otras zonas en el país.
El 78% de los predios evidenció multiresistencia y efectividad reducida de dos o más antihelmínticos, especialmente con los compuestos fenbendazol (91%) e ivermectina (89%) (Cuadro 3); resultados que concuerdan con otros estudios de resistencia en otros países del continente. Así, en México donde se reportó resistencia a fenbendazol, ivermectina y susceptibilidad en algunos predios al levamisol (González-Garduño et al., 2014), en Cuba se reportó un grupo de predios resistentes a levamisol y susceptibles a benzimidazol e ivermectina (Torres-Acosta et al., 2012; Márquez, 2014), en Brasil se reportó resistencia múltiple a closantel, ivermectina, doramectina, moxidectina, levamisol y fenbendazol (Torres-Acosta et al., 2012; Holsback et al., 2016; Bastos et al., 2017), en tanto que en Argentina se reportó resistencia múltiple en Haemonchus spp a levamisol, fenbendazol, closantel e ivermectina (Anziani y Fiel, 2015).
Por otro lado, Márquez (2014) encontró resistencia a benzimidazol, levamisol e ivermectina entre 21 a 25% del ganado de 30 predios de seis departamentos de Colombia, en tanto que solo 1-2% para doramectina y moxidectina, así como múltiresistencia en el 87% de los predios, lo que indica que, por lo menos para la zona del presente estudio, se encontró un mayor porcentaje de predios con resistencia a los antihelmínticos.
El aumento de forma paulatina del grado de resistencia no ha sido esclarecido; sin embargo, en el análisis descriptivo se hace evidente el comportamiento disímil de la resistencia en los predios, lo cual puede deberse a estrategias de manejo individual (Márquez, 2014; Mphahlele et al., 2019). En este estudio se encontró que la resistencia fue mayor en granjas con alta frecuencia de aplicación de antihelmínticos en comparación con aquellas donde se tratan a los animales 1-2 veces en el año; diferencias que pueden deberse a que las altas frecuencias de desparasitación incrementan la presión selectiva para los parásitos resistentes, ya que sobreviven al tratamiento y al reproducirse permiten un aumento en la proporción de parásitos resistentes (Cabaret et al., 2009).
Por otra parte, los resultados indican que usar varios compuestos en el año podría desencadenar multiresistencia. En este sentido, Falzon et al. (2014) documenta que las granjas con variación anual de clases de antihelmínticos tenían mayores probabilidades de tener resistencia a las drogas empleadas. Otro factor de riesgo asociado a resistencia es la dosificación por debajo de lo recomendado, ya que promueve la sobrevivencia de parásitos heterocigotos portadores de alelos susceptibles (FAO, 2003), permitiendo una mayor supervivencia de los parásitos resistentes.
En cuanto a la efectividad de los medicamentos, el análisis estadístico encontró asociación (p<0.05) de algunas variables (Figura 3). Prácticas como conservar adecuadamente los antihelmínticos, dosificar el vermífugo de acuerdo con el peso vivo de los animales, la rotación de potreros, dosificar los animales de forma preventiva y el pastoreo alterno con équidos, son estrategias que pueden minimizar la aparición de resistencia antihelmíntica; tal y como ha sido descrito por Falzon et al. (2014) en ovinos.
Se puede concluir que se demostró multiresistencia en predios del Valle Cálido del Alto Magdalena, donde Haemonchus spp fue el parásito con mayor presencia en predios con resistencia antihelmíntica. No se había reportado casos de resistencia antihelmíntica múltiple en nematodos gastrointestinales de ovejas en el Tolima, lo que hace de este estudio un aporte importante en el desarrollo de la región. Sin embargo, esta resistencia solo se asocia a la ecología de clima cálido y húmedo; desconociéndose la distribución y especies de nematodos resistentes en municipios de clima frio del departamento en donde la diversidad y la ecología parasitaria difieren.












 uBio
uBio