INTRODUCCIÓN
Los nematodos gastrointestinales tienen una alta frecuencia de presentación en los animales, afectando su bienestar y productividad. Por ello, su control es indispensable y conduce a la utilización continua de fármacos con actividad antiparasitaria como benzimidazoles, tetrahidropirimidinas y lactonas macrocíclicas, entre otros (Gokbulut y McKellar, 2018). Sin embargo, esta estrategia, si bien logró controlar el parasitismo gastrointestinal, es de enfoque reduccionista y contribuye a la aparición de problemas asociados a esta estrategia, tales como: resistencia antihelmíntica, residualidad química y el incremento de los costos para el control eficiente (Chaparro-Gutiérrez et al., 2018).
Frente a esta situación, surgen abordajes holísticos para el control antihelmíntico como: vacunas, selección de animales resistentes, manejo rotativo de potreros, utilización de enemigos naturales, utilización de nuevos principios activos y disminución de la exposición parasitaria (Hoste et al., 2012). Todas estas medidas buscan la protección contra las infecciones y reinfecciones parasitarias (Hernández Malagón et al., 2015).
Dentro de las alternativas de control se destaca la utilización de fitoquímicos obtenidos de la vegetación nativa local, los cuales pueden presentar potencial para su empleo en el entorno de los animales susceptibles a infestaciones parasitarias. Las plantas utilizadas para el control antiparasitario surgen de información procedente de la tradición oral, y consolidada a través de técnicas de ensayo y error realizadas por ganaderos en campo, sin condiciones controladas. Esto genera cuestionamientos acerca de su efectividad (Ramírez Poloche, 2012). Por tal razón, se considera indispensable evaluar metódicamente las propiedades antihelmínticas que cada planta posee para generar información contrastable, que a su vez permita incrementar la confianza en su beneficio (Moreno et al., 2010).
La viabilidad de esta búsqueda de compuestos fitoquimicos en América Latina es alta, gracias a las condiciones edafológicas y climáticas que permiten la existencia de una abundante y diversa flora. No obstante, en muchos de estos casos se desconoce sus fitocompuestos y su actividad específica. Ante esto, han surgido metodologías para estudios en plantas con potencial antihelmíntico empleando nematodos como modelos biológicos (García et al., 2005; Hernández-Alvarado et al., 2018; Matulevich Pelaez y Garcia Rodríguez, 2016; Molano et al., 2016; Quesada Romero et al., 2009).
En este contexto se planteó el presente estudio para evaluar la actividad antihelmíntica de los extractos de corteza y hoja del árbol Guazuma ulmifolia. Este árbol se emplea en regiones tropicales como planta comestible y se le atribuyen diferentes bioactividades de uso médico (Pereira et al., 2019; Velázquez et al., 2013). Incluso, existen reportes de presencia de compuestos con potencial antihelmíntico (Hernández-Alvarado et al., 2018). No obstante, faltan evidencias que documenten la magnitud del efecto biocida a distintas concentraciones de los extractos contra un modelo biológico como el de los nematodos estrongílidos de la subfamilia Cyathostominae, que son los que afectan con mayor frecuencia a los équidos en distintas partes del mundo.
MATERIALES Y MÉTODOS
Se llevó a cabo un estudió in vitro de la acción inhibitoria de la eclosión de huevos de nematodos Cyathostominae por efecto de los extractos metanólicos de la hoja y corteza de G. ulmifolia. Para esto se empleó la prueba de inhibición de la eclosión de huevos de nematodos recomendada por la Asociación Mundial para el Avance de la Parasitología Veterinaria, utilizada también por Torres Acosta et al. (2015) para el diagnóstico de la resistencia hacia los antihelmínticos.
Extractos Vegetales
Se colectaron 5 kg de tallos y 5 kg de hojas maduras y tiernas de árboles mayores de cinco años de G. ulmifolia, durante octubre de 2020 (temporada lluviosa), en el Municipio de Quebrada Negra, Cundinamarca, Colombia (4° 35' 56.57" N, 74° 04'51.30" O). La zona se encuentra a una altitud promedio de 1233 msnm y presenta una temperatura media de 24 °C, y un régimen de lluvias de tipo bimodal.
Los tallos fueron descortezados y luego la corteza y hojas se secaron por exposición solar a temperatura ambiente. Posteriormente, cada material se fragmentó en una trituradora de mandíbulas hasta obtener un tamaño de partícula de 1 mm. El material se empacó por separado en bolsas plásticas de cierre hermético para su almacenamiento a temperatura ambiente hasta la elaboración de los extractos.
El material fragmentado, tanto de corteza como de hoja, se sometió por separado a un proceso de extracción sólido-líquido continua. Esta se basó en maceración con metanol como disolvente, en una solución con proporción de 1:10 (20 g de material vegetal y 200 ml de metanol absoluto), durante 24 h, agitando mecánicamente la solución cada 6h. Luego se filtró el macerado por gravedad, empleando papel de filtro Whatman(r) con poro de 5-10 µm. Para eliminar el disolvente, se realizó evaporación al vacío empleando el rotoevaporador Heidolph HeiVapAdvantage. Finalmente, el extracto se acabó de secar en una estufa eléctrica.
Con el extracto seco de corteza y el de hoja, se preparó por separado la respectiva solución madre con una concentración de 80 mg/ml disolviendo el material respectivo en dimetil sulfóxido (DMSO). A partir de las soluciones madre de cada extracto crudo se prepararon diluciones en agua destilada con concentraciones de 1000, 500 y 250 µg/ml, para determinar la concentración media inhibitoria y la concentración con máxima inhibición de cada extracto.
Huevos de Nematodos
Se colectaron 1000 g de materia fecal de equinos naturalmente infectados con nematodos de la subfamilia Cyathostominae. Los huevos de nematodos se concentraron mediante la prueba de sedimentación lenta, seguida de la prueba de flotación con solución azucarada. Los huevos fueron cuantificados usando la cámara de McMaster. Finalmente, se preparó una solución de huevos en agua destilada con una concentración de 200 huevos/ml.
Prueba de Inhibición de la Eclosión
Se ejecutó la prueba de inhibición de la eclosión empleando las concentraciones de 1000, 500 y 250 µg/ml de cada extracto metanólico obtenido de hojas y corteza de la G. ulmifolia, un control negativo (DMSO) y dos controles positivos (Febendazol y Lugol). Estas pruebas siguieron el protocolo desarrollado por Torres Acosta et al. (2015) utilizando placas de cultivo de 24 pozos. Se emplearon dos pozos para cada control positivo, dos pozos para el control negativo y tres pozos para cada extracto y concentración evaluada. En cada pozo de 2 ml se depositó 10 µl de la concentración o control a evaluar, 1 ml de solución de huevos (200 huevos/ml) y 990 µl de agua destilada. De cada extracto se efectuaron 12 réplicas para cada concentración de los extractos de corteza y hoja.
Cada placa se incubó a una temperatura de 28 °C durante 48 h. La reacción se detuvo agregando una gota de lugol en cada pozo. Se tomó una muestra de cada pozo y la cantidad de huevos y larvas presentes se cuantificó en la cámara de MacMaster. Con estos datos se calculó el porcentaje de inhibición de la eclosión (PIE%) empleando la fórmula: PIE% = 100-(larvas/huevos + larvas)*100.
Análisis Estadístico
Los resultados de inhibición de la eclosión obtenidos en la fase experimental fueron organizados en una hoja de cálculo de MS Excel y analizados en el software R v. 3.6.3 (R Core Team, 2020) con la interfaz RStudio (RStudio Team 2020). Se verificó el cumplimiento de los supuestos básicos de homogeneidad y distribución normal de lo datos a través de las pruebas de Shapiro-Wilk y Levene. Luego se compararon las medias de inhibición a través del análisis de varianza y se realizó comparación múltiple de medias con la prueba de Duncan.
RESULTADOS
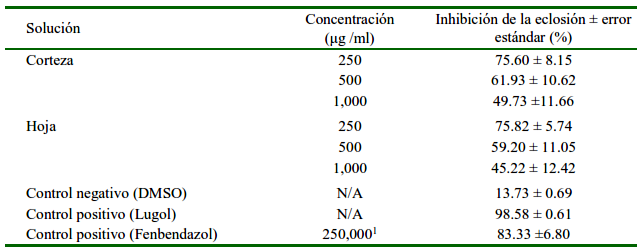
El efecto inhibitorio de los extractos de corteza y de hoja de G. ulmifolia varió entre 45 y 75%, aumentando el error estándar de los datos a medida que aumentaba la concentración del extracto. El análisis de varianza, tras la verificación del cumplimiento de los supuestos de normalidad y homogeneidad de los datos encontró similitud entre las medias analizadas (Figura 1) de las tres concentraciones de los extractos y de los controles positivos, siendo significativamente diferentes del control negativo. Sin embargo, se halló que las concentraciones de 250 µg en ambas estructuras de la planta tuvieron las respuestas más estables frente a la inhibición de la eclosión (Cuadro 1).

Figura 1 Porcentaje de inhibición de la eclosión de huevos de nematodos (subfamilia Cyathostominae) utilizando tres concentraciones de extractos metanólicos de hojas y corteza de Guazuma ulmifolia
DISCUSIÓN
Los datos obtenidos indican que tanto los extractos de corteza como los de hoja de G. ulmifolia, en sus diferentes concentraciones, presentan acción inhibitoria sobre la eclosión de huevos de nematodos Cyathostominae. Los hallazgos de este estudio son comparablesconlos realizadosporAntonio-Irineo et al. (2021), quienes evaluando el efecto inhibitorio de extractos acuosos de hoja de G. ulmifolia, empleando como modelo biológico nematodos presentes en ovinos, obtuvieron porcentajes de inhibición de la eclosión mayores al 59.8%.
El efecto antieclosión encontrado en los extractos de corteza y hoja de G. ulmifolia, probablemente se asocie a la presencia, en ambas partes, de compuestos como los taninos condensados, ácidos fenólicos y flavonoides, los cuales son abundantes en plantas de la familia Malvaceae (Zirintunda et al., 2022), familia a la que pertenece G. ulmifolia. Es importante indicar que la corteza es la parte de la planta con mayor concentración de compuestos fenólicos totales, pero con relación a los compuestos flavonoides totales tienen una concentración similar al de las hojas (Pereira et al., 2019). Las proantocianidinas (taninos condensados) predominan en la corteza, mientras que en las hojas predominan los ácidos fenólicos, al igual que los compuestos cianogénicos (Pereira et al., 2019).
Dentro de los compuestos presentes en las distintas partes de la planta G. ulmifolia, se encuentra que los ácidos fenólicos tienen un importante potencial citotóxico sobre líneas celulares de mamíferos y frente a protozoos como Leishmania y Trypanosoma (Calixto et al., 2016). Estos autores en G. ulmifolia detectaron ácidos fenólicos como el ácido gálico, ácido clorogénico, acido cafeico y ácido rosmarínico, así como los flavonoides rutina, luteolina, apigenina y quercitina, compuestos con potente actividad citotóxica con efecto leishmanicida y trypanocida. Asimismo, otros trabajos demuestran que los ácidos fenólicos tienen efectos sobre vías de señalización y de expresión genética que conducen a la muerte de formas larvarias o adultas de helmintos (Zirintunda et al., 2022).
Por otra parte, los taninos condensados presentes en G. ulmifolia se asocian a parálisis y muerte de formas adultas de helmintos (Zirintunda et al., 2022). En cuanto al efecto sobre la viabilidad de los huevos, las principales hipótesis sobre el mecanismo de acción de los taninos condensados son: a) desestabilización de la membrana y, por ende, el incremento de la permeabilidad a los demás compuestos presentes en los extractos, los cuales actuarían sobre las proteínas intracelulares del huevo, inhibiendo tanto su crecimiento como su eclosión; b) Inhibición de la reacción enzimática que permite la formación larvaria al afectar la mórula directamente; o c) Inhibición de la actividad enzimática requerida en la membrana del huevo para favorecer la eclosión (Antonio-Irineo et al., 2021).
Con respecto a los compuestos hallados en la corteza y hoja de G. ulmifolia, diversos estudios han verificado su presencia en plantas de las familias Fabaceae, Sapindaceae, Solanaceae, Myrtaceae y Santalaceae (Payne et al., 2013). De esta forma, se reporta que los extractos de hoja y flores de siete plantas australianas de estas familias tenían efecto inhibitorio en la eclosión de huevos de ciatostominos procedentes de equinos. Igualmente, extractos de la corteza de Diospyros anisandra de la familia Ebenaceae presente un porcentaje de inhibición de la eclosión de 50 y 99% contra ciatostominos en concentraciones de 11.3 y 38.1 µg /ml, respectivamente (Flota-Burgos et al., 2020). Por otro lado, Zurita et al. (2016) encontraron que los extractos de hoja de Albizia lophantha presentaron porcentajes de inhibición de la eclosión de 11 y 43% para las concentraciones de 80 y 120 µg/ml, respectivamente, nematodos gastrointestinales de equinos (Strongylus spp, Trichostrongylus axei, Strongyloides westeri y Parascaris equorum).
En todos los trabajos se buscó determinar la concentración media inhibitoria y la concentración con máxima inhibición para establecer una relación dosis/respuesta. En este estudio al intentar establecer la relación dosis-respuesta para determinar la dosis de mayor eficacia, se encontró carencia de diferencias significativas en los porcentajes de inhibición de eclosión entre las diferentes concentraciones evaluadas, aunque la estabilidad de los efectos fue mejor en las concentraciones más bajas que se evaluaron en cada extracto. Probablemente estos hallazgos se asocien a que los metabolitos secundarios responsables del efecto inhibitorio, tales como los taninos condensados e hidrolizables, alcaloides y terpenos entre otros, pueden tener efectos variables dependiendo de su proporción, pasando de terapéuticos a tóxicos en mayores proporciones (Ávalos y Pérez-Urria, 2009).
Además, se encuentra que la concentración de metabolitos con actividad anti-eclosión, se relaciona estrechamente con los solventes empleados para la extracción. Los extractos acuosos permiten extraer bio-compuestos como antocianinas, terpenoides, saponinas y taninos en concentraciones inferiores a las obtenidas con solventes alcohólicos como el metanol, en tanto que con solventes alcohólicos se reporta mayor índice de extracción sobre compuestos como flavonoides y polifenoles (Zurita et al., 2016; Flota-Burgos et al., 2017; Esteban-Ballesteros et al., 2019; Pereira et al., 2019; Antonio-Irineo et al., 2021).
CONCLUSIONES
Los extractos metanólicos de corteza y hoja de Guazuma ulmifolia en las concentraciones de 1000, 500 y 250 µg presentaron efecto anti-eclosión frente a los huevos de ciatostominidos de equinos.
Las tres concentraciones, tanto de hoja como de corteza, tuvieron un comportamiento semejante; sin embargo, la concentración de 250 µg en ambos extractos presentó mayor estabilidad en las distintas mediciones.












 uBio
uBio