INTRODUCCIÓN
El cuy (Cavia porcellus) es una especie oriunda del Perú, con una amplia importancia histórica y económica, y con gran potencial como alternativa cárnica para consumo humano por sus bajos costos de producción y altos valores nutricionales. Sin embargo, este potencial se encuentra afectado, entre otros, por diversos problemas sanitarios que disminuyen el rendimiento productivo y, consecuentemente, la retribución económica. La salmonelosis es considerada como uno de los más graves problema sanitarios por la elevada tasa de mortalidad, morbilidad, siendo una de las principales causas de aborto y mortinatalidad (Chauca, 1997; Ortega, 2015). El serovar Typhimurium de Salmonella sp usualmente se encuentra en el 100% de los aislados positivos a Salmonella sp de muestras provenientes de cuyes en Perú (Marcelo, 2015).
Las medidas de control y prevención de la salmonelosis incluyen el correcto manejo y bioseguridad en la granja con la finalidad de evitar condiciones de estrés y sobreexposición al patógeno, así como también asegurar una adecuada homeostasis en los individuos, con especial atención a su capacidad inmunitaria (Canchari, 1995). Debido a ello, el potencial desarrollo de una vacuna representa una alternativa interesante para contribuir con el adecuado control de la enfermedad. En aves se ha logrado grandes avances en el control de la cepa Salmonella Gallinarum mediante el uso de vacunas vivas atenuadas (Audisio y Terzolo, 2002). Así mismo, la CDC (2019) recomienda la vacunación con Salmonella Typhi en humanos previo a un viaje a zonas endémicas de salmonelosis como método preventivo.
Al observarse el éxito previo en otras especies para el control de la enfermedad, se ha propuesto la creación de una vacuna efectiva contra Salmonella Typhimurium. Sin embargo, la replicación de la enfermedad en condiciones experimentales representa un obstáculo tanto para el entendimiento de los procesos patológicos de la salmonelosis en el cuy como para las pruebas de eficacia y seguridad de los candidatos vacunales al observarse una mortalidad baja tras el desafío por vía oral con Salmonella Typhimurium (Saldarriaga, 2018; Bazán et al., 2019). Ante esto, el presente estudio busca determinar un modelo animal que facilite la replicación de la salmonelosis en cuyes en condiciones experimentales, extrapolando un modelo existente utilizado en ratones, el cual utiliza una única dosis del aminoglucósido estreptomicina como tratamiento previo al desafío, con la finalidad de reducir la microbiota normal y causar una susceptibilidad ante la infección por vía oral (Higginson et al., 2016). Para tal fin, se realizó un diseño experimental que busca recolectar evidencias del efecto positivo, tanto en mortalidad como en frecuencia de aparición de lesiones, de una única dosis de 50 mg de estreptomicina previo al desafío experimental.
MATERIALES Y MÉTODOS
Animales
En marzo de 2020 se obtuvieron 58 cuyes hembras de 15 días de edad provenientes de un centro de crianza experimental ubicado en el distrito de Huaral, Lima, Perú. Los animales fueron transportados a la Unidad de Biología y Genética Molecular de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos, Lima. Los cuyes fueron distribuidos en tres módulos de crianza de tres pisos cada uno, los cuales contaban con comederos, bandejas recolectoras de heces, tubos PVC recolectores de orina y un dispensador de agua conectado a bebederos accionados mediante niples.
Dos de estos módulos contuvieron a 24 animales cada uno distribuidos equitativamente en cada piso (8 animales por piso). Cada piso correspondía a una concentración de inóculo diferente (107, 108 y 109 UFC/ml). Asimismo, un módulo correspondía al grupo "Con estreptomicina", mientras que el otro módulo correspondía al grupo "Sin estreptomicina". El tercer módulo contó únicamente con 10 animales, distribuidos equitativamente en dos pisos (5 animales por piso). Este módulo correspondía al grupo de animales No Desafiados. Al grupo de animales ubicados en el piso inferior se les denominó "Blanco con estreptomicina" y al grupo de animales ubicados en el piso superior se les denominó "Blanco sin estreptomicina".
Diseño Experimental
La crianza tuvo una duración total de 45 días, iniciando con un periodo de 15 días de adaptación a las nuevas condiciones de crianza y poder observar potenciales signos clínicos que sugieran una enfermedad preexistente. Asimismo, en este periodo inicial se realizó un descarte de salmonelosis mediante un protocolo de aislamiento microbiológico modificado a partir de lo descrito por la OMS (2010) y Díaz (2016), siguiendo el estándar ISO-6579. Para ello se tomaron 8 pellets de heces frescas de cada módulo de experimentación los días 0, 7 y 15. Las muestras fueron homogeneizadas y se tomó 0.5 g del pool de heces, siendo puesto en 4.5 ml de agua peptonada. Tras 18 h de incubación a 37 °C se transfirió 20 µl del agua peptonada a 2 ml de caldo de Rappaport -Vassiliadis Soya e incubados durante 24 h a 41.5 °C. Luego, los caldos fueron sembrados en agar Xilosa Lisina Desoxicolato (XLD) mediante sembrado por agotamiento e incubados durante 24 h. Finalmente, se observaron las placas sin encontrar crecimiento de colonias compatibles con Salmonella sp.
En el primero de los 30 días del estudio se administró estreptomicina (Sigma) por vía oral mediante sonda intragástrica de acuerdo con el protocolo descrito por Vishwakarma et al. (2012), a dosis de 50 mg diluido en 1 ml de NaCl a los individuos de los grupos correspondientes. Los animales de los grupos blanco recibieron 1 ml de NaCl por vía oral mediante sonda intragástrica. Los animales pasaron por un ayuno de 24 h al término de este procedimiento. Además, se midió el consumo de alimento diario mediante la diferencia del peso del alimento ofrecido y el alimento recolectado al finalizar el día.
Cepa Patógena
El desafío experimental se realizó en el segundo día del estudio experimental. Para ello se utilizó una cepa de Salmonella Typhimurium de patogenicidad conocida. La obtención de esta cepa se realizó 7 días previos a la inoculación experimental. Para ello se utilizaron dos cuyes provenientes del mismo centro de crianza a los cuales se inoculó vía intraperitoneal 107 UFC de Salmonella Typhimurium. Uno de los animales murió súbitamente al día siguiente de la inoculación, mientras que el otro se mantuvo asintomático y murió luego de 7 días. El patógeno fue aislado del hígado, contenido intestinal y contenido biliar de ambos animales. Esta cepa reactivada fue cultivada en 500 ml de Caldo Luria Bertani (LB) por 18 h. Tras la incubación, el caldo de cultivo fue homogenizado y dispensado en 10 tubos de 50 ml. Los tubos fueron centrifugados a 16 500 g por 5 min. Se descartó el sobrenadante y se resuspendió el material sedimentado en 2 ml de glucosa al 20%. Se combinó el contenido de cada uno de los 10 tubos en uno solo, obteniendo 20 ml de inóculo. Se midió la absorbancia de la solución mediante espectrofotometría y realizando los ajustes correspondientes se llegó a la concentración deseada de 109 UFC/ml. Se obtuvierondilucioneshasta obtenerinóculoscon concentraciones de 107, 108 y 109 UFC/ml.
La inoculación fue realizada mediante pellets de alimento, en base a la metodología descrita por Nilsson et al. (2019). Los animales fueron observados diariamente días para determinar posibles signos clínicos compatibles con salmonelosis y mortalidad. Este periodo culminó cuando no se observó casos de mortalidad durante al menos 5 días. La última mortalidad se observó al día 25, por lo que el periodo observacional duró 30 días.
Lesiones Macro y Microscópicas
Se realizó la necropsia a los animales que murieron durante el estudio. Se registraron posibles lesiones macroscópicas in situ. Luego se procedió a examinar los órganos ex situ, tomándose, además, muestras de intestino delgado, hígado y pulmón para diagnóstico histopatológico, así como de bazo, hígado y pulmón para aislamiento microbiológico. En los animales con vesícula biliar distendida se recolectó el contenido biliar mediante punción con aguja fina para aislamiento microbiológico.
Se realizó la eutanasia a los animales supervivientes luego del periodo observacional mediante anestesia con ketamina / xilacina (Ket-A-Xyl(r),Agrovet Market) a una dosis de 0.05-0.1 ml/cuy vía IM y luego se realizó la eutanasia mediante aplicación intracardiaca de 2 ml de pentobarbital sódico a 6.5 g (Halatal(r), Montana). Los animales pasaron a la necropsia luego de la eutanasia.
Se obtuvieron cortes histológicos con tinción hematoxilina-eosina (H-E) de las muestras remitidas, a las cuales se les atribuyó un patoscore de acuerdo con la metodología utilizada por Vishwakarma et al. (2012). El puntaje se basó en la observación de lesiones patológicas microscópicas, específicamente la presencia de edema en la submucosa (0-3 puntos), infiltración de polimorfo-nucleados (0-4 puntos), pérdida de células caliciformes (0-3 puntos), y ulceración epitelial (0-3 puntos). El puntaje de cada criterio fue sumado, obteniéndose un puntaje máximo de 13 puntos. El puntaje final se define como intestino intacto (0 puntos), inflamación mínima (1-2 puntos), inflamación leve (3-4 puntos), inflamación moderada (5-8 puntos) o inflamación severa (9-13 puntos). Para obtener un puntaje representativo de cada grupo, se promedió el puntaje final de todos los animales pertenecientes a los grupos de distintas dosis.
PCR en Tiempo Real
Se realizó la técnica de PCR cuantitativa o en tiempo real (qPCR) para determinar el momento en días en que los animales excretaban el patógeno por heces. Se recolectaron 8 pellets de heces elegidas de diversas zonas de las bandejas recolectoras de heces de cada uno de los módulos experimentales los días 0, 1, 3, 6, 9, 15 y 21 pos-inoculación. Se extrajo el ADN a partir de a partir de 1 g de heces homogenizadas de cada grupo experimental mediante el QIAamp PowerFecal DNA Kit, siguiendo el procedimiento recomendado por el fabricante.
Se realizó una curva standard a partir de diluciones de muestra de ADN obtenida de un cultivo de concentración previamente determinada mediante espectrofotometría con la finalidad de cuantificar mediante qPCR el ADN obtenido. Los cebadores utilizados para la determinación de Salmonella Tiphimurium fueron aquellos descritos por Malorny et al. (2004), los cuales generan un tamaño de fragmento de 94 bp. Las condiciones de la reacción fueron establecidas de acuerdo con el protocolo descrito por Delibato et al. (2006) con un ciclo inicial de 95 °C durante 5 minutos, seguido durante 40 ciclos de amplificación de 95 °C durante 1 min, 60 °C durante 1 min y 72 °C durante 1 min. Los resultados obtenidos fueron colocados en un diagrama XY, obteniéndose la fórmula de la recta con la que se realizaron las cuantificaciones absolutas de Salmonella. Se realizó PCR cuantitativo al ADN extraído de las heces, utilizando un protocolo idéntico en cuanto a reactivos y condiciones al utilizado en la fase de estandarización de la curva. Los resultados de Ct obtenidos fueron convertidos a cantidad absoluta de Salmonella por gramo de heces mediante la fórmula determinada por la curva estandarizada.
RESULTADOS
En el periodo inicial de 15 días de adaptación no se observaron signos clínicos compatibles con enfermedad. La mortalidad observada durante la fase experimental se presenta en el Cuadro 1. Se observó un mayor porcentaje de mortalidad al desafío experimental en los cuyes que recibieron tratamiento previo de estreptomicina, no habiendo diferencia estadística entre los porcentajes de mortalidad según la concentración de inóculo (Fisher Test, p=0.84). El uso de curvas de supervivencia reflejó la diferencia obtenida (Figura 1), donde los animales tratados con estreptomicina tuvieron una tasa acumulada de mortalidad mayor. Por otro lado, se observó una mayor frecuencia de lesiones macroscópicas en los grupos pretratados con estreptomicina (Cuadro 2).
Cuadro 1 Mortalidad observada en los grupos blancos y grupos experimentales inoculados con diferentes concentraciones de una cepa patógena de Salmonella Typhimurium

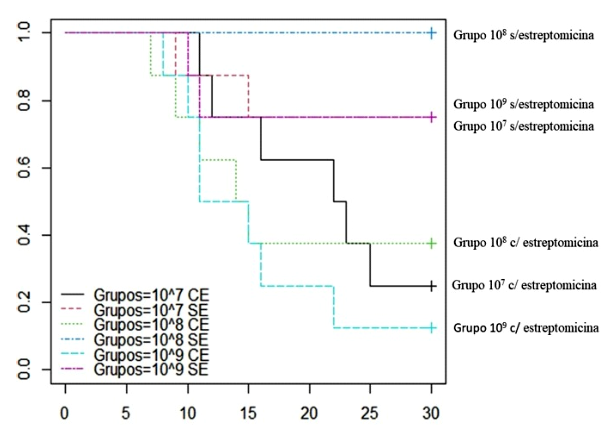
Figura 1 Curva de supervivencia obtenida a partir de la mortalidad registrada en cuyes inoculados con diferentes concentraciones de una cepa patógena de Salmonella Typhimurium. El eje y denota el porcentaje de animales supervivientes. El eje x denota los días pos-desafío
Cuadro 2 Lesiones macroscópicas en cuyes inoculados con tres concentraciones de una cepa patógena de Salmonella Typhimurium y premedicados con o sin estreptomicina
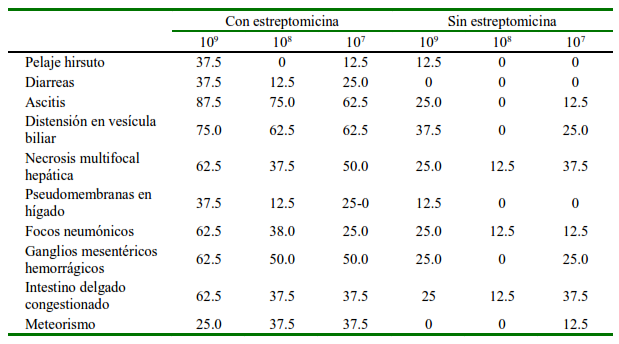
Los patoscores con base a las lesiones observadas en intestino delgado (edema en la submucosa, infiltración de polimorfonucleares, pérdida de células caliciformes, ulceración de la mucosa) fueron mayores en los animales pretratados con estreptomicina (Cuadro 3). Las mayores lesiones se debieron a una inflamación moderada a nivel intestinal. El grupo 108 sin tratamiento previo con estreptomicina mostró el patoscore más bajo, siendo común cambios histopatológicos mínimos, mientras que el grupo 109pretratado con estreptomicina mostró el patoscore más elevado.
Cuadro 3 Promedio de patoscores obtenidos de las muestras de intestino delgado de cuyes inoculados con diferentes concentraciones de una cepa patógena de Salmonella Typhimurium y premedicados con (CE) o sin (SE) estreptomicina
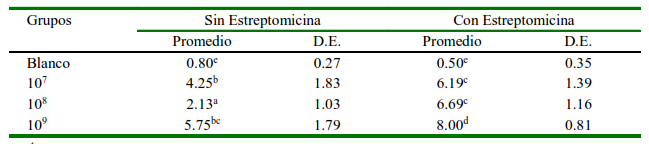
a,b,c Índices diferentes denotan diferencia significativa (p<0.05)
La cantidad de alimento consumido fue mayor en los animales que no recibieron tratamiento previo de estreptomicina y en cuyes del grupo Blanco (p<0.05; Figura 2). El promedio de peso inicial y al desafío fue similar entre grupos, en tanto que al final del posdesafio los grupos blanco presentaron el mayor peso, seguido de los grupos SE y CE (p<0.04, Cuadro 4).
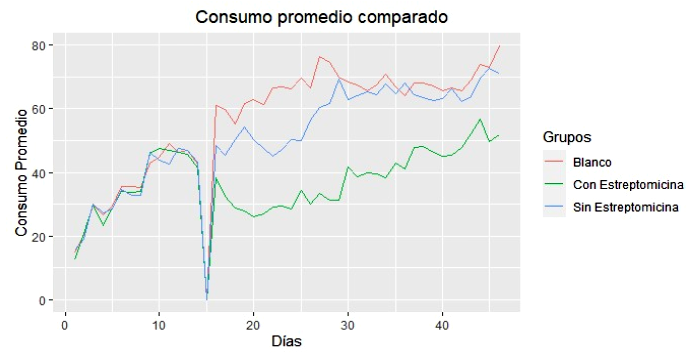
Figura 2 Consumo promedio comparado de grupos sometidos a tratamiento con estreptomicina, grupos sin tratamiento, y grupos blanco
Cuadro 4 Peso promedio inicial, al desafío y final (29 días pos-desafío) en cuyes inoculados con diferentes concentraciones de una cepa patógena de Salmonella Typhimurium y premedicados con (CE) o sin (SE) estreptomicina
| Peso inicial (g) | Peso al desafío (g) | Peso final (g) | |
|---|---|---|---|
| Blanco CE | 266 ± 14.6 | 473.6 ± 40.5 | 872.4cd ± 82.5 |
| Blanco SE | 298.4 ± 15.5 | 503.6 ± 12.6 | 917.2d ± 50.2 |
| 107 SE | 263.8 ± 8.6 | 436.9 ± 66.0 | 765.5b ± 58.2 |
| 108 SE | 285.8 ± 18.2 | 488.9 ± 49.5 | 824.4b ± c55.5 |
| 109 SE | 270.5 ± 17.0 | 451.0 ± 40.9 | 790.3bc ± 47.8 |
| 107 CE | 268.9 ± 23.5 | 443.0 ± 27.9 | 632.0a ± 86.0 |
| 108 CE | 258.6 ± 22.1 | 389.5 ± 48.6 | 596.0a ± 28.4 |
| 109 CE | 265.4 ± 15.7 | 418.9 ± 22.1 | 604.0a ± 9.2 |
a,b,c,d Índices diferentes denotan diferencia significativa (p<0.05)
La cantidad de UFC por gramo de heces más alta se observó al día 6 en el grupo 109con tratamiento previo de estreptomicina. Así mismo, este grupo presentó el mayor tiempo de excreción de Salmonella Typhimurium en heces (15 días). Dos de los grupos experimentales (108 y 109 SE) no amplificaron en ninguna reacción (Cuadro 5).
Cuadro 5 Unidades formadoras de colonias (UFC) por gramo de heces observados tras una reacción de PCR en tiempo real en las muestras de ADN extraídas de heces recolectadas de cuyes de experimentación pos-inoculación con diferentes concentraciones de una cepa patógena de Salmonella Typhimurium y premedicados con (CE) o sin (SE) estreptomicina
| Con Estreptomicina | Sin Estreptomicina | |||||||
|---|---|---|---|---|---|---|---|---|
| Blanco | 107 | 108 | 109 | Blanco | 107 | 108 | 109 | |
| Día 0 | - | - | - | - | - | - | - | - |
| Día 1 | - | - | 1.29x103 | 0.93x103 | - | - | - | - |
| Día 3 | - | - | 2.48x103 | 1.11x104 | - | 1.22x104 | - | - |
| Día 6 | - | 1.32x104 | 3.65x104 | 3.33x105 | - | 1.23x104 | - | - |
| Día 9 | - | - | 1.3x103 | 2.4x104 | - | - | - | - |
| Día 15 | - | - | - | 2.05x104 | - | - | - | - |
| Día 21 | - | - | - | - | - | - | - | - |
El límite de detección fue de 103 UFC por gramo de heces
DISCUSIÓN
La elección de estreptomicina se basó en un modelo murino ampliamente usado tanto para el estudio de patogénesis de Salmonella spp como para el análisis de candidatos vacunales de serotipos de Salmonella, siendo el principal Salmonella Typhimurium (Kaiser et al., 2012; Higginson et al., 2016). Pesciaroli et al. (2011) fueron los primeros que sugirieron el uso del modelo llamado "Ratón tratado con estreptomicina" con la finalidad de probar tanto la efectividad como la seguridad de un candidato vacunal contra Salmonella Typhimurium en ratones.
En el presente estudio, la relación encontrada entre la aplicación de estreptomicina y la mortalidad producida por una cepa de Salmonella Typhimurium muestra una clara evidencia que apoya a la hipótesis de que los animales pretratados con estreptomicina presentarían una mayor mortalidad producida por salmonelosis a comparación de animales sin tratamiento. Kaiser et al. (2012) encontraron que la microbiota de los ratones es reducida hasta en un 90%, tanto en densidad como en composición, 24-48 h después de una sola dosis de 20 mg de estreptomicina por vía oral. Esta depleción produce una mayor susceptibilidad a la infección producida por Salmonella Typhimurium y, por consiguiente, un porcentaje de mortalidad elevado.
Los cuyes con adecuada microbiota intestinal se muestran usualmente resistentes a la infección experimental. Diversos autores obtuvieron mortalidades nulas tras una infección por vía oral con 2x106 UFC de Salmonella Typhimurium luego de 49 días de crianza (De la Rosa, 2018; López, 2018; Saldarriaga, 2018; Bazán et al., 2019). En el presente estudio se obtuvo una mortalidad de 75% (18/24) para cuyes pretratados con estreptomicina y de 16.7% (4/24) para cuyes sin tratamiento luego de 45 días de crianza. La mortalidad observadas en cuyes sin tratamiento previo de estreptomicina, en comparación con otros estudios donde no se presentó mortalidad pudo deberse a la procedencia de la cepa, a la dosis utilizada, a las condiciones ambientales de la crianza e incluso a características innatas de resistencia o susceptibilidad propias de cada individuo.
El patoscore en los grupos con y sin tratamiento previo de estreptomicina fue de 7.125/13 y de 4.208/13. En este sentido, Pesciaroli et al. (2011) obtuvieron un patoscore de 8.2/17, mientras que Vishwakarma et al. (2012) obtuvieron un promedio de 8/13. No obstante, estas diferencias pudieron deberse al día en que se realizaron las evaluaciones, dado que en dichos estudios se hizo entre los 3 y 11 días del desafío, mientras que en el presente estudio fue entre los 7 y 30 días del desafío. A su vez, es importante considerar que la determinación de un patoscore es subjetiva.
Los animales que recibieron un tratamiento con estreptomicina denotaron una mayor eliminación de bacterias por heces que los animales sin tratamiento previo, así como también una eliminación por mayor tiempo para los grupos que recibieron una dosis de 108 y 109 UFC/ml. Lawley et al. (2007) observó que ratones pretratados con una dosis de neomicina eliminaban hasta 1000 veces más de UFC por gramo de heces que ratones sin tratamiento previo luego de un desafío con 108 UFC de Salmonella Typhimurium por vía oral utilizando ratones con predisposición genética conocida a esta infección. En el presente estudio, la diferencia de la excreción de UFC por gramo de heces entre los grupos no pudo ser definida adecuadamente debido al límite de detección de la prueba de qPCR. No obstante, la cantidad de UFC por gramo de heces observado por dicho autor fue marcadamente mayor a la observada en este estudio, posiblemente debido, además, al empleo del corticosteroide Dexametasona (5 mg/l agua) con la finalidad de causar una mayor inmunosupresión.
Existe una discrepancia entre los datos de mortalidad observados versus los datos de excreción de UFC de Salmonella Typhimurium para el grupo 107 con tratamiento previo de estreptomicina. En este grupo se observó una mortalidad elevada (6/8), pero sin que se observen niveles detectables de Salmonella Typhimurium en heces. Debido a que en el presente estudio se priorizó la observación de mortalidad, se mantuvo a los animales de cada grupo en jaulas colectivas, sin posibilidad de obtener muestras individualizadas de heces, lo cual implica la posibilidad de colectar heces de animales sin signos clínicos asociados a salmonelosis (25% de animales en el módulo).Asimismo, se debe considerar el límite de detección de la prueba (103 UFC/g de heces). Por otro lado, se observó un patoscore menor en este grupo, en tanto que las mortalidades para este grupo fueron espaciadas, siendo el último caso el día 25 pos-inoculación. Ante esto, es posible indicar que una dosis de 107 UFC/ml más la dosis de 50 mg de estreptomicina no es suficiente para causar excreción de Salmonella Typhimurium en heces mayor a 103 UFC/g de heces, a pesar de ser suficiente para provocar un cuadro de salmonelosis sistémico.
CONCLUSIONES
La mortalidad en cuyes causada por un desafío de Salmonella Typhimurium a concentraciones de 108 y 109 fue mayor en cuyes pretratados con una única dosis de 50 mg de estreptomicina por vía oral que en aquellos desafiados con una dosis de 107.
La frecuencia de aparición de lesiones histológicas asociadas a salmonelosis luego de un desafío a concentraciones de 107, 108 y 109 de Salmonella Typhimurium fue mayor en cuyes pretratados con una única dosis de 50 mg de estreptomicina por vía oral que en aquellos no pretratados.
Los parámetros productivos de consumo de alimento y ganancia de peso luego de un desafío a concentraciones de 107, 108 y 109 de Salmonella Typhimurium fueron menores en cuyes pretratados con una única dosis de 50 mg de estreptomicina por vía oral que en aquellos no pretratados.
No fue posible determinar el efecto de la estreptomicina en los niveles de excreción de Salmonella Typhimurium en heces.












 uBio
uBio 


