INTRODUCCIÓN
La canal de cuy es reconocida como un alimento de gran valor nutricional, resaltando su aporte proteico, habiendo incrementado significativamente su producción en los últimos años en el Perú (MIDAGRI, 2019). No obstante, la crianza informal bajo condiciones deficientes de manejo sanitario no garantiza el expendio de un alimento inocuo, lo que representa un riesgo para la salud del consumidor.
La Resolución Ministerial N.° 591- 2008/MINSA que aprueba la Norma Técnica Sanitaria N.° 071-MINSA/DIGESA-V.01 (2008) establece los criterios microbiológicos de calidad sanitaria e inocuidad para los alimentos y bebidas de consumo humano, incluyendo la presencia de Salmonella spp (MINSA, 2008); sin embargo, el aislamiento de cepas de S. enterica resistentes y multidrogorresistentes (MDR) a antibióticos en canales, vísceras y muestras fecales provenientes de esta especie ponen en evidencia el riesgo sanitario al que es expuesto el consumidor (Telles, 2017; Morales-Cauti, 2018; Salvatierra et al., 2018; Soto, 2019; Huamán et al., 2020).
Salmonella enterica ha sido reconocida como uno de los patógenos de mayor importancia causante de una enfermedad transmitida por alimentos (ETAs) de carácter zoonótico a nivel mundial. Sin embargo, esta muestra signos y lesiones variables en el humano y en los animales, dependiendo de la patogenicidad, virulencia y resistencia frente a antibióticos de la cepa infectiva (Ríos, 2018; Duran, 2019; Jaja et al., 2019).
La salmonelosis en cuyes es reconocida como una enfermedad prevalente en el país, mostrándose de forma aguda (mortalidad entre 24-48 horas) o crónica, con signos generales de caquexia, anorexia, debilidad, parálisis de miembros, aborto, ascitis, neumonía y diarrea, entre otros (Morales-Cauti, 2017; Duran, 2019). Sin embargo, la salmonelosis en humanos está relacionada con signos leves, aunque, serovares como S. Typhimurium y S. Enteritidis pueden causar sintomatología gastrointestinal ligada con dolor abdominal, náuseas, vómitos, diarrea y gastroenteritis, hasta septicemia y muerte en los casos más graves (Telles, 2017; Ríos, 2018).
El serovar aislado con mayor frecuencia en cuyes (muestras de heces, linfonódulos, canal, vísceras, etc.) es S. Typhimurium (Marcelo, 2015; Salvatierra et al., 2018; Morales-Cauti, 2018; Duran, 2019; Huamán et al., 2020). Este serovar también ha sido reportado en muestras obtenidas de humanos (OPS, 2008; Quesada et al., 2016; Elkenany et al., 2019; Quino et al., 2020) determinando resistencia a por lo menos un antibiótico y multidrogoresistencia a más de tres antibióticos usados en tratamientos contra salmonelosis no tifoideas en humanos (Quesada et al., 2016; Ríos et al., 2019; Elkenany et al., 2019; García et al., 2019; Jaja et al., 2019; Quino et al., 2020), así como de gastroenteritis donde se requiere un tratamiento antibiótico (Soto, 2019).
Por otro lado, el uso no adecuado de antibióticos como promotores de crecimiento en animales (Sánchez-Silva et al., 2014) o en tratamientos farmacológicos sin supervisión veterinaria favorece la diseminación de cepas bacterianas resistentes a antibióticos, incluso en calidad de cepas multidrogoresistentes (MDR) a través de la cadena alimentaria (Ríos, 2018; Jaja et al., 2019; Quino et al., 2020).
La Organización Mundial de la Salud (OMS) presentó en 2015 el "Plan de acción mundial sobre la resistencia a los antimicrobianos" que enfatiza la estrecha relación entre salud pública, seguridad alimentaria y sanidad animal (OMS, 2015).Además, expone como objetivos la realización de programas de concientización sobre la resistencia antimicrobiana, la vigilancia epidemiológica e investigación de cepas resistentes, el desarrollo de programas de higiene y desinfección que disminuyan la incidencia de casos y el uso correcto de antimicrobianos en animales y humanos.
El reporte del aislamiento de Salmonella enterica en canales de cuyes es limitada (Cayro, 2013; Soriano, 2020) y la evaluación de su resistencia frente a antibióticos no ha sido estudiada. Por ende, es pertinente el estudio de las cepas de Salmonella enterica y su resistencia antibiótica en canales de cuyes comercializados en un mercado de abasto en Lima, Perú.
MATERIALES Y MÉTODOS
Localización
Las muestras se recolectaron durante el periodo de agosto a setiembre de 2021 en el Mercado Megacentro Caquetá, uno de los mercados de abasto más importantes de Lima, ubicado en el Cercado de Lima, Perú. Las muestras fueron procesadas en el Laboratorio de Microbiología y Microscopía de la Universidad Científica del Sur, Lima.
Tamaño muestral y Animales
El número de muestras necesarios para el estudio fue determinado mediante la fórmula de poblaciones no finitas o desconocidas (EpiTools Epidemiological Calculators, 2019), determinando que se trabaje con 384 canales de cuyes (Cavia porcellus).
Los cuyes eran machos de aproximadamente tres meses de edad, sin lesiones ni signos visibles de enfermedad que eran faenados, eviscerados y puestos en expendio en el Mercado Megacentro Caquetá. Para el muestreo se utilizó el método de arrastre, donde con un hisopo estéril se frotó 10 veces en dirección horizontal y vertical la cara interna de la canal abarcando la zona abdominal y torácica, así como la cara externa de la canal.
El muestreo se realizó en 4 días de colecta con 2 semanas entre colecta y colecta, muestreando alrededor de 100 canales por vez. Las muestras fueron transportadas en tubos Falcon estériles con medio de transporte Stuart en condiciones de refrigeración (4°C) hacia el laboratorio donde fueron procesadas de inmediato.
Aislamiento e Identificación Bacteriana
Para el aislamiento de Salmonella enterica se utilizó la metodología descrita en la Norma ISO 6579 (2002) "Microbiology of food and animal feeding stuffs - Horizontal method for the detection of Salmonella spp" (ISO, 2002).
Enriquecimiento selectivo: Las muestras fueron procesadas en dos tiempos: enriquecimiento estándar y enriquecimiento tardío. El enriquecimiento tardío provee nutrientes del medio selectivo durante un mayor número de días, dando oportunidad de crecimiento y reproducción a las cepas dañadas logrando en consecuencia una mayor tasa de recuperación (Mitchell y Shane, 2001). Para el enriquecimiento estándar las muestras se inocularon en tubos con 4 ml de caldo Rappaport-Vassiliadis y se incubaron a 37 °C por 24 h. Para el enriquecimiento tardío, el caldo Rappaport-Vassiliadis remanente del enriquecimiento estándar fue conservado por 5 d en condiciones ambientales. Seguidamente, se tomó 1 ml del caldo y se inoculó sobre un nuevo tubo con 4 ml de caldo Rappaport-Vassiliadis e incubado nuevamente a 41 °C por 24 h. Posteriormente fueron sembradas en agar xilosa lisina desoxicolato (XLD).
Cultivo bacteriano: La muestra enriquecida fue sembrada por agotamiento en agar XLD e incubada a 37 °C por 24 h hasta obtener colonias compatibles.
Identificación bacteriana: Las colonias compatibles con Salmonella enterica fueron sometidas a pruebas bioquímicas, considerándose positivas las colonias capaces de fermentar glucosa, pero no lactosa ni sacarosa, descarboxilar lisina, utilizar citrato como fuente de nitrógeno para la formación de amoniaco, producir H2S a partir de tiosulfato de sodio, ser móviles, producir gas y carecer de enzimas ureasa y triptofanasa. Las muestras positivas fueron aisladas en criovales y almacenadas a temperatura de refrigeración.
Perfil de Resistencia Antibiótica
El perfil de resistencia antibiótica se realizó mediante el método de disco difusión en placa (Kirby-Bauer). Las colonias bacterianas positivas a Salmonella enterica fueron suspendidas en suero fisiológico hasta obtener una turbidez de 0.5 ml en la escala McFarland, luego se sembraron en agar Mueller-Hinton y finalmente se enfrentaron a 16 discos antibióticos: ácido nalidíxico (30 µg), ciprofloxacina (5 µg), cloranfenicol (30 µg), enrofloxacina (5 µg), estreptomicina (300 µg), gentamicina (10 µg), fosfomicina (50 µg), amoxicilina con ácido clavulánico (20 µg), nitrofurantoína (300µg), furazolidona(100µg), tobramicina (10 µg), ceftazidima (30 µg), cefotaxima (30 µg), ceftriaxona (30 µg), sulfametoxazol-trimetoprima (25 µg) y ampicilina (10 µg).
Los discos antibióticos evaluados fueron seleccionados debido a reportes de sensibilidad, resistencia y multidrogoresistencia de colonias de S. enterica aisladas en cuyes y humanos (Matsuura et al., 2010; Quesada et al., 2016; Morales-Cauti, 2018; Salvatierra et al., 2018; Elkenany et al., 2019; García et al., 2019; Jaja et al., 2019; Ríos et al., 2019; Soto, 2019; Huamán et al., 2020; Quino et al., 2020). Las placas fueron incubadas a 37 °C por 24 h y los halos de inhibición se interpretaron según las recomendaciones de la Clinical and Laboratory Standards Institute (CLSI, 2012) y el European Committee on Antimicrobial Susceptibility Testing (EUCAST, 2021).
RESULTADOS
Se aislaron cepas de Salmonella enterica en el 28.9 ± 4.5% (111/384) de las canales. El perfil de resistencia antibiótica se realizó en todas las cepas de S. enterica aisladas. El 84.7% (94/111) mostró resistencia al menos a 1 de los 16 antibióticos evaluados. Se reporta resistencia frente a ácido nalidíxico 46.8% (52/111), cloranfenicol 46.8% (52/111), sulfametoxazol-trimetoprima 39.6% (44/111) y amoxicilina + ácido clavulánico 12.6% (14/111). Todas (111/111) las cepas fueron sensibles a estreptomicina. La mayoría de las cepas mostraron sensibilidad a cefotaxima, ceftazidima, ceftriaxona y enrofloxacina (Figura 1).
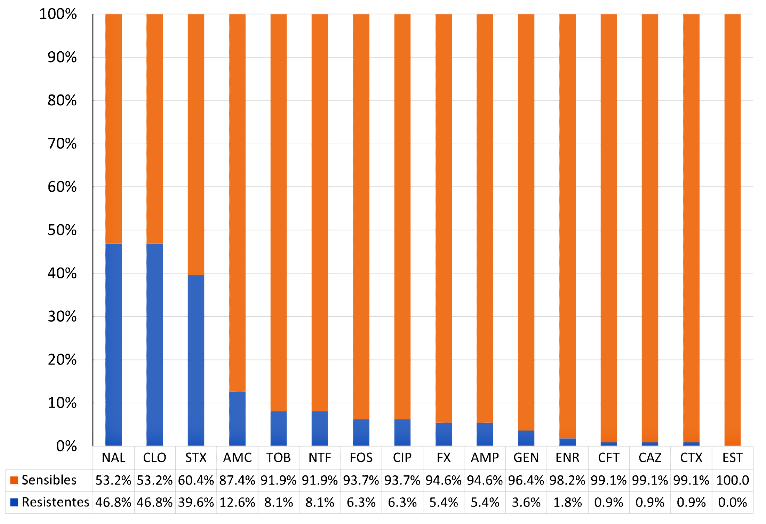
NAL: ácido nalidíxico; CLO: cloranfenicol; STX: sulfametoxazol/trimetoprima;AMC: amoxicilina + ácido clavulánico; TOB: tobramicina; NTF: nitrofurantoína; FOS: fosfomicina; CIP: ciprofloxacina; GEN: gentamicina;AMP: ampicilina; FX: furazolidona; ENR: enrofloxacina; CFT: ceftriaxona; CAZ: ceftazidima; CTX: cefotaxima; EST: estreptomicina
Figura 1 Perfil de resistencia antibiótica de cepas de Salmonella enterica en canales de cuyes en un mercado de abasto en Lima (2021)
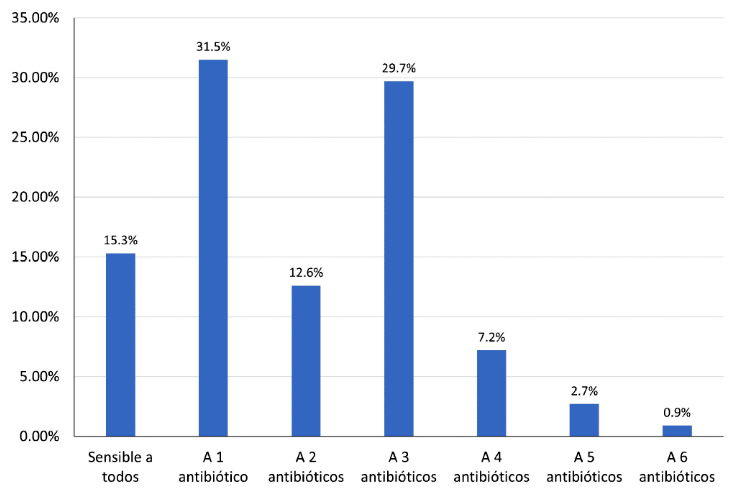
El 31.5% (35/111) de las cepas mostró resistencia a 1 antibiótico, 12.6% (14/111) a 2 antibióticos y 40.5% (45/111) mostró su condición de MDR, entre ellos ceftazidima, cefotaxime, ceftriaxona, cloranfenicol, ácido nalidíxico, fosfomicina y ampicilina (Figura 2).
DISCUSIÓN
El 28.9 ± 4.5% (111/384) de cepas positivas a Salmonella enterica aislados en esta investigación difiere de lo reportado por Soriano (2020), quién utilizando la misma metodología de muestreo en el mismo lugar de estudio aisló solo 5.1 ± 2.2% (20/393) de cepas positivas en la canal externa e interna de cuyes (Cavia porcellus) en expendio. El incremento en el número de muestras positivas en esta investigación sugiere como posibles causas: el faenamiento de animales infectados, el pobre manejo de la higiene, limpieza y desinfección del área de faenamiento, errores durante la etapa de evisceración y deficiencia de los programas de vigilancia y control que limiten la contaminación de las canales en los mercados de abasto. Sin embargo, el aislamiento de Salmonella enterica en órganos de cuyes aparentemente sanos y enfermos reportada por otros autores demuestra que existe mayor probabilidad de exposición a la infección previo al proceso de manufactura (Salvatierra et al., 2010; Matsuura et al., 2010; Ayala, 2018; Huamán et al., 2020).
Se reconoce como principal nicho de la Salmonella al tracto intestinal, por lo que la fuente de contaminación de estas canales sería de tipo fecal, donde la eliminación de esta bacteria puede ser intermitente, esporádica o constante, producto de la relación de las diferentes cepas de Salmonella y los diferentes hospedadores que infectan (Andino y Hanning, 2015; Crump et al., 2015), mostrando amplias variaciones de prevalencias de serotipos en diferentes animales de consumo, ubicación, y otras variables externas al serovar de Salmonella en estudio (Pavon et al., 2022).
Respecto al perfil de resistencia antibiótica, el presente estudio reporta 84.7% de los aislados como resistentes al menos a un antibiótico de los evaluados. Si bien Huamán et al. (2020) reportaron 100% de aislados de S. enterica provenientes de cuyes de crianza intensiva, como resistente al menos a un antibiótico enfrentado, dicha evaluación no se hizo en canales faenados, por lo que no se puede inferir una disminución del porcentaje de cepas de Salmonella enterica resistentes a antibióticos. Por el momento, no se han reportado investigaciones que evalúen el perfil de resistencia antibiótica en similares condiciones que puedan ser comparadas con los resultados obtenidos.
La sensibilidad frente a ácido nalidíxico (53.2%) de las cepas de S. enterica aisladas es inferior a la reportada por Caballero (2015) y Soto (2019), quienes reportaron sensibilidad superior al 70% en muestras obtenidas por hisopado rectal en cuyes asintomáticos y en linfonódulos mesentéricos de canales en expendio, respectivamente. El aislamiento de cepas resistentes a ácido nalidíxico (46.8%) en esta investigación supone que la susceptibilidad a las quinolonas se encuentra en descenso, posiblemente por el uso indiscriminado de estos antibióticos como promotores de crecimiento o por su uso rutinario en el tratamiento de salmonelosis en cuyes (Sánchez-Silva et al., 2014; Salvatierra et al., 2018; Soto, 2019). La resistencia a quinolonas representa un grave problema para la salud pública dado que es la familia antibiótica de elección en el tratamiento de salmonelosis no tifoideas en personas adultas (Cabrera, 2008). Sin embargo, este estudio aisló cepas sensibles a ciprofloxacina (93.7%) y enrofloxacina (98.2%), lo que coincide con Matsuura et al. (2010) y Salvatierra et al. (2018), quienes reportaron aislados de S. enterica en vísceras de cuyes 100 % sensibles a enrofloxacina y ciprofloxacina, respectivamente.
Según Cabrera (2008), antibióticos como cloranfenicol, sulfametoxazol-trimetoprima, amoxicilina + ácido clavulánico y ampicilina también pueden ser utilizados en casos de salmonelosis en humanos; sin embargo, el presente estudio reporta resistencias del 46.8, 39.6, 12.6 y 5.4%, respectivamente.
La resistencia frente a amoxicilina + ácido clavulánico coincide con la reportada por Huamán et al. (2020), aunque difiere del 100% de sensibilidad reportada por Matsuura et al. (2010) y Salvatierra et al. (2018). Lo alarmante del aislamiento de cepas resistentes a amoxicilina + ácido clavulánico (12.6%) y ampicilina (5.4%) es que ambas están contraindicadas en el tratamiento de cuyes con salmonelosis por la toxicidad que generan en la microbiota intestinal que acarrea cuadros de enterocolitis y muerte (Matsuura et al., 2010; Salvatierra et al, 2018).
En los casos de salmonelosis no tifoideas en infantes, las cefalosporinas de tercera generación como cefotaxima, ceftazidima y ceftriaxona son los antibióticos mayormente utilizados (Bradley, 2021). Los hallazgos de esta investigación evidencian que más del 98% de las cepas enfrentadas fueron sensibles a estos antibióticos, permitiendo suponer que todavía poseen eficacia terapéutica en pacientes enfermos. Por otro lado, Soto (2019) reporta 100% de cepas sensibles a ceftriaxona e indica que es el antibiótico de elección en cuyes con cuadros de salmone-losis sistémicas donde otros antibióticos no son eficaces.
La resistencia a sulfametoxazol-trimetoprima en el 39.6% (44/111) de las cepas aisladas coincide con la resistencia reportada por Huamán et al. (2020), pero difiere de los resultados de otros investigadores quienes reportaron una sensibilidad del 100% de cepas de S. enterica provenientes de órganos, hisopados rectales y muestras fecales de cuyes asintomáticos y clínicamente enfermos (Matsuura et al., 2010; Caballero, 2015; Morales-Cauti et al., 2018; Salvatierra et al., 2018; Soto, 2019). Estos hallazgos sugieren la aparición e incremento de la resistencia antibiótica de aislados de S. enterica frente a antibióticos en los que previamente se observaba sensibilidad. Además, el 46.8% (52/ 111) de las cepas aisladas fue resistente a cloranfenicol fue superior al 35.7% (15/42) reportado por Morales-Cauti et al. (2018) en cuyes clínicamente enfermos e inferior al 97% de sensibilidad reportada por Matsuura et al. (2010).
Contraria a la resistencia frente a nitrofurantoína reportada por Salvatierra et al. (2018) en el 40% (8/20) de muestras obtenidas de hígado de cuyes con salmonelosis, esta investigación reporta sensibilidad a dicho antibiótico en el 91.9% (102/111) de las cepas. Por otro lado, el 94.6% de sensibilidad a furazolidona se asemeja al 85% reportado por Matsuura et al. (2010). La sensibilidad de las cepas frente a furazolidona puede deberse a que no es usado como promotor de crecimiento y a que es un antibiótico poco utilizado en casos de salmonelosis en cuyes.
A pesar de que el uso de cloranfenicol y nitrofuranos como furazolidona y nitrofurantoína en animales de consumo humano ha sido prohibido en Perú desde el 2013 debido a su actividad carcinogénica (MINAGRI, 2013), el aislamiento de cepas resistentes en este estudio sugiere que el uso de estos antibióticos en la crianza de cuyes sigue activo; inclusive incluso se platea su uso en manuales de producción de cuyes debido a su bajo costo (Soto, 2019).
La sensibilidad reportada a gentamicina (96.4%) es similar a la reportada por Matsuura et al. (2010), Morales-Cauti (2018) y Soto (2019) en muestras de cuyes asintomáticos y clínicamente enfermos. Este antibiótico es, no obstante, de uso común en casos de salmonelosis en cuyes. Por otro lado, el 100% de cepas sensibles a estreptomicina puede justificarse por la concentración del disco utilizado (300 µg), ya que la concentración de estreptomicina comúnmente utilizada es de 10 µg, como en el estudio realizado por Salvatierra et al. (2018) donde se obtuvo resistencia en el 30% de las cepas analizadas.
El aislamiento de cepas resistentes a tres o más antibióticos (multidrogoresistentes, MDR) (40.5%) como ceftazidima, cefotaxima, ceftriaxona, cloranfenicol, ácido nalidíxico, fosfomicina y ampicilina se asemeja a lo reportado por Salvatierra et al. (2018) y Huamán et al. (2020), y genera preocupación, ya que son de uso común en salmonelosis no tifoideas en humanos (Cabrera, 2008). Cabe destacar que el uso no controlado de antibióticos favorece la proliferación de cepas bacterianas con condiciones de resistencia antibiótica, disminuyendo la efectividad de alternativas terapéuticas en humanos y animales, además de generar cepas MDR (Jaja et al., 2019; Quino et al., 2020).
CONCLUSIONES
El 28.9 ± 4.53% (111/384) de cepas positivas a Salmonella enterica aisladas en la canal de cuyes (Cavia porcellus) comercializadas en el Mercado Megacentro Caquetá de Lima confirma el peligro al que es expuesto el consumidor y la importancia de establecer lineamientos de seguridad alimentaria que regulen la presencia de microorganismos en los alimentos.
Las cepas de S. enterica evaluadas mostraron resistencia en al menos un antibiótico. Cerca de la mitad de los aislados mostraron resistencia frente al ácido nalidíxico, cloranfenicol y sulfametoxazol-trimetoprima.












 uBio
uBio