INTRODUCCIÓN
El aumento de patógenos bacterianos resistentes a antibióticos se ha convertido en un problema grave de salud pública a nivel mundial (Munita y Arias, 2016). Esto incluye a los patógenos transmitidos por alimentos que han desarrollado resistencia antimicrobiana (O'Bryan et al., 2018). Uno de estos microrganismos es Staphylococcus aureus, que suele estar presente en las superficies externas del cuerpo del humano y especies animales, sea como comensal o patógeno, por lo que tiene el potencial de causar múltiples enfermedades infecciosas (Weese y Duijkeren, 2010). S. aureus también es un importante agente causal de enfermedades transmitidas por alimentos (Seo y Bohach, 2013), y puede ser transmitido por diversos productos como la carne de ave (Weese y Duijkeren, 2010; Ribeiro et al., 2018). En las últimas décadas, debido a la evolución de esta bacteria y al abuso de los antibióticos, S. aureus ha mostrado un aumento gradual de su resistencia a los fármacos, generando cepas peligrosas como S. aureus resistente a la meticilina (Guo et al., 2020). Sudamérica registra la mayor prevalencia en el mundo de cepas S. aureus resistentes, lo cual implica a la carne de ave como un latente riesgo para la salud pública (Ribeiro et al., 2018).
En los alimentos, el crecimiento de S. aureus y otros patógenos se ha limitado por el empleo de sustancias químicas conocidas como preservantes o conservantes (Faleiro, 2011; Abu-Ghazaleh, 2013; Aminzare et al., 2014). Sin embargo, el uso de conservantes químicos ha tenido consecuencias negativas en la salud de los consumidores, de allí que la industria alimentaria está en la búsqueda de compuestos naturales con propiedades similares (Fratianni et al., 2010; Kumari et al., 2019). Los conservantes naturales que comúnmente se utilizan son los extractos de plantas, chitosán, bacteriocinas, péptidos bioactivos y aceites esenciales, entre otros (Olatunde y Benjakul, 2018).
Los aceites esenciales son complejos compuestos naturales y volátiles producidos por plantas aromáticas (Bakkali et al., 2008). Su aplicación como aditivos alimentarios es una alternativa natural que ha demostrado actividad antimicrobiana frente a patógenos transmitidos por alimentos (Burt, 2004). Esta actividad antimicrobiana no puede atribuirse a un único mecanismo de acción, debido a la gran variedad de compuestos presentes en los aceites esenciales (Burt, 2004); por lo que, en general, se cree que componentes como los terpenos, terpenoides, fenilpropenos, y algunos otros, como la alicina y los isotio-cianatos, son los que tienen la mayor actividad antimicrobiana (Gavahian et al., 2020).
El aceite esencial de orégano presenta compuestos antimicrobianos de tipo terpenoides como el timol y carvacrol, y puede ser aplicado en los alimentos con el fin de inhibir el crecimiento de S. aureus, suprimiendo además la síntesis de enterotoxinas estafilocócicas (de Souza et al., 2010; Cui et al., 2019). Por ello, el objetivo del presente estudio fue evaluar la actividad antimicrobiana del aceite esencial de orégano (Origanum vulgare) frente a Staphylococcus aureus ATCC 25923 en carne de pollo.
MATERIALES Y MÉTODOS
Aceite Esencial de Orégano
Se utilizó un aceite esencial de orégano extraído previamente por el Laboratorio de Salud Pública y Salud Ambiental de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos (FMV-UNMSM), Lima, Perú. El orégano (Origanum vulgare) fresco provenía del departamento de Junín. El proceso de extracción del aceite esencial de orégano (AO) y su composición química determinada mediante cromatografía de gases acoplado a espectrometría de masas ha sido previamente publicado (Carhuallanqui et al., 2020).
Cepa de Staphylococcus aureus
La cepa de Staphylococcus aureus ATCC 25923 (Microbiologics, Francia) fue cultivada en Agar Tripticasa soya (TSA) a 37 °Cpor 24h.
Ensayo de Difusión en Disco (DDA)
La evaluación preliminar de la actividad antimicrobiana del AO se realizó mediante el DDA. Se sembró un inóculo de la cepa de S. aureus, previamente ajustado a una turbidez de 0.5 ml en la escala de McFarland, con un hisopo estéril sobre toda la superficie del agar Müeller-Hinton (García et al., 2000). Posteriormente, discos de AO a 13 concentraciones (0.01, 0.03, 0.06, 0.12, 0.25, 0.5, 1, 2, 4, 8, 16, 32 y 100%) fueron colocados sobre la superficie del agar. Finalmente, se incubaron a 37 °C por 24 h y se midió el halo de inhibición que rodeaba a cada disco. Esta evaluación se realizó por triplicado. Según Espina et al. (2011), la actividad antimicrobiana del AO se clasifica como no inhibitoria cuando los halos son menores a 10 mm.
Concentración Mínima Inhibitoria (CMI)
La CMI es la menor concentración de AO que inhibe el crecimiento bacteriano y se determinó mediante microdiluciones en microplacas estériles de 96 pocillos, según lo descrito por García et al. (2000) y Sharafati Chaleshtori y Sharafati Chaleshtori (2017). Es decir, se añadió 95 µl de Caldo Soja Tripticaseína (TSB) a trece pocillos de una misma fila, al primer pocillo de esa fila se le agregó 100 µl del AO a una concentración del 32% y a partir de este se realizaron diluciones seriadas 1:2 hasta el pocillo 12, el pocillo 13 fue el control positivo (no contenía AO). Posteriormente, se añadió un inóculo bacteriano de 5 µl a cada pocillo, resultando en una población microbiana final de 5 x 104 bacterias/pocillo. Finalmente, las microplacas se incubaron a 37 °C por 22 h. Para evidenciar la variación en la turbidez se determinaron las densidades ópticas mediante un espectrofotómetro a 450 nm a las 0 y 22 h (Sharafati Chaleshtori y Sharafati Chaleshtori, 2017).
Concentración Mínima Bactericida (CMB)
La CMB se realizó mediante la determinación de la supervivencia de las bacterias expuestas a las concentraciones de AO. Para ello, se tomó una muestra de 10 µl de cada pocillo utilizado en la prueba del CMI, incluyendo el control, y se sembró en placas con agar Baird Parker (Boskovic et al., 2015). Las placas se incubaron a 37 °C por 24 h, y se observó el crecimiento de colonias redondas de color negro brillante, típicas de S. aureus. La concentración más baja de AO en la que no se observó desarrollo bacteriano se denominó CMB.
Actividad Antimicrobiana en Carne de Pollo
Se adquirieron pechugas de pollo del mercado del distrito de San Luis, Lima, que fueron colocadas en bolsas de polietileno de primer uso y transportadas al Laboratorio de Salud Pública y Salud Ambiental de la FMVUNMSM en una caja térmica conteniendo geles refrigerantes (4 °C). La carne fue lavada con agua corriente y se realizaron cortes asépticos para obtener filetes de aproximadamente 25 g, que fueron sometidos a radiación ultravioleta por 25 min. Se descartó la presencia de S. aureus mediante siembra en agar Baird Parker, y se evalúo la presencia de residuos de antimicrobianos mediante el test microbiológico conocido como "prueba in situ con torundas" (prueba stop), siguiendo el protocolo descrito por Moreno (2003) usando como indicador la cepa de S. aureus ATCC 25923.
Se inoculó 1 ml de cada concentración de AO (0.01, 0.03, 0.06, 0.12, 0.25, 0.5, 1, 2, 4, 8, 16, 32%) diluido con Tween 80, similar a lo descrito por Sharafati Chaleshtori y Sharafati Chaleshtori (2017), sobre las superficies de los filetes, con excepción de las muestras control. De forma similar, todas las muestras fueron contaminadas directamente con un inóculo de 1 ml de S. aureus ATCC 25923 conteniendo aproximadamente 2.5 x 105 bacterias/ml, consiguiendo en los filetes una carga microbiana de aproximadamente 104 UFC/g (4.4 Log UFC/g). Las muestras contaminadas fueron envasadas a vacío (Selladora Foodsaver V2240) en bolsas estériles de polietileno y se mantuvieron a temperatura ambiente (aproximadamente 20 °C) por 2 h, simulando un abuso de temperatura durante el traslado desde el lugar de expendio al domicilio, y a 4 °C durante 12 h, como un tiempo probable de almacenamiento antes de su uso a nivel doméstico. Luego, se realizaron los recuentos microbiológicos por duplicado. Para ello, se homogenizó 25 g de la muestra con 225 ml de agua peptonada al 0.1% y se realizaron diluciones decimales hasta obtener concentraciones de 10-2 y 10-3. Las diluciones se sembraron en agar Baird Parker y tras su incubación a 37 °C por 45 h se realizaron los recuentos de S. aureus según lo descrito por Da Silva et al. (2019), con un nivel de detección de 2 Log UFC/g.
Análisis Estadístico
Los recuentos se expresaron como Log UFC/g. Las reducciones decimales alcanzadas en la carga de S. aureus de los filetes de pollo se obtuvieron de restar el valor del recuento de la muestra control (sin tratamiento) del recuento obtenido en cada muestra. Se realizó la prueba de Shapiro-Wilk para evaluar la normalidad de los datos. Se hizo el análisis de varianza y comparaciones múltiples de Tukey para determinar el efecto de la concentración de AO sobre las reducciones decimales alcanzadas. Los análisis se realizaron con el software IBM SPSS Statistics v. 23.0 para Windows (SPSS Inc., USA).
RESULTADOS
El AO mostró actividad antimicrobiana contra S. aureus en la prueba de difusión en disco en concentraciones ≥ 16% (Cuadro 1).
Cuadro 1 Resultados del ensayo difusión en disco de diferentes concentraciones del aceite esencial de orégano (Origanum vulgare) en un cultivo de Staphylococcus aureus ATCC 25923
| AO (%) | Zona de inhibición (mm) |
|---|---|
| 100 | 26 |
| 32 | 12 |
| 16 | 10 |
| ≤8 | <10 |
AO: Concentración del aceite esencial de orégano
El Cuadro 2 muestra la turbidez generada por el crecimiento bacteriano a través de la variación de las densidades ópticas (DO) tomadas a las 0 y 22 h de incubación. Las DO fueron mayores a las 22 h comparado con las 0 h en las concentraciones de AO de 0.01% hasta 0.25%, por lo que se consideró como CMI a la concentración de 0.5%. Asimismo, el AO de orégano demostró poseer un efecto bactericida a concentraciones de 32, 16, 8 y 4, puesto que no se observó crecimiento de S. aureus, considerándose, por lo tanto, que el CMB fue de 4%.
Cuadro 2 Densidades ópticas de las pruebas de concentración mínima inhibitoria (CMI) del aceite esencial de orégano (Origanum vulgare) sobre el crecimiento de Staphylococcus aureus ATCC 25923
| AO (%) | Densidad óptica | |
|---|---|---|
| 0 h | 22 h | |
| 32 | 0.21 | 0.20 |
| 16 | 0.21 | 0.19 |
| 8 | 0.20 | 0.17 |
| 4 | 0.17 | 0.16 |
| 2 | 0.17 | 0.16 |
| 1 | 0.17 | 0.16 |
| 0.5 | 0.16 | 0.16 |
| 0.25 | 0.15 | 0.26 |
| 0.12 | 0.16 | 0.33 |
| 0.06 | 0.14 | 0.32 |
| 0.03 | 0.16 | 0.41 |
| 0.01 | 0.15 | 0.39 |
| Control | 0.14 | 0.40 |
AO: Concentraciones de aceite esencial de orégano
En general, todas las concentraciones de AO de 1% a más lograron reducir de forma significativa los recuentos de S. aureus en la carne de pollo (Figura 1). La muestra control presentó un recuento de 4.48±0.08 Log UFC/g, por lo que el efecto del manejo de tiempo y temperatura tras la inoculación y previo al recuento no fue significativo. En las muestras tratadas con 32 y 16% de AO no se detectó la cepa patógena inoculada, por lo que el tratamiento habría reducido los recuentos en al menos 2.5 Log UFC/g, considerando que el nivel de detección de la metodología es de 2 Log UFC/g. Los recuentos obtenidos en las muestras tratadas con 8, 4, 2 y 1% fueron 4.18±0.2, 4.30±0.1, 4.18±0.1 y 4±0.2 Log UFC/g, respectivamente, por lo que las reducciones decimales obtenidas oscilaron entre 0.5 a 0.2 Log UFC/g. Los recuentos obtenidos en las muestras tratadas con concentraciones 0.5, 0.25 y 0.125% no mostraron diferencias significativas respecto al control.
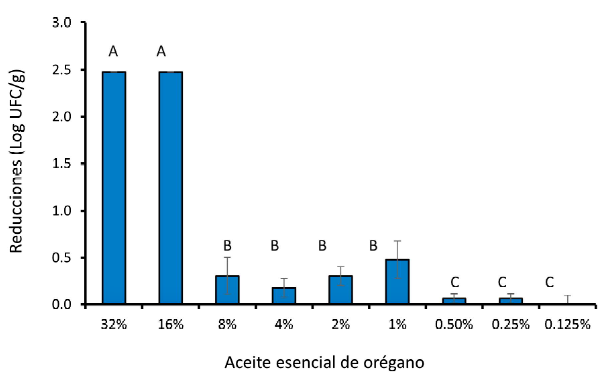
Figura 1 Reducciones (Log UFC/g) en la carga microbiológica de Staphylococcus aureus ATCC 25923 de filetes de pollo tratados con diferentes concentraciones de aceite esencial de orégano. Letras distintas (A, B, C) indican diferencias significativas (p<0.05). Las barras muestran la desviación estándar
DISCUSIÓN
Los resultados evidencian un efecto antimicrobiano del AO frente a S. aureus en carne de pollo. Esta actividad antimicrobiana se debe principalmente al carvacrol y timol del orégano, ya que tienen la capacidad de alterar la permeabilidad de la membrana celular bacteriana, produciendo daño estructural y funcional (Lambert et al., 2001; Burt, 2004; Govaris et al., 2010). Asimismo, se ha descrito que el carvacrol puede alterar la estructura del ADN del S. aureus, afectando con ello la replicación, transcripción y traducción del ADN (Cui et al., 2019). Además, el AO puede causar en S. aureus la inhibición del ciclo del ácido tricarboxílico y sus enzimas clave (Cui et al., 2019). Carhuallanqui et al. (2020) determinaron que el orégano del que se extrajo el AO utilizado en este estudio presentaba 11.9 y 1.7% de timol y carvacrol, respectivamente.
La composición química del AO explica en gran medida la intensidad de su efecto antimicrobiano. Así, los valores altos de CMI y CMB se pueden relacionar de forma inversa con los niveles de carvacrol y timol del AO empleado. Por ejemplo, Ortega (2018) obtuvo una CMI de 0.12% del AO frente a S. aureus, menor a la obtenida por este estudio, pero la composición del AO usado por estos autores presentaba una alta concentración de carvacrol (73.3%).Asimismo, Nostro et al. (2007) reportaron una CMI de 0.060.12% en aislados de S. aureus proveniente de infecciones oculares, empleando un AO con 14% de carvacrol y 24.7% de timol. Lu et al. (2018) obtuvieron un CMI de 0.32% en aislados clínicos de S. aureus resistentes a la metacilina, cuando las enfrentaron a un AO con 6.6 y 72.3% de timol y carvacrol, respectivamente. Man et al. (2019) describieron una CMI de 0.4% contra S. aureus, similar al obtenido en este estudio (0.5%), pero con un AO conteniendo 80.5% de carvacrol. Por tanto, si bien el timol y carvacrol son los componentes del AO que son determinantes en su actividad antimicrobiana, no se puede descartar el posible efecto sinérgico que pueden presentar otros componentes delAO (Ultee et al., 2002; Burt, 2004; Gavahian et al., 2020).
La CMB 4% del presente estudio es similar al reporte de Oyarzabal et al. (2011), quienes evaluaron la acción antimicrobiana del AO frente a bacterias aisladas de la leche bovina y cepas estándares ATCC de S. aureus. Estos autores emplearon orégano de origen peruano y reportaron una baja concentración de carvacrol y timol en su AO.
Las condiciones medioambientales como el clima o la altitud pueden influenciar en la cantidad y la calidad de los componentes de la planta, asimismo, el método de extracción del AO puede afectar a estos componentes (Arcila-Lozano et al., 2004; Reyes-Jurado et al., 2015). Según Simirgiotis et al. (2020), el carvacrol puede constituir del 12.6 al 88.7% en el AO, en tanto que Sakkas y Papadopoulou (2017) indican que el timol puede presentarse hasta en 64%. Sin embargo, Tellez y Nolazco (2017) encontraron concentraciones bajas de carvacrol (2.24%) y timol (18.8%) en AO proveniente de plantas de Tacna (Perú). Por otro lado, Tellez (2017) analizó seis ecotipos de AO provenientes de Cusco (Perú) determinando concentraciones menores de carvacrol (0.20-2.04%) y timol (2.3-18.3%), atribuyendo estos valores al estrés hídrico de la planta cultivada a más de 3000 msnm. El orégano empleado en el presente estudio provino de la región de Junín, lugar con similar altitud a la zona del estudio de Tellez (2017), lo que podría explicar las concentraciones similares de carvacrol y timol. Otros estudios también reportan bajos niveles de carvacrol y timol (Asensio, 2013; Simirgiotis et al., 2020).
En el presente estudio, se simuló un manejo deficiente de la temperatura (20 °C) durante el traslado de los filetes de pollo desde el lugar de expendio hacia el domicilio. Este manejo no influyó significativamente sobre los recuentos microbianos, ya que tanto el inóculo como las muestras control presentaron cantidades similares (4.4 Log UFC/g). Rodriguez-Caturla et al. (2012) describieron que la constante específica de velocidad de crecimiento máxima de S. aureus en carne de pollo a 20 °C es de 0.04-0.16. Considerando estas condiciones, el crecimiento de este microorganismo durante 2 h oscilaría entre 0.03-0.13 Log UFC/g. Así mismo, Chaichi et al. (2021) determinaron crecimientos menores a 0.1 Log UFC/g de S. aureus en pechugas de pollo cuando se almacenaron a 37 °C durante 2 h. Por otro lado, el almacenamiento durante 12 h a 4 °C no tendría repercusión sobre los recuentos, ya que S. aureus no es capaz de crecer en refrigeración (Seo y Bohach, 2013).
La aplicación de AO a los filetes de pollo contaminados con S. aureus ATCC 25923 disminuyó los recuentos microbianos de esta bacteria, siendo los efectos antimicrobianos más significativos en las concentraciones más altas. Al respecto, Pesavento et al. (2015) consiguieron reducciones <2 Log UFC/g de S. aureus con concentraciones de 0.5-2% de AO en albóndigas de vacuno, AO que contenía 71.8% de carvacrol. Asimismo, Dos Santos Rodrigues et al. (2017) obtuvieron reducciones de 1-2 log UFC/ml en los recuentos de S. aureus en superficies de acero inoxidable usando AO en concentraciones de 0.25 y 0.125% (67% de carvacrol y 16% de timol). En general, se describe que los aceites esenciales y otros conservantes naturales consiguen un efecto bactericida entre 1-4 Log UFC/g contra bacterias transmitidas por alimentos cuando son aplicados en carne y productos cárnicos (Yu et al., 2021).
Para que S. aureus produzca enterotoxinas en cantidades capaces de causar enfermedad en el hombre, es necesario que alcance una concentración mayor a 5 Log UFC/g (ICMSF, 2002; Erkmen y Bozoglu, 2016). Además, Staphylococcus aureus suele estar presente en pequeñas cantidades en los alimentos, y en los casos más desfavorables se estima que presentaría cantidades máximas de 4 Log UFC/g, las cuales se mantienen constantes si los alimentos son almacenados en refrigeración (Seo y Bohach, 2013). Por tanto, la aplicación de AO en las concentraciones utilizadas en este estudio no garantizaría la higienización completa la carne de pollo. A pesar de ello, la aplicación de AO en proporciones desde tan solo 1% reduce las cantidades de este microorganismo, pudiendo usarse como una alternativa a los conservantes y para actuar de forma sinérgica junto con otros tratamientos.












 uBio
uBio 


