INTRODUCCIÓN
En la última década la porcicultura nacional está alcanzando un importante desarrollo productivo debido a mayores inversiones en tecnología y genética a través de la importación de germoplasma y razas mejoradas, principalmente en la costa peruana que alberga el 32.8% de granjas tecnificadas del país (MINAGRI, 2021). Sin embargo, este desarrollo está siendo afectado por agentes virales que merman la productividad del cerdo como el virus de Influenza A (VIA), una zoonosis causante de la enfermedad respiratoria más importante en humanos y animales (Garten et al., 2009) por las recombinaciones genéticas que existen entre los subtipos que infectan a cerdos, aves y humanos.
El virus de Influenza Aes el agente causal de Influenza Porcina (IP) y forma parte del Complejo Respiratorio Porcino (CRP) junto al virus del Síndrome Reproductivo y Respiratorio Porcino (PRRSv), Circovirus porcino tipo 2 (CVP-2) y Mycoplasma hyoneumoniae, afectando la producción porcina por el aumento en los costos de producción y limitando el potencial de exportación (Schmidt et al., 2015; Pallarés et al., 2020).
El VIA es un virus envuelto que pertenece al género Influenza A de la familia Orthomyxoviridae, posee un genoma de ARN de polaridad negativa y segmentada y se clasifica en subtipos según las diferencias antigénicas de las dos principales glicoproteínas de superficie: Hemaglutinina (H) y Neuraminidasa (N) (ICTV, 2020). La naturaleza segmentada del genoma viral permite la generación de nuevas variantes antigénicas al intercambiar segmentos de ARN durante el proceso de replicación viral cuando dos virus del mismo género infectan de manera conjunta a una misma célula, proceso conocido como ''reordenamiento'' genético (Hurt et al., 2016). En el cerdo, los subtipos más predominantes son el H1N1, H1N2 y H3N2 (Lewis et al., 2016; Wang et al., 2018).
Los cerdos son considerados "recipientes mezcladores" para los virus de la influenza humana, aviar y porcina, debido a que presenta receptores de ácido siálico de unión a la galactosa α2-6 (mamíferos) y α2-3 (aves y equinos) en células epiteliales respiratorias porcinas (De Graaf y Fouchier, 2014). Esta característica molecular del cerdo da lugar a los eventos de reordenamiento genético descritos anteriormente con la posibilidad de ocasionar epidemias y pandemias humanas (Rajao et al., 2019).
Las infecciones por el VIA en el cerdo ocasionan signos clínicos respiratorios como tos, estornudos, descarga nasal, temperatura rectal elevada, letargia y dificultad respiratoria (Torremorell, 2021). Los cerdos infectados comienzan a eliminar el virus dentro de las 24 horas posteriores a la infección, y, por lo general, lo eliminan durante un periodo de 7 a 10 días (OIE, 2021). La ruta principal de transmisión es por contacto directo con secreciones oronasales con títulos de hasta 1x107 partículas infecciosas/ml en el pico de la excreción viral (Zimmerman et al., 2019; Torremorell, 2021).
En el Perú existen escasos estudios sobre la epidemiología del virus de influenza A en cerdos a pesar del rol que juega esta especie dentro de la ecología de la enfermedad y que constituye una de las zoonosis más devastadoras del ser humano. El único trabajo de serología sobre el VIA fue desarrollado por Tinoco et al. (2015), quienes encontraron una prevalencia de 8 y 24% en cerdos de granjas de traspatio durante el pico de la pandemia humana (octubre, 2009) y pos-pandemia (abril, 2010), respectivamente. Ante esto, el objetivo del presente estudio fue determinar la frecuencia de anticuerpos contra el virus de Influenza A en cerdos de los departamentos de Lima, Ica y Arequipa como base para futuros estudios epidemiológicos sobre esta enfermedad.
MATERIALES Y MÉTODOS
Lugar y Colección de Muestras
El estudio se realizó en granjas porcinas tecnificadas de la región Lima, Ica y Arequipa (Perú) con antecedentes de problemas respiratorios como tos, disnea, estornudos, secreción nasal y/o fiebre, durante los años 2020 al 2021.
Las muestras de sangre de los porcinos de diversas edades y sin distinción de sexo fueron colectadas por los médicos veterinarios responsables de cada granja como medida de bioseguridad y restricciones de movimiento causadas por la pandemia del COVID-19. En todos los casos se utilizó el protocolo disponible para toma de muestras sanguíneas en cada predio.
Tamaño Muestral
El número de animales a muestrear (n=281) para cada región (Lima, Ica y Arequipa) se determinó aplicando la fórmula de estimación por proporción (Dhand y Khatkar, 2014). Para esto se utilizó el valor de 24% como prevalencia referencial de influenza A en porcinos (Tinoco et al., 2015), un nivel de confianza de 95% y un error del 5%. En total se procesaron 858 muestras de suero de porcinos.
Las muestras de sangre (5 ml) fueron mantenidas en una caja de tecnopor (poliestireno expandido) con geles refrigerantes hasta su llegada al Laboratorio de Virología de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos en Lima. Las muestras fueron centrifugadas a 70 g por 5 minutos y los sueros resultantes fueron depositados en viales de 2 ml previamente rotulados y congelados a -80 °C hasta su procesamiento.
Detección de Anticuerpos contra Virus Influenza A
Los anticuerpos fueron analizados mediante la prueba de ELISA de bloqueo para la detección de anticuerpos contra la proteína N (nucleoproteína) del virus de influenza A empleando el kit comercial (IDEXX influenza A Ab test, IDEXX, USA), siguiendo las indicaciones del fabricante. La muestra fue considerada positiva a anticuerpos contra el VIA cuando presentó una relación M/N (muestra/control negativo) <0.6 y negativa con un M/N >0.6 (IDEXX, 2020). Se calculó el número de muestras positivas (Thrusfield, 1990) global, así como la frecuencia e intervalo de confianza al 95% de las tres regiones, Lima, Ica y Arequipa (Clopper y Pearson, 1994, Soper, 2022).
La variable edad se categorizó en ocho grupos etarios (0 = hasta 21 días; 1 = 22-35 días; 2 = 36-50 días; 3 = 51-70 días; 4 = 7190 días; 5 = 91-110 días; 6 = 111-132 días; 7 = 133-152 días), y la variable resultados de la prueba ELISA se interpretó como negativo o positivo. La prueba estadística utilizada fue análisis de regresión logística multinomial mediante el programa estadístico R.
RESULTADOS
Del total de animales muestreados, la frecuencia de animales positivos en las granjas tecnificadas de Lima, Ica y Arequipa fue de 24.9% (214/858), con un intervalo de confianza al 95% de 22.0 a 27.8% (Cuadro 1). Se pudo observar que las regiones de Ica y Arequipa tenían una menor ocurrencia de animales positivos respecto a Lima. El análisis de regresión logística para el riesgo de presentación de anticuerpos contra el virus de Influenza A indicó diferencias significativas entre Lima y Arequipa (p<0.003) y entre Lima e Ica (p<0.0002). El Odds Ratio indicó un 75% más riesgo de presentar anticuerpos contra el VIA en Lima con respecto a Arequipa; y Lima de 100% con respecto a Ica.
Cuadro 1 Presencia de muestras positivas a anticuerpos contra el virus de Influenza A (VIA) en Lima, Ica y Arequipa (2020-2021)
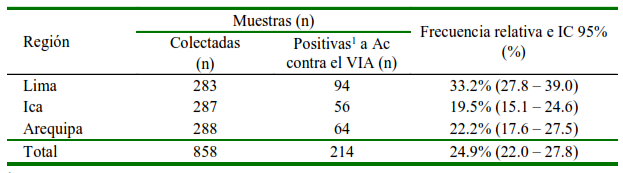
1 Las muestras fueron consideradas positivas a anticuerpos contra el VIA cuando la relación M/N <0.6
La frecuencia de muestras positivas que se muestra en la Figura 1 explica la dinámica de la seropositividad del virus de influenza A en el ganado porcino en las granjas de Arequipa, Ica y Lima con antecedentes de procesos respiratorios. Se observa una mayor frecuencia de animales seropositivos en los grupos etarios más jóvenes con tendencia al descenso con la edad, para volver a subir en los grupos etarios de 71 a 110 días de edad, para luego volver a descender en animales de mayor edad.
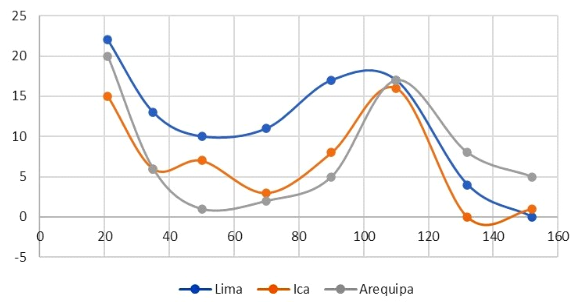
Figura 1 Dinámica de positividad anticuerpos (%) contra el virus de Influenza A en porcinos por región, Perú (2020-2021). Cada representa un grupo etario (≤21, 22-35, 36-50, 5170, 71-90; 91-110, 111-132, 133-152 días)
Siguiendo el mismo criterio, se realizó análisis de regresión logística para comprobar si las diferencias observadas son estadísticamente significativas. Entre los grupos etarios, utilizando el grupo etario 0 (hasta 21 días) como basal por tener la mayor frecuencia de animales positivos, se encontró diferencias significativas con los grupos etarios 1, 2, 3, 4, 6 y 7, a excepción del grupo etario 5 (Figura 1). El análisis de regresión logística mostró que en la región Lima, el grupo etario 0 (hasta 21 días) y 5 (91 a 110 días) tuvo mayor oportunidad de presentar anticuerpos contra el VIA, aunque la edad no se consideró como un factor de riesgo (OR<1).
Al evaluarse las dos variables de interés (región y grupo etario) en un modelo de regresión logística múltiple, donde existe la posibilidad de identificar efectos confundentes a través de sus interacciones, se observa interacciones significativas, de modo que la frecuencia de enfermedad dentro de los grupos etarios no fue igual en las tres regiones.
DISCUSIÓN
La población de porcinos en el Perú fue de 3 265 145 en 2020, bastante similar a la población registrada en 2019 (3 258 809) (MINAGRI, 2021), a pesar del impacto económico que atraviesa el país por la actual coyuntura sanitaria del SARS-CoV2. En el país se tiene el reglamento sanitario porcino (DS N.° 002-2010-AG) desde 2010 que contempla todas las acciones y medidas sanitarias establecidas por SENASA para prevenir, controlar y erradicar las enfermedades porcinas de mayor impacto económico, tales como el virus del síndrome respiratorio y reproductivo porcino (PRRSv), el virus de Aujeszky (VAD), peste porcina clásica (PPC) y brucelosis porcina. Sin embargo, no se contempla al VIA en el cerdo a pesar de ser una enfermedad zoonótica en donde este animal juega el rol principal por considerarse el mezclador o generador de nuevas cepas emergentes de subtipos del VIA. Los anticuerpos detectados en los porcinos de crianza tecnificada sugieren su exposición a virus de campo, ya que en el país no está autorizada el uso de vacunas comerciales.
El estudio mostró que la frecuencia de anticuerpos contra el virus de influenza A fue de 24.9% (22.0 - 27.8% IC) considerando las muestras de las tres regiones (Cuadro 1). Los resultados fueron muy similares a los reportados por Tinoco et al. (2015), quienes hallaron una prevalencia de 24% en muestras de porcinos de granjas de traspatio en Tumbes, aunque en dicho estudio se utilizó la prueba de inhibición de la hemaglutinación (IH) para la identificación de anticuerpos contra el subtipo H1N1 del VIA, y en el presente trabajo se utilizó un kit comercial de ELISA que identifica todos los anticuerpos secretados contra el VIA. Por otro lado, en el estudio de Muller (2012) en cerdos de crianza tecnificada y de traspatio de Santa Rosa y Quetzaltenango en Guatemala utilizando un kit comercial de ELISA se halló una prevalencia serológica de 0 y 9%, respectivamente.
La frecuencia de anticuerpos contra el VIA en porcinos de granjas tecnificadas por región fue de 33.2% (I.C.: 27.8 - 39.0%), 19.5% (I.C.: 15.1 - 24.6%) y 22.2% (I.C.:17.6 - 27.5%) para Lima, Ica y Arequipa, respectivamente. La frecuencia más alta fue encontrada en Lima y esto podría deberse a que esta región concentra la mayor cantidad y productividad de cerdos en el Perú (MINAGRI, 2021). La alta densidad de animales en las granjas porcinas tecnificadas es un factor que incrementa la propagación de la enfermedad, pues su transmisión es a través del contacto directo y aerosoles (Brown, 2000; Poljak et al., 2008).
Históricamente, la técnica para la detección de anticuerpos contra VIA ha sido la prueba de inhibición de la hemaglutinación (IH), porque identifica anticuerpos contra los subtipos del VIA, a diferencia del ELISA que detecta en forma general, todos los anticuerpos contra VIA. La ventaja indicada de la prueba de IH está limitada al requerimiento de las cepas de referencia de los subtipos identificados para poder realizar la técnica; mientras que, el ELISA tiene la principal ventaja de identificar todos los anticuerpos contra el VIA en una sola corrida y se puede trabajar grandes cantidades de muestras (Ciacci-Zanella et al., 2010; Goodell et al., 2014; Zacour et al., 2016).
Anticuerpos contra el VIA fueron detectados en todos los grupos etarios. Los resultados de la regresión logística revelan que los cerdos pertenecientes al grupo etario 0 (hasta 21 días) y grupo etario 5 (91 a 110 días) tienen mayor oportunidad de presentar ocurrencia de animales positivos a anticuerpos contra VIA en comparación con otros grupos etarios. En este sentido, Garrido-Mantilla et al. (2019) reportaron que lechones entre 18 y 21 días de edad era el grupo etario con mayor probabilidad para detectar al virus de influenza A, en tanto que Allerson et al. (2013) documentaron la función de los lechones como reservorio del virus, así como el mantenimiento de la infección viral en granjas y la introducción del virus en las poblaciones destetadas.
Larsen et al. (2010) observaron que los neonatos en ausencia de marranas positivas pueden actuar potencialmente como portadores. Los lechones obtienen la inmunidad pasiva de la madre al nacer, la cual va disminuyendo con el tiempo, favoreciendo la exposición a lechones de mayor edad o de otras fuentes de infección presente en el medio.
Esta inmunidad provee una protección contra virus antigénicamente similares al VIA, lo que se conoce como protección homóloga. Asimismo, Allerson et al. (2013) demostraron la presencia del virus durante 70 días en cerdos de 90 a 110 días de edad, alojados en cebadero donde no se incluyeron animales de otras procedencias. Esto sugiere que el virus puede persistir en la población porcina más tiempo del esperado.
Actividades de manejo como destete, aretado, vacunaciones, etc., puede influir en un estrés adicional, favoreciendo que el organismo se encuentre temporalmente inmunocomprometido y más susceptible a la infección por patógenos presentes en las granjas, como el VIA. Esto podría explicar el ascenso de animales seropositivos en el grupo etario 2 (36 a 50 días) de las granjas de la región Ica, debido a un desafío por el VIA de campo, ya que en el país no se utilizan vacunas comerciales como medida de prevención (Hollis, 2022). Por otro lado, se debe considerar que el número de muestras por grupo etario en Ica no es uniforme, siendo el grupo etario 2 el de mayor tamaño muestral, lo cual podría sesgar los valores encontrados.
No se dispone de información en el país de cómo el VIA ingresó, pero se infiere que podría deberse a la importación de líneas genéticas mejoradas como sucedió con el PRRSv (Ramírez et al., 2019) y la diarrea epidémica porcina (Castro-Sanguinetti et al., 2017). A pesar de haber evidencia clínica, serológica y molecular del VIA en el país, poco se conoce sobre los aspectos epidemiológicos y moleculares de las cepas que circulan en las granjas porcinas. Este trabajo es un estudio inicial que debe ser ampliado con otros trabajos de investigación que involucren estudios de caracterización viral para que las autoridades sanitarias puedan plantear medidas de control y prevención acorde al subtipo viral identificado en granjas porcinas del país.
CONCLUSIONES
La ocurrencia de muestras positivas a anticuerpos contra el virus de influenza A en porcinos de granjas tecnificadas fue de 24.9% para el global de muestras de las regiones de Lima, Ica y Arequipa.
La frecuencia de anticuerpos contra el virus de influenza A en porcinos de granjas tecnificadas fue de 33.2% (I.C. 95% 27.8 - 39.0), 19.5% (I.C. 95% 15.1 - 24.6) y 22.2% (I.C. 95% 17.6 - 27.5) en la región de Lima, Ica y Arequipa.
El análisis de regresión logística multinomial indicó interacción entre regiones y grupos etarios.












 uBio
uBio 


