INTRODUCCIÓN
Una patología de etiología multifactorial en los gatos que se puede presentar desde muy temprana edad es la conjuntivitis. Una alteración ocular que se caracteriza por una variada gama de signos clínicos provocados por agentes virales y/o bacterianos, siendo de especial importancia Chlamydophila (Chp) felis, bacteria Gram negativa que pertenece a la familia de las Chlamydiaceae. Esta es un patógeno primario de conjuntivitis felina y forma parte del Complejo Respiratorio Superior Felino (CRF). La seroprevalencia es elevada en las poblaciones felinas, pero la frecuencia de aislamiento del microorganismo puede ser de 4% en individuos sanos y de 30% en enfermos (Lloret y Duhalde, 2008). Esta bacteria es causante del 50% de las conjuntivitis en felinos en Chile (Maier et al., 2011).
Es una enfermedad común en ambientes con gran cantidad de felinos; por ejemplo, en criaderos u hogares donde conviven más de dos gatos, lo cual podría deberse a situaciones de estrés como la tensión social, así como a situaciones derivadas del parto y la lactancia, que hacen que los portadores asintomáticos desarrollen enfermedad clínica y diseminen el microorganismo (Strom y Frössling, 2009). La transmisión de Chp. felis requiere de un contacto directo con el agente bacteriano, siendo generalmente de tipo horizontal procedente de portadores sintomáticos o asintomáticos (Maier et al., 2001). Para la transmisión de la infección se deben considerar dos factores, como son la virulencia de la cepa y el número de bacterias que infectan al hospedero; no obstante, la dosis mínima infectante de las cepas aún es desconocida (Rodolakis y Mohamad, 2008). Los signos clínicos más comunes son la conjuntivitis, quemosis, secreción ocular serosa a mucopurulenta y blefaroespasmo (Nguyen et al., 2019). También se pueden observar otros signos clínicos como secreciones nasales serosas o mucopurolentas y estornudos (Sykes et al., 2014)
Todas las especies de Chlamydophila son patógenos zoonóticos potenciales, siendo Chlamydophila psittaci y Chlamydophila abortus las más importantes y mejor documentadas (Rodolakis y Mohamad, 2008), mientras que Chp. felis es un patógeno común en animales y la infección es rara vez identificable en el humano, pudiendo infectarse por medio de gatos infectados (Azuma et al., 2006), sin embargo, no existe evidencia epidemiológica donde C. felis represente un riesgo zoonótico significativo (Horzinek et al., 2013). En Chile no hay estudios serológicos publicados, motivo por el cual, el presente estudio tuvo como objetivo determinar la prevalencia de la enfermedad en felinos domésticos y su asociación con las variables sexo, rango etario y antecedentes compatibles con el complejo respiratorio felino (CRF).
MATERIALES Y MÉTODOS
Lugar de Estudio
El estudio fue realizado entre junio y agosto de 2013 en una clínica de animales menores de la ciudad de San Carlos, ubicada al norte de la ciudad de Chillán, Región de Ñuble. Se trabajó con 60 animales que fueron atendidos y se encontraban incluidos en la base de datos de pacientes felinos de la clínica veterinaria, la cual contaba con tres años de funcionamiento. Los animales utilizados (n=60) representaron el 28.6% del total de la base de datos, los cuales fueron seleccionados utilizando un programa de selección aleatoria, que permitió identificar el número de ficha del paciente y cuyo único criterio de inclusión era ser mayor a 2 meses de vida.
A cada animal se les realizó un examen clínico, que incluyó las constantes fisiológicas, mucosas (oral y ocular), palpación de linfonódulos y condición corporal. Todos los datos fueron recuperados de sus fichas clínicas. Además, se obtuvieron datos mediante una anamnesis, enfocada principalmente en la búsqueda y/o antecedentes de sintomatología compatible con CRF.
Muestras
Se tomaron muestras de sangre (0.5 ml) a los felinos seleccionados mediante punción de la vena cefálica, utilizando bránulas de 24G. Las muestras fueron centrifugadas a 2000 rpm durante 10 minutos en el laboratorio de la Universidad Santo Tomás sede Concepción. Los sueros resultantes fueron dispuestos en tubos eppendorf y conservados a 4 ºC y posterior transporte a -12 ºC para su análisis.
Técnica Diagnóstica
Se utilizó el kit comercial Immuno-Comb(r) Feline Toxoplasma & Chlamydophila Antibody Test Kit (Biogal) (Cat. N.° 50FTC201/50FTC210) (Biogal), el cual está diseñado para detectar títulos de anticuerpos tipo IgG para Toxoplasma gondii y Chlamydophila sp en el suero de felinos. La muestra inmune positiva se considera un título igual o superior a 1:32, equivalente a la Categoría S=3 del test. La prueba tiene una sensibilidad del 94.7% y una especificidad del 100% para Chlamydophila sp (Biogal, 2007). La prueba fue realizada siguiendo las indicaciones del fabricante.
Análisis Estadístico
El estudio fue de tipo descriptivo y transversal. Se evaluaron las variables sexo y grupo etario. Para este último se consideraron seis grupos de acuerdo con la tabla Feline Life Stage Guidelines (Vogt et al., 2010). Se determinó la seroprevalencia con base al porcentaje de positividad en la prueba de ELISA. Para determinar si existían diferencias estadísticas para la variable sexo y antecedentes clínicos previos a CRF, se aplicó el método estadístico de Fisher exacto, método que permite analizar si dos variables están asociadas cuando la muestra a estudiar es demasiado pequeña, en tanto que se utilizó la prueba de Chi cuadrado para la variable edad. Además, se utilizó la correlación de Spearman para determinar la asociación entre edad y seroprevalencia. Todos los análisis estadísticos se efectuaron con el software Infostat v. 2020e.
RESULTADOS Y DISCUSIÓN
La seroprevalencia de Chlamydophila spp en gatos atendidos en la clínica de animales menores de la ciudad de San Carlos fue de 51.6% (31/60). La seroprevalencia en las hembras fue de 71.4% (27/37) y en los machos fue de 25.8%% (6/23) (p=0.39). Con relación a los grupos etarios, el mayor porcentaje de seropositivos fue observado en las categorías Junior (35.5%) y Kitten (32.2%), seguido por los grupos Prime (25.80), Mature y Senior (ambos con 3.2%), pero sin diferencias significativas entre categorías (p=0.62) (Cuadro 1).
Cuadro 1 Seroprevalencia de Chlamydophila felis según factores de riesgo en 60 pacientes felinos (San Carlos, Chile)
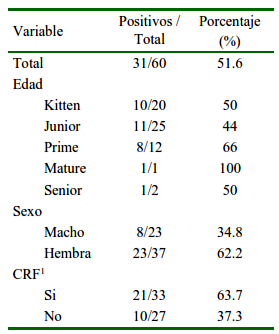
1 Antecedentes compatibles con el complejo respiratorio felino
El coeficiente de Spearman evidenció una correlación negativa (r=-0.872), indicando que a mayor edad de los individuos existe una menor seropositividad (p<0.05).
De los animales muestreados, 33 de ellos (55%) presentaron por lo menos uno de los signos clínicos compatibles con el complejo respiratorio felino. Al asociar la presencia/ausencia de estos signos con los casos seropositivos, 67.7% presentaron antecedentes de CRF, en tanto que el 37.3% seropositivo restante no presentó antecedentes de CRF, siendo estas diferencias no significativas (p=0.40).
El 51.6% de seropositividad coincide con el 50% reportado por Maier et al. (2001) en Santiago de Chile mediante la técnica de inmunofluorescencia indirecta (IFI) con muestras de raspado conjuntival de pacientes con conjuntivitis. Esto pudo justificar el elevado porcentaje de prevalencia del estudio, ya que es de esperarse un mayor número de positivos Chlamydophila spp en gatos con conjuntivitis o con CRF (Hartmann et al., 2008; Gruffydd-Jones et al., 2009). Asimismo, el valor encontrado fue mayor al 4% encontrado en animales sanos y de 30% en animales con signos clínicos por Lloret y Duhalde (2008). Por otro lado, Suica (2004) en Lima, Perú, reportó 11.7% (7/60) de gatos positivos mediante la técnica de IFI cuya población muestreada era variable, siendo de 73.3% en animales enfermos (73.3%) por distintas causas (incluyendo compatibilidad con complejo respiratorio y conjuntivitis) y de 26.7% en animales clínicamente sanos; en tanto que Dovc et al. (2008) en Eslovenia reportaron la presencia de anticuerpos tipo IgG para Chlamydophila felis en 16.7% (5/30) de gatos expuestos experimentalmente al virus de la inmunodeficiencia felina (FIV) y al virus de la leucemia felina (FeLV)
Diferencias entre estudios podrían estar relacionadas con la sensibilidad y especificidad de las técnicas empleadas, siendo mucho mayor para ImmunoComb, la cual es de 94 y 100% (Biogal, 2007), respectivamente, lo que reduce notablemente los falsos negativos y positivos, en contraste con la inmunofluorescencia que a pesar de que su especificidad sea del 98 al 99%, su sensibilidad varía de 80 a 90% (Camacho, 2012).
Los valores obtenidos en esta investigación concuerdan con reportes de la literatura científica, la cual indica que un importante factor de riesgo para esta enfermedad son los animales jóvenes, especialmente los menores a un año (Gruffydd-Jones et al., 2009). Por otro lado, Suica (2004) reportó el mayor porcentaje de seropositividad (6.7%) en animales mayores del año (adultos). Sin embargo, hay que recordar que en ese estudio se demuestra la presencia de anticuerpos tipo IgG contra Chlamydia, lo que indica que los animales estuvieron expuestos a la infección, pero no se podía determinar si se encontraban en un estado agudo, crónico o como portadores.
A pesar de los porcentajes que reflejan una mayor seropositividad en animales entre los 2 meses y los 2 años, no hubo diferencia estadística significativa entre grupos, pero se podía notar que a mayor edad había una menor seroprevalencia de la enfermedad, lo que concuerda con lo establecido por Lloret y Duhalde (2008), que indican que a medida que aumenta la edad del gato disminuye el riesgo de infección, y que gatos mayores de 5 años raramente estarán infectados.
Los resultados obtenidos demuestran la presencia de anticuerpos contra Chlamydophila felis en pacientes felinos domésticos de la clínica veterinaria de la ciudad de San Carlos; sin embargo, los estudios realizados a nivel nacional siguen siendo escasos, siendo de gran importancia generar nuevas investigaciones que permitan conocer de mejor manera la epidemiología de esta enfermedad.












 uBio
uBio 

