INTRODUCCIÓN
En Perú, la pesca del calamar gigante o pota (Dosidicus gigas) es la segunda más importante del país después de la anchoveta, con capturas destinadas a los mercados de exportación. El país ha producido más del 50% de los desembarques mundiales de calamar gigante por varios años, alcanzando los 556 000 t en 2014, aunque este volumen ha disminuido en las últimas temporadas (FAO, 2020; Produce, 2020; Rovegno, 2021).
A partir del calamar gigante, se han desarrollado una variedad de productos como enlatados, daruma (condimentados secos), hamburguesas y nuggets, pero todos utilizan la carne cocida y no aprovechan la funcionalidad de la carne como los productos de surimi (Chirinos, 2009; Maza, 2002, Paredes y De la Puente, 2014). Sin embargo, el manto de calamar gigante es una materia prima apreciada porque su color blanco facilita el uso de colorantes para obtener alimentos imitando productos como camarones, cangrejos, etc. (Martín Sánchez et al., 2009), aunque algunos inconvenientes derivan de sus sabores amargos y ácidos (Yamanaka et al., 1995; Sánchez-Brambila et al., 2004). No obstante, el empleo de tratamientos salinos y ácidos solucionan estos inconvenientes, además de facilitar la formación de gel (Maza et al., 2003, 2007; Maza y Rosales, 2004; Sánchez-Brambila et al., 2004; Martín Sánchez et al., 2009).
Konno y Fukazawa (1993) describieron la autolisis de la proteína del músculo del calamar, sugiriendo que la actividad de las proteasas origina sustancias de sabor amargo-ácido, dañando así la textura del músculo. Según Wakameda et al. (1983) y Wakameda y Arai (1986), la autólisis desestabiliza los enlaces F-actina con la miosina y provoca la disociación de las proteínas miofibrilares, favoreciendo el proceso de surimi; sin embargo, la alta solubilidad en agua de los filamentos de miosina de calamar gigante expone su estructura a las enzimas proteolíticas, alterando la gelificación térmica (Okamoto et al., 1993; Konno y Fukazawa, 1993; Konno et al., 2003). Por otro lado, Konno et al. (2003) indicaron que se requiere la adición de sal para solubilizar la proteína y formar un gel térmico, a pesar de que esto promueve la autolisis en el músculo del calamar, especialmente a 0.3 M (1.76 %).
Kuwahara (2011) evaluaron la prevención de la desnaturalización de la miosina mediante el uso de tartrato, gluconato y citrato de sodio en el calamar japonés (Todarodes pacificus), encontrando mejores resultados con el uso de Na-Citrato, además de lograr un aumento de la fuerza del gel; posiblemente debido a un efecto quelante de los iones de zinc, que afecta a las metaloproteasas del músculo del calamar (Kuwahara et al., 2004, 2006).Al igual que el NaCl, el citrato de sodio actúa no solo disolviendo las proteínas miofibrilares sino, también, inhibiendo la autolisis con la consiguiente mejora de las propiedades en el gel inducido térmicamente (Kuwahara et al., 2006).
Maza et al. (2003) lograron eliminar el sabor amargo-ácido en el calamar gigante mediante la aplicación de un tratamiento de lixiviación ácida y prensado, utilizando ácido cítrico 0.026 M y cloruro de sodio 0.34 M y una etapa de neutralización con bicarbonato de sodio 0.024 M. El surimi se obtuvo mezclando la pulpa con sorbitol como aditivo crioprotector para evitar la pérdida de propiedades funcionales y nutricionales de las proteínas durante el almacenamiento en congelación. Asimismo, sustancias como el azúcar, polioles y otros han sido evaluados como agentes crioprotectores para prolongar la vida útil del surimi (Matsumoto y Noguchi, 1992; Zhang et al., 2020).
En cuanto a la ingesta de micronutrientes y con base en el enfoque de alimentación saludable, se ha tratado de reducir el cloruro de sodio como agente solubilizante en el sol coloidal, así como reducir el uso de crioprotectores como los polifosfatos de sodio (reducir el exceso de sodio y de fosfato en alimentos), considerando que es una prioridad de salud preventiva para enfermedades no transmisibles (Calvo y Uribarri, 2013; Uribarri y Calvo, 2003). Es así que este estudio tuvo como objetivo evaluar el efecto de varias concentraciones de citrato de sodio en la formación de gel y su acción crioprotectora en la producción de surimi de músculo de calamar gigante (D. gigas) sobre las propiedades reológicas que constituyen atributos de calidad en el producto (fuerza de gel, dureza, elasticidad y grado de plegado).
MATERIALES Y MÉTODOS
Diez mantos frescos de calamar gigante, de 63.5 ± 1.5 cm de longitud, libres de piel externa y vísceras, fueron adquiridos en el Mercado Mayorista Pesquero de Ventanilla (Callao, Perú). Los especímenes fueron colocados en cajas con hielo en escamas para su conservación, manteniendo temperatura por debajo de 5 oC hasta su llegada a la planta de procesamiento (Figura 1). Se utilizó cloruro sódico (NaCl) y citrato trisódico (Na3C6H5O7) del proveedor Aromas del Perú.
Composición Química Proximal
La composición química proximal fue determinada con técnicas analíticas adaptadas por Albrecht et al. (2017). El contenido de humedad se obtuvo mediante secado al horno de las muestras a 102 ± 1 ºC y el contenido de cenizas en un horno de mufla a 600 °C, ambos hasta llegar a un peso constante. El contenido de grasa se determinó mediante el equipo Soxtherm(r) (C. Gerhardt, Alemania), usando hexano, mientras que la proteína se determinó a través de la metodología Kjeldahl, multiplicando el contenido total de nitrógeno por 6.25. Este análisis solo se desarrolló el día de recepción de los mantos.
Elaboración de Surimi Evaluación de textura
La materia prima fue cortada en láminas (50-100 mm de largo y 10-20 mm de espesor), mantenidas en inmersión en agua con hielo a temperatura inferior a 10 oC. Las láminas fueron desmenuzadas en un cortador industrial de acero inoxidable (IMKA EIR2) de 20 L de capacidad a una velocidad de 1500 rpm. La lixiviación se llevó a cabo agregando una solución ácida salina fría 0.026 M de ácido cítrico y 0.34 NaCl (Maza et al., 2003), manteniendo proporciones de 1:4 (materia prima: solución) y dejando reposar durante 30 min a 10 °C. Luego, la muestra fue prensada mediante la aplicación de 10 kg/cm2 utilizando una prensa hidráulica (TK-5-5, Bibun Machine Construction Co). La pulpa obtenida previamente ácida y deshidratada fue desmenuzada en una cortadora (cutter) hasta obtener aspecto de carne molida con un pH 5.5. La humedad fue regulada a 75% mediante la adición de hielo.
La pulpa desmenuzada previamente neutralizada con bicarbonato de sodio hasta llegar a pH 6.8-7.0 fue separada en dos porciones envasadas en bolsas de polietileno. Una porción fue identificada como tratamiento SNa y sometida a estabilización con 4.0% sorbitol y 0.25% citrato sódico (Kowata et al., 2003) y la segunda porción, identificada como S fue estabilizada con 4.0% sorbitol. Ambas porciones fueron congeladas en túnel a -25 °C y almacenadas a -20 °C durante 2 meses hasta su evaluación.
Preparación de los Coloides Sol del Surimi
Las muestras de los tratamientos SNa y S fueron colocadas en un equipo Multi-Blender Mill SC-D (Nissei), cortadas en láminas de aproximadamente 10 mm de espesor y homogeneizadas con 0.5% CaCl2 (50 mM) a 20 000 rpm por 3 min, manteniendo la temperatura a 5 ºC, hasta obtener una pasta homogénea (sol de surimi), incluyendo las sales para las pruebas de solubilización y crioprotección.
Las pruebas reológicas para las muestras de ambos tratamientos fueron realizadas asegurando la homogeneidad de la pasta formada y evitando la presencia de aire. La pasta formada fue llenada en envases cilíndricos de acero inoxidable (33 mm de diámetro interior y 35 mm de altura) con tapa rosca en los extremos y mantenidas en agua con hielo a temperatura de 10 °C. La cocción posterior fue realizada en baño maría (Memmert) a 90 oC durante 25 min y enfriamiento inmediato en agua con hielo durante 30 min. Los geles obtenidos denominados "geles tipo kamaboko" (Carvajal et al., 2005) fueron colocados en bolsas de polietileno y mantenidos a 4 oC durante 18 h antes de su evaluación.
Las pruebas reológicas fueron la medida de la fuerza de gel, elasticidad y dureza, además de las pruebas de doblez. Se hicieron 10 determinaciones por tratamiento.
Prueba de ruptura. La dureza y la elasticidad de los geles fueron determinadas en función del punto de fractura. El equipo utilizado fue el analizador de textura Brookfield CT3-1500 (Brookfield Engineering Laboratorios, USA) provisto con una esfera de penetración de 5 mm de diámetro a velocidad de 1 mm/s. La fuerza de gel fue obtenida como producto de la multiplicación de los valores de dureza y la elasticidad (g*cm).
Prueba de doblez. Se hizo siguiendo la metodología de Tanikawa et al. (1985) y Çaglak (2018), cortando una lámina con grosor aproximado de 1 mm de del gel y realizando dobleces sucesivos hasta producir fractura. La escala de calificación de la prueba de doblez es la descrita por Tanikawa et al. (1985), siendo la categoría AA (no se agrieta al doblarse en 4), A (se agrieta cuando se dobla en 4), B (forma pequeña grieta al ser doblada en 2), C (forma grieta hasta la mitad al ser doblada en 2) y D (se parte al ser doblada en 2).
Tratamientos
Evaluación de la formación coloide sol usando cloruro o citrato sódico
La solubilización de los coloides sol fue evaluada en las muestras S (surimi solo con sorbitol como crioprotector). Las muestras fueron mezcladas con NaCl en concentraciones 0 y 1.5% (como controles) y con citrato sódico al 0.25, 1.27, 2.0, 3.0 y 7%. Las variables respuesta fueron la fuerza de gel, elasticidad y grado de plegado de los geles obtenidos.
Evaluación del efecto crioprotector usando sorbitol (S) o sorbitol con citrato sódico (SNa)
La conservación de muestras de surimi S (surimi solo con sorbitol como crioprotector) y SNa (surimi con sorbitol y citrato como crioprotector) se evaluó mediante la estabilidad en la formación de gel después de dos meses de almacenamiento a -20 ºC. Para ello, se preparó sol coloidal para cada tratamiento adicionando concentraciones de 0 y 1.5 % de NaCl (como control) y 0.25, 1.27, 2.0 y 3.0% de citrato de sodio. Las variables de respuesta a los datos fueron fuerza de gel, dureza, elasticidad y grado de plegamiento de los geles obtenidos. La data se grafica en dos bloques, bloque A donde se colocan los controles (sin cloruro de sodio y con cloruro de sodio 1.5%) y bloque B donde se colocan las muestras con diferentes dosis de citrato.
Análisis Estadístico
Los datos obtenidos fueron analizados con el programa estadístico Statgraphics Plus v. 5.0 para Windows. Las pruebas de varianza y correlación de Pearson fueron aplicadas para evaluar el efecto del citrato como agente solubilizante y crioprotector. La interacción entre la concentración de citrato sódico adicionado como agente solubilizante (0.0-1.272.0-3.0%) y el efecto crioprotector (con y sin) fue evaluada mediante un análisis de varianza de dos vías con base a los datos de dureza, elasticidad y fuerza de gel (p<0.05). Se realizaron representaciones graficas de las características reológicas de surimi y concentrados de calamar gigante y calamar común obtenidos en estudios similares con fines comparativos.
RESULTADOS Y DISCUSIÓN
La composición química proximal indicó 84.75 ± 0.05% de humedad, 13.45 ± 0.15% de proteína bruta, 0.35 ± 0.03% de grasa y 1.32 ± 0.02% de cenizas.
Efecto de las sales en la formación del coloide sol
La Figura 2 muestra elevados coeficientes de correlación positiva (p<0.05) entre el incremento de citrato sódico hasta 3% y los valores de dureza, elasticidad y fuerza de gel, lo cual guarda relación con lo explicado por Kuwahara et al. (2004) respecto a la interacción con la estructura proteica miofibrilar y la formación de geles de mayor dureza.
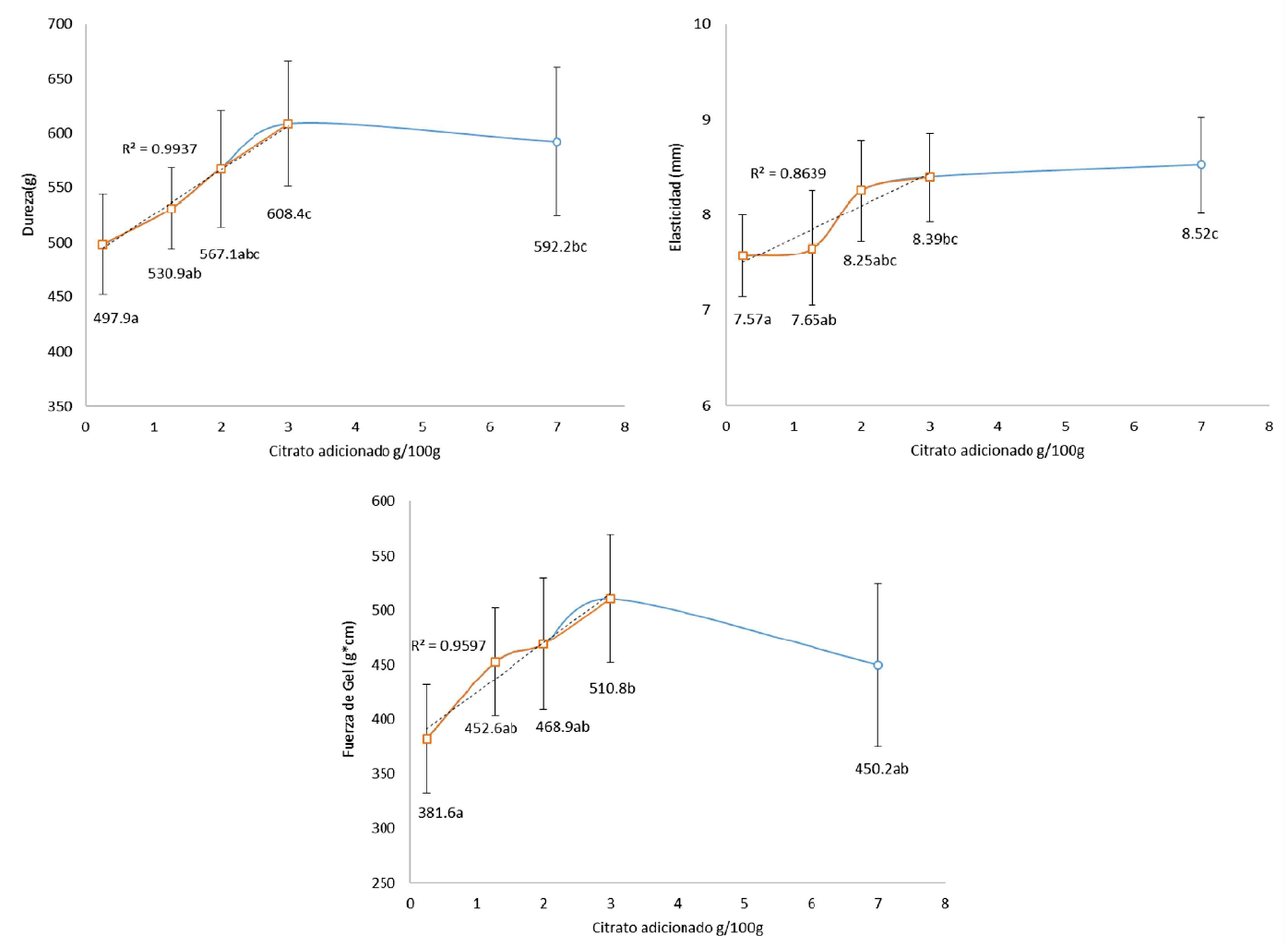
Figura 2 Efecto solubilizante de 0.25, 1.27, 2.0, 3.0 (cuadrados rojos) y 7.0% (círculo azul) de citrato de sodio sobre las propiedades de textura de los geles de Dosidicus gigas. La línea roja indica correlación entre concentraciones de 0.25 a 3%. Surimi solubilizado al 1.5% de NaCl (triángulo negro)
Valores de dureza y fuerza de gel en las muestras conteniendo 0.25 y 1.27% de citrato sódico no presentaron diferencias significativas (p>0.05), pero a partir de 2% se produce un notorio incremento, especialmente en la elasticidad de los geles, sugiriendo el inicio de la formación adecuada del coloide sol, el cual alcanza su máximo valor en concentraciones de 3% de citrato sódico. Por otro lado, la adición de 7% de citrato sódico afectó la textura, en especial la dureza y la fuerza de gel, posiblemente debido al efecto del denominado salting-out. Los valores de dureza del presente estudio superan los encontrados por Kuwahara et al. (2004) en geles de calamar común japonés Todarodes pacificus (entre 479 y 508 g) elaborados con adiciones de 100 -250 mM de citrato sódico y también superan los valores de dureza, elasticidad y fuerza de gel (365.8 g, 6.7 mm y 243.9 g.cm, respectivamente) obtenidos por Maza et al. (2003) en geles de D. gigas elaborados con adición de 2.7% NaCl y 5.0% almidón y sometidos a calentamiento a 90 °C por 20 min.
El uso de citrato sódico, además de las ventajas en la solubilidad de la miosina, sugiere un efecto supresor sobre su desnaturalización térmica, lo cual ha sido demostrado por Kuwahara y Konno (2010) en carne de carpa común Cyprinus carpio, obteniendo valores de estabilización de miosina 101.7 veces comparados con el uso de NaCl. También Ooizumi et al. (1984) comprobaron el mayor efecto protector del citrato sódico sobre la desnaturalización térmica de las miofibrillas de caballa Scomber japonicus en estudios comparativos con otros ácidos mono y dicarboxílicos como el Na-gluconato y Na-tartrato.
Francis et al. (1992) y Odell et al. (1998) refieren la acción del citrato sódico como quelante de cationes metálicos divalentes, inactivadores de serin y metaloproteasas, actividad que ha sido considerada en numerosos estudios, semejante al EDTA y a la 1,10-fenantrolina frente a cationes divalentes (Zn2+, Co2+, Ca2+, Mg2+ entre otros) (Erickson, 2000; Dublán, 2001; Kuwahara et al., 2004). Este efecto quelante protegería a las proteínas miofibrilares de la degradación, permitiendo la participación de mayor contenido de miosina de cadena pesada en la formación de la red tridimensional durante la gelificación térmica del surimi de manto de calamar gigante (Kuwahara et al., 2003, 2004, 2006). En este contexto, el análisis de la Figura 2 sugiere que los fenómenos de solubilización y quelación ocurrirían de modo simultaneo durante la formación del sol en la proteína de calamar gigante. Es posible que los bajos niveles de citrato sódico ocasionen quelación y ello se refleja en un cambio de elasticidad no significativo, en tanto que mayores concentraciones explicarían el incremento de la formación del coloide sol y la posterior estabilización térmica, haciendo evidente mejores propiedades de textura a concentraciones entre 1.27 a 3%.
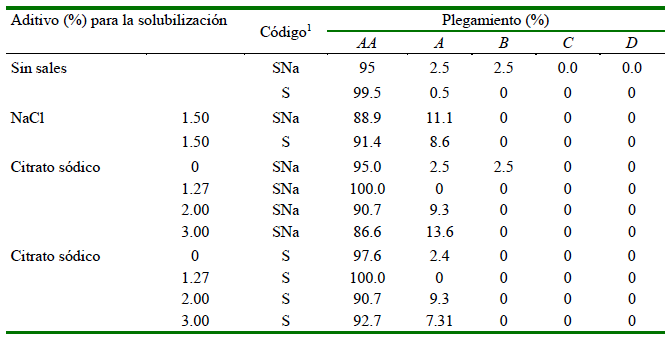
Los mejores resultados de la prueba de plegamiento correspondieron a las muestras de SNa con citrato de sodio al 1.27 % (plegamiento de AA al 100 %) y muestras S con cloruro de sodio al 1.5 % (91.4 %).
Efecto crioprotector
En el bloque A de la Figura 3 se compara los efectos de crioprotección (con y sin citrato) en las muestras control mediante la formación de gel a partir de los diferentes coloides sol surimi como (C) y sin cloruro sódico (0). Las muestras de surimi sin citrato obtuvieron valores más altos en las características reológicas independientemente de que se les añadiera o no NaCl.
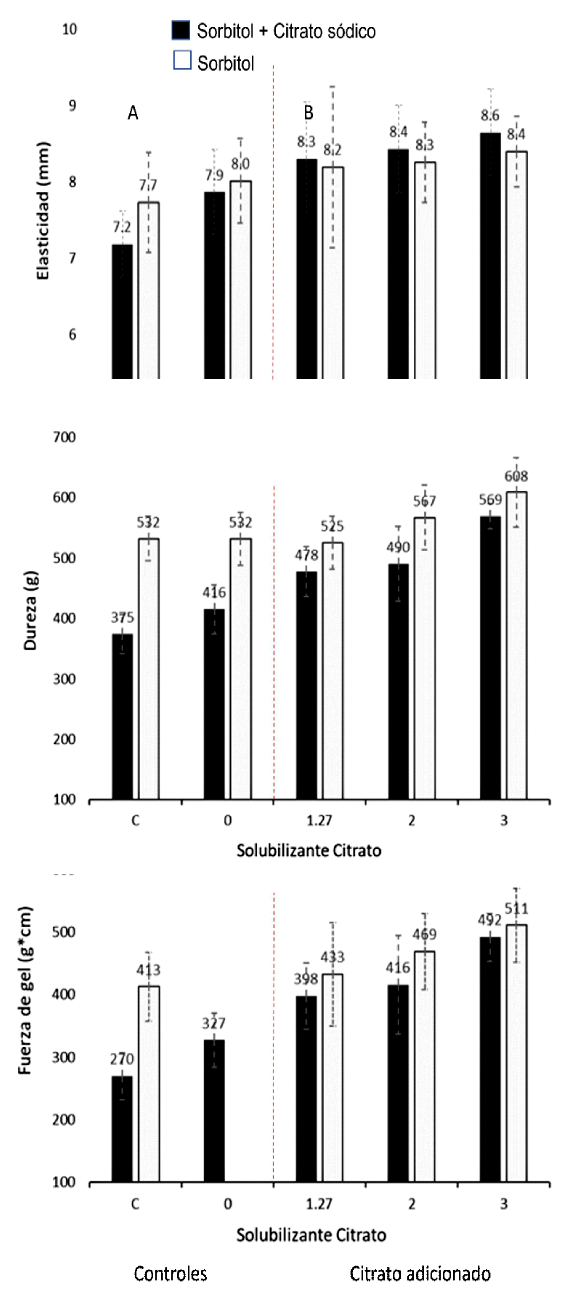
Figura 3 Dureza, elasticidad y fuerza de gel en muestras con crioprotectores Sorbitol (S) NaCl (control "C"). Línea roja: separa los resultados con muestras de control "C" y sin sales "0"
En base a este tipo de coloide sol con y sin sales, se puede deducir que la adición de citrato sódico no aporta efecto crioprotector. Asimismo, el citrato sódico tampoco logró el efecto de quelación apreciado pues la dosis no llegaba al 2.0% como se indicó en el análisis de solubilización.
La segunda etapa de evaluación del efecto crioprotector (Bloque B), donde se evaluaron los niveles de citrato sódico en el rango de 1.27 a 3.0% no se encontró efecto protector alguno. Por el contrario, las muestras presentaron valores inferiores a las tratadas con sorbitol. Los geles de calamar gigante a partir de surimi con 0.25% de citrato sódico (S) obtuvieron 91.4% de grado de plegado AA para la prueba de doblez (Cuadro 1), en concordancia con el reporte de Kanayama et al. (1992), quienes demostraron que tanto el kamaboko reticulado (suwari kamaboko) como el no reticulado (musuwari kamaboko) presentaron buenos resultados tras la adición de citrato sódico dentro de un rango de 0.10 a 0.50% por peso en el surimi.
Cuadro 1 Grado de plegamiento en diferentes condiciones de solubilización con citrato sódico (0 a 3%) y cloruro sódico (1.5%) en surimi de calamar (crioprotector Sorbitol "S")
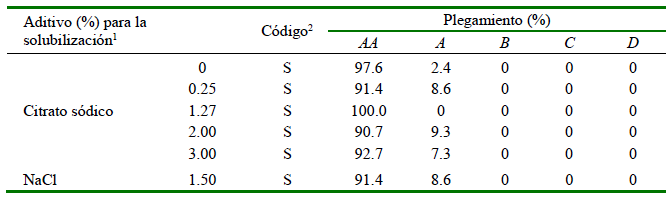
1 Para producir el sol-gel se adiciono diferentes niveles de citrato sódico a surimis con crioprotector sorbitol (S)
2 El código se refiere al surimi que se le adicionó como crioprotector citrato con sorbitol (SNa) o solo sorbitol (S)
Kowata et al. (2003) estudiaron el efecto protector combinado de 5.0% de sorbitol y 0.20% de citrato sódico sobre la desnaturalización proteica del surimi de Alaska pollack congelado a -20 °C, obteniéndose geles con grado AA en la prueba de doblez, pero este nivel de plegamiento no se mantuvo en el primer trimestre de congelación. La cantidad de crioprotectores empleados en la elaboración del surimi de calamar gigante "SNa" en este estudio (4.0% de sorbitol y 0.25% de citrato sódico) fue similar, obteniéndose con las concentraciones de 1.27; 2.0; 3.0% de citrato sódico, geles con 100.0; 90.7; 92.7 grado AA en la prueba de doblez respectivamente después de dos meses de almacenamiento (Cuadro 2).
Cuadro 2 Grado de plegamiento en diferentes condiciones de crioprotección con citrato sódico (0 a 3%) o cloruro sódico (1.5%) o sin agentes solubilizantes en surimi de calamar gigante (crioprotector Sorbitol "S" y crioprotector Sorbitol+ Citrato SNa)
1 El código se refiere al surimi que se le adicionó como crioprotector citrato con sorbitol (SNa) o solo sorbitol (S)
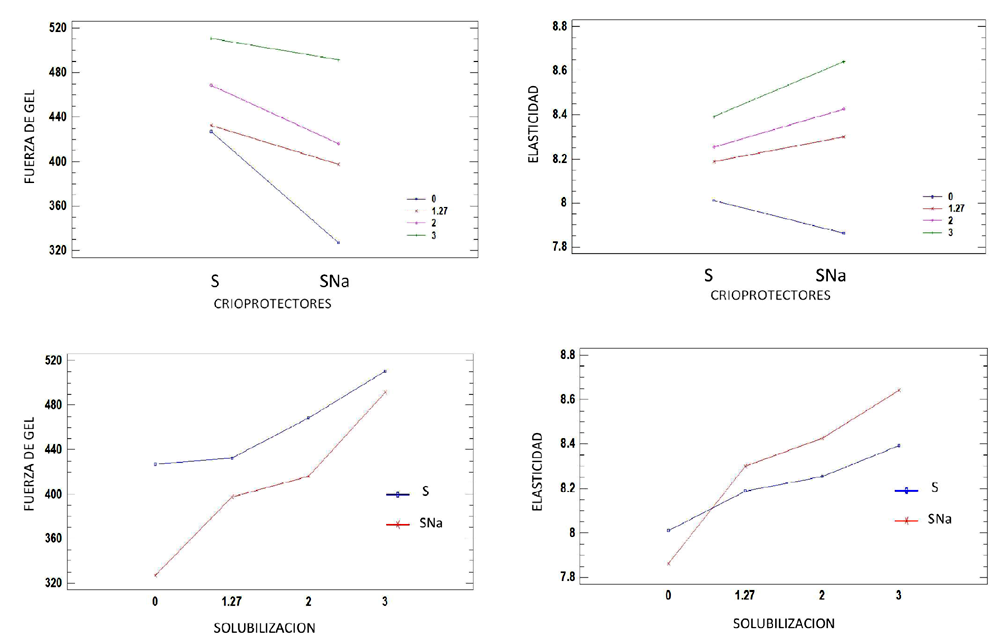
Figura 4 Análisis de interacciones entre los factores de tipos de crioprotector (Sorbitol "S" y Sorbitol + Citrato Sódico "SNa") vs concentración de Citrato Sódico en el coloide sol
El análisis estadístico factorial (factores: tipos de crioprotector y concentración de agente usado para obtener el coloide sol a partir de surimi) indicó un efecto significativo del tipo de surimi (entre S vs SNa) como crioprotector sobre la dureza (p=0.0) y la fuerza de gel (p=0.0028). Si bien estos son diferentes, el de mayor valor es la muestra que no presentó citrato como crioprotector (S). Por otro lado, el efecto en la elasticidad (p=0.6056) no presentó diferencias significativas en ambos casos. Respecto a las concentraciones como agente formador del sol a las dos condiciones de crioprotección, se presentó un efecto significativo con la dureza (p=0.0001) y la fuerza de gel (p=0.0000), pero no con la elasticidad (p=0.2441). Además, la interacción entre las dos variables (crioprotección y formación del coloide sol) no fue significativa (p=0.1203).
El efecto contraproducente de la adición de citrato trisódico como crioprotector podría señalar una ligera influencia en la formación del sol de miosina, que la predispone al ataque por el remanente de la actividad proteolítica, pero insuficiente para generar el proceso gelificante respecto a la dureza. Por el contrario, los surimis almacenados con citrato trisódico y solubilizados con citrato sódico presentaron mayores valores de elasticidad, aunque no significativos.
Este trabajo: surimi S control "A0" solubilizado con cloruro de sodio 1.5%, surimi S "A1" solubilizado con citrato de sodio 1.27%, surimi S "A2" solubilizado con citrato de sodio 2.0%, surimi S "A3" solubilizado con citrato de sodio 3.0 %, surimi SNa "B0" solubilizado con cloruro de sodio al 1.5%, surimi SNa "B1" solubilizado con citrato de sodio al 1.27%, surimi SNa "B2" solubilizado con citrato de sodio al 2.0%, surimi SNa "B3" solubilizado con citrato de sodio al 3.0%.
Comparación de propiedades de textura y nivel de sodio utilizados
En la Figura 5 se representa una comparación de la distribución de fuerza de gel vs. elasticidad en trabajos realizados en manto de calamar gigante. En estos trabajos los geles fueron medidos con una sonda de 5 mm de diámetro y a una velocidad de 60 mm/min. Los geles obtenidos a partir de coloides sol con citrato presentaron mejores propiedades reológicas, siendo superior a la extracción con ácido fosfórico, solubilización alcalina, solubilización ácida-salina, etc. Se puede apreciar una mejora sustancial de la fuerza de gel y de la elasticidad, con lo cual el surimi de este trabajo logra los mayores valores de textura en geles de surimi de calamar gigante hasta ahora reportados.
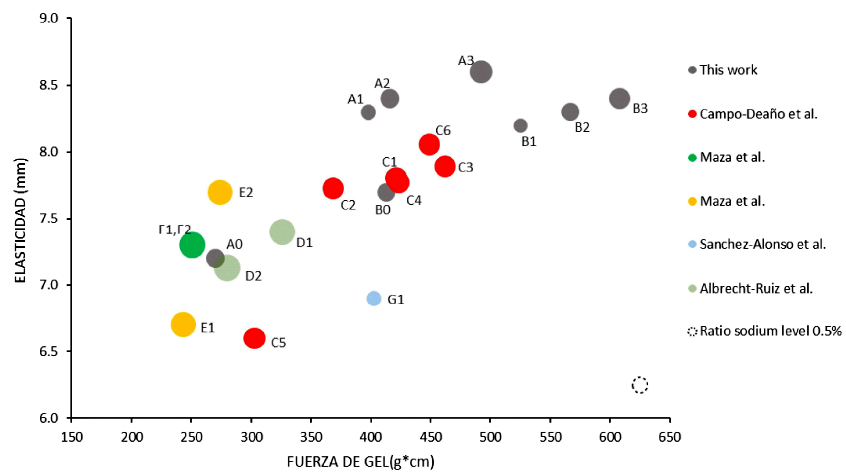
- Campo Deaño et al. (2010): C1 a C6, método de aislamiento ácido, solubilizado con cloruro de sodio 2.0%
- Albrecht-Ruiz et al. (2017): D1-D2, método del surimi con lixiviación ácido-salina, solubilizado con cloruro de sodio al 3.0%
- Maza et al. (2003): E1-E2, método del surimi con lixiviación ácido-salina, solubilizado con cloruro de sodio al 3.0%
- Maza et al. (2003): F1-F2, método de aislamiento alcalino, solubilizado con cloruro de sodio 3.0%
- Sánchez-Alonso et al. (2007): G1, método de aislamiento con solución salina alcalina, solubilizado con cloruro de sodio al 1%
Figura 5 Relación de fuerza de gel, elasticidad y nivel de sodio adicionado (ratio).
Numerosos trabajos de investigación han presentado resultados sobre solubilización de la proteína de calamar gigante a diferentes fuerzas iónicas con NaCl en concentraciones de 1.0% (Sánchez -Alonso et al., 2007), 2.0% (Campo-Deaño et al., 2009), 2.5% (Cortés-Ruiz et al., 2008, De la Fuente Betancourt et al., 2008, Dihort-García et al., 2011), 2.7% (Maza et al., 2003) y 3.0% (Maza y Rosales, 2004; Albrecht-Ruíz et al., 2017), obteniendo resultados variables dependiendo del método aplicado a la extracción de proteína. Los rangos usados de sodio adicionados fluctuaron entre 1000 a 1500 mg de sodio /100 g.
Se evidencia una mejora en fuerza de gel entre los surimis a partir de coloides sol con citrato sódico en comparación con el coloide con NaCl (Figura 6). El uso de citrato sódico permite obtener productos con menores cantidades de iones sodio, mejorando las propiedades de textura, además de reflejar su efecto múltiple al actuar en el sistema sol proteico (efecto quelante-efecto estabilizante y termoestabilizador del citrato sódico).
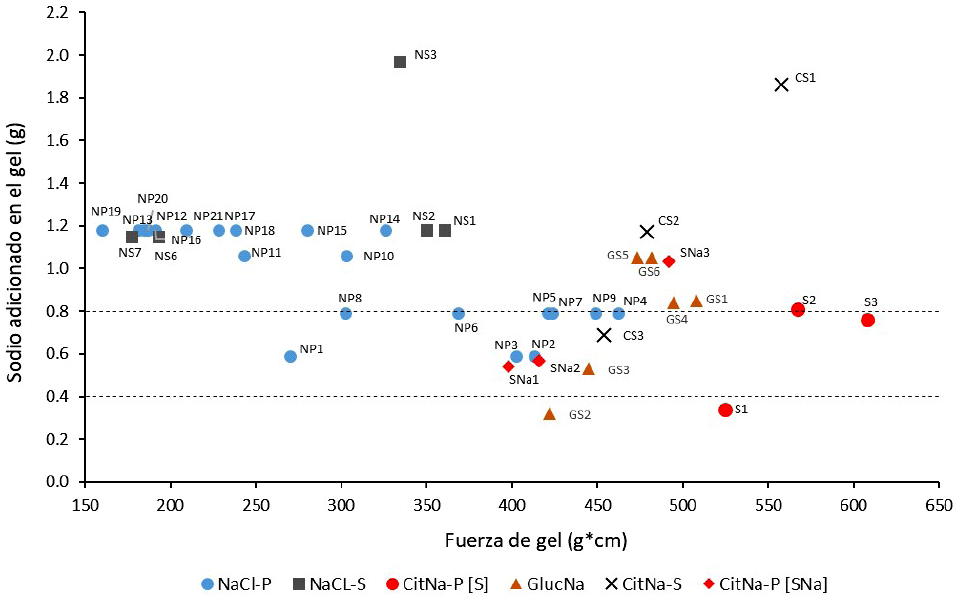
- NaCl-S: Surimis de calamar o aislados solubilizados con cloruro de sodio (Kuwahara et al. [2003]: NS1-NS5 / Park et al. [2005]: NS6-NS7)
- CitNa-S: Surimi de calamar solubilizado con citrato de sodio (Kuwahara et al. [2004]: CS1-CS3)
- CitNa-P [SNa]: Surimi de calamar gigante "SNa" solubilizado con citrato de sodio (Este trabajo: SNa1 - SNa3)
- CitNa-P [S]: Calamar gigante surimi "S" solubilizado con citrato de sodio (Este trabajo: S1 -S3)
- GlucNa: Surimis de calamar o aislados solubilizados con gluconato de sodio (Kuwahara et al. [2004]: GS1 / Kuwahara et al. [2004]: GS2-GS6)
Límite superior de sodio en alimentos final: 0.8 g/100 g
Límite inferior de sodio en alimentos final: 0.4 g/100 g
Figura 6 Efecto de diferentes sales y niveles de sodio en la fuerza del gel de calamar y calamar gigante. NaCl-P: Surimis de calamar gigante o aislados solubilizados con cloruro de sodio.
Al identificar la diferencia y la ventaja en el reemplazo de NaCl por citrato sódico en músculo de calamar gigante, a valores elevados de fuerza iónica con valores de sodio por encima del 1% en el sistema cárnico, se podría obtener mejor textura con citrato sódico, en rangos entre 420 a 670 g*cm a diferencia valores máximos de 350 g*cm utilizando NaCl. En el uso de sodio, coloides sol al 1.5% NaCl respecto a 1.27% de citrato sódico se obtuvieron valores de 590 mg/100 g y de 340 mg/100 g en fuerza de gel. A su vez, la cantidad de citrato sódico en 100 g de surimi proporciona el 17% de la ingesta diaria recomendada (2000 mg/d) y el NaCl aportaría 29.5%.
Además de la ventaja en las propiedades tecnológicas por la formación del coloide sol con citrato, la utilización de citrato sódico permite obtener un alimento reducido en sodio y cumplir con los límites vigentes de 800 mg de sodio por 100 g de alimento sólido (EFSA, 2019). Por otro lado, dentro de un plazo cercano, los límites de contenido de sodio se reducirán a 400 mg de sodio por 100 g en alimento sólido (Ley N.° 30021, Ley de Promoción de la Alimentación Saludable 2013 [MINSA, 2017]). En este contexto, solo el citrato en la matriz cárnica de calamar gigante lograría cumplir con la reglamentación sanitaria (340 mg sodio/100 g).
Los resultados obtenidos en el presente estudio indican que es factible la utilización de citrato sódico como agente formador del coloide sol a partir de surimi obteniéndose mejor gelificación y mayores valores de textura con la ventaja de reducir el contenido de sodio en el surimi.
CONCLUSIONES
El citrato de sodio es una opción para la formación adecuada del coloide sol y mejora de las características de textura en geles de surimi de calamar gigante entre las concentraciones de 1.27-3.0%, pero no brinda beneficios como agente crioprotector.
La sustitución de NaCl por citrato de sodio representa un aporte nutricional en el procesamiento del surimi como alimento concentrado proteico con una reducción de sodio del 31.4% ante el uso de cloruro sódico.












 uBio
uBio