INTRODUCCIÓN
Los animales de compañía, especialmente los perros, están adaptados para vivir en estrecha relación con los humanos, lo que contribuye al bienestar social y emocional de sus dueños, en particular los niños (Cainzos et al., 2018; Escalada Mena et al., 2020). No obstante, a pesar de los múltiples beneficios, esta estrecha asociación tiende a aumentar el riesgo de adquirir enfermedades zoonóticas a través de las mascotas (Suganya et al., 2019). Los parásitos intestinales de los perros están difundidos en todo el mundo y son motivo de preocupación debido a su potencial zoonótico (Lee et al., 2010, Rostami et al., 2019) y, por tanto, han sido reconocidos como un importante problema de salud pública, especialmente en países en vías de desarrollo (Soriano et al., 2010).
En Chile, diversos estudios han demostrado la presencia de endoparásitos con potencial zoonótico de origen animal en parques públicos de las ciudades (López et al., 2006; Gorman et al., 2006; Armstrong et al., 2011; Luzio et al., 2015; Quilodrán et al., 2018). Las diversas formas parasitarias (huevos, ooquistes y quistes de parásitos) que pueden estar presentes en el suelo de parques y espacios públicos aumentan el riesgo de infección parasitaria en las mascotas y con ello la transmisión a sus dueños, especialmente niños y personas inmunodeprimidas (Robertson et al., 2000). Sin embargo, no hay datos publicados que indiquen contaminación parasitaria de heces caninas provenientes de perros con dueño en el país. Por tanto, el presente estudio tuvo por objetivo determinar la ocurrencia de parásitos intestinales en perros con dueño pertenecientes a la ciudad de Talca entre julio y diciembre 2020 y su asociación con las variables edad, estado sanitario y confinamiento. El estudio aportará datos epidemiológicos de relevancia, tanto para la salud animal como humana y los potenciales riesgos zoonóticos bajo el enfoque Una Salud (One Health).
MATERIALES Y MÉTODOS
El estudio se llevó a cabo en la ciudad de Talca, Chile (35°252 593 S, 71°402 003 O), capital de la región del Maule. La zona cuenta con una población aproximada de 220 357 habitantes (CENSO, 2017) y presenta clima mediterráneo.
La obtención de muestras fecales se realizó mediante un muestreo por conveniencia con un n=100 a partir de dos clínicas veterinarias particulares de la ciudad de Talca participantes en el estudio (Integravet y Los Robles), o de forma domiciliaria. En todos los casos se realizó examen clínico a los caninos y las muestras fecales se recogieron inmediatamente después de la defecación espontánea o mediante torulado rectal en cirugía, previo consentimiento informado a los dueños.
Se observaron características macroscópicas de las heces tales como consistencia y la posible detección de proglótidos o gusanos. Se transfirió una submuestra de 2-3 g a un tubo Falcón de 15 ml con 8 ml de solución conservante de SAF (sodio acetato, ácido acético y formalina). Cada tubo se rotuló con el nombre y número de identificación del animal y se trasladó al Laboratorio de Parasitología de la Universidad Santo Tomás, Talca, Chile para el examen coprológico. Se excluyeron del estudio los perros sin dueño o representante legal.
Junto con la muestra fecal, se recopilaron datos epidemiológicos de los animales:
Edad, cachorro: 0-1 año; adulto: 1.1-7 año; senior: más de 7 años,
Confinamiento, indoor: caninos que viven en sus hogares y salen solo bajo supervisión de su tutor con su correa correspondiente; outdoor: caninos que se desplazan sin control de dueño en espacios urbanos exteriores y cuya presencia en su hogar se limita solo a procesos de alimentación o descanso nocturno,
Estado sanitario del animal: al día: la afirmación por parte de los dueños de la administración de desparasitación interna durante los últimos seis meses; atrasado: ausencia de desparasitación interna en dicho periodo.
El examen coprológico consistió en una modificación del método coprológico de sedimentación difásica con formol-éter dietílico (SAF) (Yang y Scholten, 1977; Young et al., 1979), utilizando la técnica de flotación de cloruro de sodio en el sedimento. Este método permite la detección de huevos, larvas, quistes, esporoquistes y ooquistes de parásitos. Los huevos del parásito se diferenciaron según sus características morfológicas (Deplazes et al., 2013).
En el análisis estadístico se definió la prevalencia según Bush et al. (1997). Para determinar la asociación entre la prevalencia y las variables asociadas analizadas (edad, confinamiento y estado sanitario), se utilizó la prueba de probabilidad exacta de Fisher, la prueba de Chi cuadrado y el Odds ratio (OR). Se consideraron significativos los valores de p<0.05. Todos los análisis estadísticos se realizaron utilizando el software GraphPad Prism v. 2.0.
RESULTADOS Y DISCUSIÓN
Se encontraron huevos de nematodos intestinales en 18 muestras (18/100) indicando una prevalencia total del 18%. Esta prevalencia fue mayor a la esperada considerando que el 42% de los dueños de perros indicaron tratar a sus mascotas con antihelmínticos (Cuadro 1).
Cuadro 1 Frecuencia de perros con dueño con endo-parasitismo, según las variables epidemiológicas, en la ciudad de Talca, Chile, mediante un muestreo por conveniencia (n =100) entre julio y diciembre de 2020
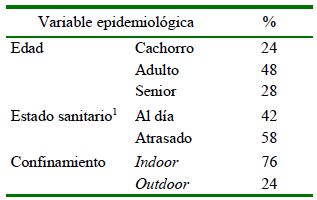
1 Al día: El dueño afirma la desparasitación interna en los últimos seis meses; Atrasado: ausencia de desparasitación interna en dicho periodo
Las especies de endoparásitos intestinales encontrados fueron Toxocara canis (14 muestras) y Trichuris vulpis (5 muestras).
Los cachorros presentaron cuatro veces más riesgo de presentar infección con nematodos intestinales que los perros adultos (OR = 3.51; p=0.03) y ocho veces más riesgo respecto a los perros senior (OR = 7.8; p=0.01), en tanto que los perros adultos demostraron tener dos veces más riesgo de presentar esta infección que los perros senior (OR = 2.2; p=0.47). En este aspecto, la gran fertilidad de estos parásitos, asociada a la resistencia de los huevos de T. canis (Jordan et al., 1993) contribuye para una contaminación ambiental acumulativa (Oliveira-Sequeira et al., 2002; Katagiri y Oliveira-Sequeira, 2008).
La infección de cachorros se atribuye principalmente al paso transplacentario de larvas, principal vía de transmisión del parásito (Macpherson, 2013). Además, la infección en perros adultos, especialmente en aquellos con hábitos outdoor, se puede originar a partir del consumo de hospederos paraténicos, tales como roedores o lagomorfos, ya que las larvas, una vez ingeridas, pueden originar gusanos adultos en el intestino sin sufrir una migración somática (Parsons, 1987). En el presente estudio, los perros con dueño con hábitos outdoor tienen un mayor riesgo de infección por T. canis y también podrían desempeñar un papel zoonótico en la toxocariasis humana (Inagaki et al., 2019; Gakosso et al., 2020; Nicoletti, 2020).
En Chile existen reportes que demuestran infección humana por Toxocara con base a la medición del antígeno somático por la técnica de ELISA en pacientes con lesiones oculares y eosinofilia, indicando mayores frecuencias de infección en niños que viven en centros urbanos, con contacto con perros y gatos, y que practica geofagia (Tribiño et al., 1999; Sánchez et al., 2011). La neurotoxocariasis es menos frecuente y sus manifestaciones incluyen eventos de meningitis y encefalitis. Esta forma de infección por Toxocara en humanos también ha sido descrita en Chile a través de estudios serológicos utilizando pruebas de ELISA, tomografía computarizada cerebral y resonancia magnética (Fica et al., 2021).
Además de T. canis, se encontró Trichuris vulpis en perros adultos, no desparasitados y con hábitos indoor. Zanzani et al. (2014), en forma similar ha reportado esta parasitosis en perros en Chile, especialmente en presencia de múltiples mascotas. Sin embargo, la propagación de la infección por T. vulpis a través de la contaminación ambiental, incluidos parques y plazas, pareciera ser el factor principal que contribuye a la mayor prevalencia de T. vulpis en perros (Robertson y Thomson, 2002; Taylor et al., 2007). La tricuriasis humana o tricocefalosis ha sido reportada en Chile (Sapunar et al., 1999) y es detectada mediante colonoscopía. Las manifestaciones clínicas pueden ser desde asintomáticas a la presentación diarrea crónica, dolor y distensión abdominal entre otros (Betson et al., 2015).
La relación entre la presencia de nematodos intestinales con el confinamiento de las mascotas tuvo significancia estadística (p=0.001; Cuadro 2). El Odds ratio calculado fue de 6.07, indicando que perros outdoor tienen seis veces más probabilidades de riesgo de presentar nematodos intestinales que los perros indoor. Una posible explicación a la prevalencia observada de parásitos intestinales en perros indoor es la contaminación ambiental provocada por la presencia de fecas infectadas con huevos de helmintos provenientes de la introducción de mascotas adoptadas sin previa desparasitación, o introducción de fómites contaminados con heces infectadas (Ruvalcaba et al., 2018).
Cuadro 2 Distribución de animales positivos y negativos a parásitos intestinales (p value) según variables epidemiológicas en perros con dueño muestreados en la ciudad de Talca, Chile, entre julio y diciembre 2020

1 Al día: El dueño afirma la desparasitación interna en los últimos seis meses; Atrasado: ausencia de desparasitación interna en dicho periodo
Por otro lado, la relación entre el estado sanitario y la presencia de nematodos intestinales resultó ser no significativa. En este aspecto, se debe considerar que solo 8/68 de perros tratados presentaron la infección, y estos pudieron haberse infectado al ingerir huevos infectantes durante los paseos diarios con sus dueños, considerando la existencia de altas cargas parasitarias existentes en ambientes outdoor. Junto con ello, la venta de fármacos antiparasitarios en Chile se realiza sin receta médico-veterinaria, lo cual favorece la inadecuada elección de estos fármacos por parte de tutores de mascotas, junto con posibles errores en dosificación y frecuencias de administración. Esto podría interferir en la adecuada protección antiparasitaria y, al mismo tiempo, promover la resistencia a ciertos fármacos.
Dado que los perros muestreados tienen dueño, existe un mayor riesgo de transmisión zoonótica de estos parásitos a las personas tal como ha sido demostrado en recientes estudios (Fica et al., 2021) lo cual pone en evidencia la importancia de la tenencia responsable de mascotas, la correcta desparasitación, y la educación a la población respecto a la importancia de la salud animal y los riesgos asociados de la transmisión de parásitos zoonóticos desde las mascotas a los humanos.
CONCLUSIONES
El 18% (18/100) perros con dueño se encontraban parasitados con nematodos intestinales en la ciudad de Talca, Chile.
Los parásitos identificados fueron Toxocara canis y Trichuris vulpis.
La mayor prevalencia del endoparasitismo se presentó en cachorros y perros con hábitos de permanecer en ambientes externos a la casa sin control de los dueños.
No se encontró diferencias significativas en la prevalencia de parásitos intestinales en perros que fueron dosificados en los últimos seis meses con aquellos que no lo fueron.












 uBio
uBio 


