INTRODUCCIÓN
La toxoplasmosis es una de las parasitosis más prevalentes a nivel mundial, cuyo agente etiológico es Toxoplasma gondii, un protozoario intracelular obligado, perteneciente al phylum Apicomplexa, familia Sarcocystidae y género Toxoplasma. Este parásito tiene la capacidad de infectar a un gran número de especies animales, incluido el hombre. Estos pueden infectarse mediante tres estadios parasitarios: por la ingesta de ooquistes esporulados en suelo, agua o alimentos contaminados, por la ingesta de quistes tisulares presentes en tejidos de los hospederos intermediarios, y por transmisión vertical de taquizoítos (Tenter et al., 2000).
El hombre se infecta principalmente tras la ingesta de carnes infectadas crudas o poco cocidas y al tomar leche cruda de cabra contaminada con taquizoítos (Dubey, 2010). Se reconoce una correlación significativa entre seropositividad en animales de producción y el desarrollo de quistes tisulares en los distintos tejidos u órganos (Opsteegh et al., 2016). El desarrollo clínico de la toxoplasmosis en el humano suele darse de forma asintomática en individuos inmunocompetentes, pero es considerablemente grave en caso de darse una primoinfección en mujeres gestantes y en individuos con algún compromiso inmunológico, donde la parasitosis es potencialmente fatal (Cook et al., 2000).
Los caprinos forman parte del gran número de especies que son hospederos intermediarios de T. gondii, con el riesgo de poder transmitir la infección a la cría en desarrollo en gestaciones reiteradas, pudiendo provocar mortalidad perinatal y principalmente abortos, todo ello dependiendo de la etapa de gestación en la que ocurra la primoinfección, y por lo tanto, afectando la economía de los capricultores (Cordero del Campillo y Rojo, 2001). Los caprinos tienen gran valor para las poblaciones rurales marginadas del Perú, ya que constituye un recurso económico, alimenticio y proteico (MINAGRI, 2017).
En el país son limitadas las investigaciones preliminares relacionadas a la toxoplasmosis en caprinos. Se tiene el reporte de Rivera et al. (1988) en caprinos de siete departamentos del Perú, donde determinaron una seroprevalencia global de 33.6%. Por otro lado, Chávez (2020) realizó un trabajo de investigación reciente llevado a cabo en caprinos de 23 departamentos y determinó 28.15% de seroprevalencia global, estableciendo asociaciones significativas a variables como: ubicación, sistema de crianza y piso altitudinal. Por consiguiente, el objetivo del presente estudio fue determinar la seroprevalencia de Toxoplasma gondii en cabras del departamento de Piura y establecer la posible asociación entre las variables procedencia, sistema de crianza, edad y piso altitudinal con la seropositividad a la parasitosis.
MATERIALES Y MÉTODOS
Lugar de Estudio
Se trabajó con cabras procedentes del departamento de Piura, con edad mayor a 6 meses y clínicamente sanas. Las muestras de suero de estos animales se procesaron en el Laboratorio de Parasitología de la Facultad de Medicina Veterinaria (FMV) de la Universidad Nacional Mayor de San Marcos (UNMSM), Lima, Perú.
Muestras
Durante los años 2017 y 2018 se puso en marcha un estudio a nivel nacional para el monitoreo de la brucelosis caprina por parte del Servicio Nacional de Sanidad Animal (SENASA) donde se colectaron muestras de sangre en forma aleatoria. Estas muestras, luego del estudio original, fueron mantenidas a -20 °C para posteriores investigaciones, siendo en parte donadas a la FMV-UNMSM para llevar a cabo diversos trabajos de investigación respecto a enfermedades infeccionas en la especie caprina.
Las muestras se clasificaron según la provincia de procedencia de las cabras (Piura, Ayabaca, Paita, Sechura, Sullana, Huancabamba, Morropón y Talara), grupo etario (<1, 1-3 y >3 años), sistema de crianza (intensiva, extensiva) y piso altitudinal (0-500, >500-2500 msnm). En el presente estudio solo se trabajó con muestras de un banco de sueros, por ello no se vulneró a ninguna especie animal.
Tamaño Muestral
El tamaño muestral fue determinado haciendo uso de la fórmula para la estimación de una proporción en una población infinita (Daniel, 2002), con 95% de nivel de confianza, 5% de error máximo admisible y con una seroprevalencia referencial de 33.6% indicado por Rivera et al. (1988), obteniéndose un tamaño muestral de 343 muestras. En el estudio, y ante la disponibilidad del banco de muestras de suero, se trabajó con 362 muestras que fueron distribuidas de manera proporcional al número de cabras en cada provincia: Sullana (103 muestras), Ayabaca (94 muestras), Piura (65 muestras), Morropón (37 muestras), Huancabamba (31 muestras), Sechura (16 muestras), Paita (11 muestras) y Talara (5 muestras).
Procesamiento de las Muestras
Se empleó el kit ID Screen(r) Toxoplasmosis Indirect Multispecies ELISA (IDvet, France) para la detección de Inmunoglobulinas G (IgG) contra Toxoplasma gondii (antígeno P30) en los sueros caprinos. El cambio de color en los pocillos de las placas se midió en un lector automático de ELISA Kaito-RT-2100C, usando filtro de 450 nm. La prueba tiene una sensibilidad de 98.36% y una especificidad de 98.8%, según el manual del kit comercial.
Análisis de los Datos
Se tuvo en consideración las muestras con resultado positivo al ELISA indirecto (las muestras con resultado sospechoso o dudoso se excluyeron de todos los análisis estadísticos) y se hizo el cálculo de la seroprevalencia aparente, expresada en porcentaje. Con base a los porcentajes de especificidad y sensibilidad de la prueba diagnóstica se calculó la seroprevalencia real con sus respectivos intervalos de confianza (IC 95%). Además, se determinaron los intervalos de confianza con la finalidad de evaluar si existían diferencias estadísticamente significativas entre las seroprevalencias reales y las variables en análisis. Finalmente, se determinó la fuerza de asociación entre la seropositividad a la parasitosis y la variable piso altitudinal al estimar el Odds Ratio (OR) con su respectivo intervalo de confianza (Ruiz y Morillo, 2004; Jaramillo y Martínez, 2010).
RESULTADOS
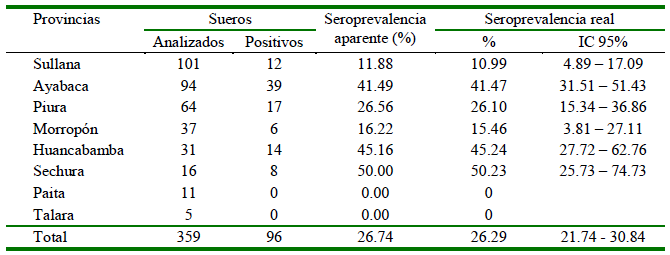
De un total de 362 muestras analizadas, tres resultaron dudosas y fueron retiradas del análisis estadístico. Por otro lado, 96 de las 396 muestras fueron positivas a T. gondii, resultando en una seroprevalencia aparente de 26.74% y una seroprevalencia real de 26.29 ± 4.55%. La seroprevalencia por provincia se presenta en el Cuadro 1, donde las provincias de Sechura (50.23%), Huancabamba (45.24%) y Ayabaca (41.47%) presentan las prevalencias más altas.
Cuadro 1 Número de cabras seropositivas a Toxoplasma gondii mediante la técnica de ELISA indirecto y según la provincia de procedencia. Piura, 2018
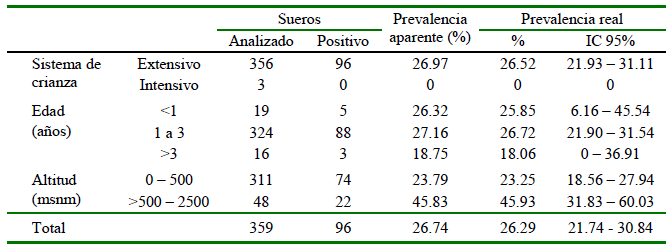
En el Cuadro 2 se presenta la seropositividad a Toxoplasma gondii según el sistema de crianza, edad y piso altitudinal. La seroprevalencia real según el sistema de crianza fue de 26.52 ± 4.59% (96/356) para el sistema de crianza extensivo y de 0% (0/3) al sistema de crianza intensivo. La seroprevalencia real según la edad fue relativamente similar para los tres grupos etarios aunque ligeramente menor para las cabras mayores de tres años (18.06 ± 18.83) (3/16), mientras que las cabras del piso altitudinal entre 500 a 2500 msnm presentaron una seroprevalencia real de 45.93 ± 14.10% (22/48) y las del estrato 0-500 msnm de 23.25 ± 4.69% (74/311).
Cuadro 2 Número de cabras seropositivas a Toxoplasma gondii mediante la técnica de ELISA indirecto según el sistema de crianza, edad y piso altitudinal. Piura, 2018
El cálculo del Odds Ratio (OR) para evaluar la fuerza de asociación entre la infección por toxoplasmosis y la variable piso altitudinal arrojó un valor de 0.37 (IC 95%: 0.20 - 0.69), indicando que un piso altitudinal de 0 a 500 msnm es un factor protector para la infección por T. gondii en las cabras del departamento de Piura, comparándolo con el piso altitudinal de 500 a 2500 msnm.
DISCUSIÓN
La seroprevalencia real de Toxoplasma gondii en las cabras del departamento de Piura fue del 26.29% (IC 95%: 21.74 30.84%) mediante el uso de un test de ELISA indirecto como método de diagnóstico serológico. Contrastando con los escasos reportes existentes en el país, la frecuencia hallada coincide con un reciente estudio realizado por Chávez (2020), quién empleó también el ELISA indirecto como método de diagnóstico serológico y reportó una seroprevalencia de 28.15%; mientras que fue ligeramente menor al 33.6% mencionado por Rivera et al. (1988), con la diferencia que en dicho estudio se empleó como prueba diagnóstica la Hemaglutinación Indirecta (HAI).
Los resultados del presente estudio son concordantes con el 30.7% reportado en Brasil (Romanelli et al., 2020), el 21.23% reportado en China (Wang et al. (2020), el 30% reportado en La India (Sharif et al., 2007) y el 27.90% reportado en Tailandia (Jittapalapong et al., 2005). Sin embargo, los hallazgos del presente estudio difieren de otras frecuencias reportadas, siendo superior al 6.8% reportado en Corea (Jung et al., 2014), al 14.5% reportado en Brasil (Mainardi et al., 2003) y al 17% reportado en Noruega (Stormoen et al., 2012) e inferior a frecuencias reportadas en China de 42.5% (Zhou et al. (2018), en Brasil de 40.5-49.4% (Rêgo et al., 2016), en India de 42.47% (Bachan et al., 2018) y enArgentina de 39% (Gos, 2019).
La alta variabilidad en los valores reportados en la literatura puede estar asociada a múltiples factores; entre ellos, la prueba serológica empleada y el punto de corte empleado como criterio de seropositividad, así como las características de los animales en estudio (Tenter et al., 2000). Inclusive se ha encontrado porcentajes variables de seroprevalencia dentro del mismo país, posiblemente debido, además, al tamaño de muestra, y a las características climáticas y geográficas (Díaz et al., 2016; Zhou et al., 2018).
Las seroprevalencias reales más elevadas se presentaron en Sechura (50.23 ± 24.50%), Huancabamba (45.24 ± 17.52%) y Ayabaca (41.47 ± 9.96%). Por otra parte, no hubo animales seropositivos en Paita y Talara, lo cual pudo ser el reflejo del bajo número de muestras en dichas provincias. No obstante, los resultados ponen en evidencia la gran contaminación con ooquistes de felinos que existiría en la región de Piura, además, de revelar el deficiente sistema de manejo que llevan los capricultores de la zona.
No se encontró diferencia significativa entre la toxoplasmosis en cabras con la variable edad, lo cual significa que la parasitosis puede darse en cualquiera de los rangos etarios evaluados sin diferencia alguna. No obstante, diversas investigaciones han determinado que la seroprevalencia de la toxoplasmosis se incrementa con la edad de los animales, ya que un animal que ha vivido más tiempo se ha podido infectar por diversas fuentes o ha tenido una mayor probabilidad de contagio a comparación de un animal joven (Teshale et al., 2007; Cavalcante et al., 2008).
Se evidenció, asimismo, una mayor y significativa seroprevalencia en cabras manejadas bajo un sistema de crianza extensiva, lo cual está de acuerdo con reportes que indican una mayor probabilidad de infección en los animales de crianza semi-extensiva o extensiva. Esto debido a la mayor exposición a un entorno ambiental que puede estar contaminado con formas infectivas del parásito en comparación con animales criados bajo un régimen intensivo, donde hay un mejor control sanitario y adecuados protocolos de bioseguridad (Figueiredo et al., 2001; Neto et al., 2008; Tzanidakis et al., 2012; Luyo et al., 2017). Sin embargo, se debe reconocer que el bajo número de animales muestreados en el sistema de crianza intensivo en el presente estudio pudo haber influido en los resultados obtenidos.
La asociación entre la infección por toxoplasmosis y la variable altitud fue significativa (p<0.05). El Odds Ratio (OR) fue 0.37 (IC 95%: 0.20 - 0.69), lo cual indicó que un piso altitudinal de 0 hasta 500 msnm fue un factor protector para la infección por T. gondii en cabras, comparándolo con un piso altitudinal superior a 500 hasta los 2500 msnm. Estos hallazgos coinciden con otras investigaciones en rumiantes menores (Tegegne et al., 2016; Gebremedhin et al., 2014), con excepción del estudio de Caballero-Ortega et al. (2008) en México quienes encontraron menor riesgo de infección por T. gondii en crianzas por encima de 1200 msnm, aunque indicaron que la presencia de gatos tenía más relevancia que el piso altitudinal por sí solo.
CONCLUSIONES
La seroprevalencia real de Toxoplasma gondii en cabras del departamento de Piura utilizando la prueba de ELISA indirecto fue de 26.29 ± 4.55% (IC 95%: 21.74 -30.84%).
La variable grupo etario no fue considerada como factor de riesgo para la infección por toxoplasmosis.
La seropositividad a T. gondii se asoció significativamente a la variable piso altitudinal.
El piso altitudinal de 0 a 500 msnm se consideró factor protector (OR: 0.37) frente a la infección por toxoplasmosis, comparándolo frente a un piso altitudinal de 500 a 2500 msnm.












 uBio
uBio 


