INTRODUCCIÓN
El mundo en la actualidad sufre una serie de graves, crecientes y complejos problemas ecológicos, siendo la contaminación química por actividades antropogénicas uno de las que causan mayor impacto (Rahman y Singh, 2011; Jahandari, 2020). Los compuestos que intervienen en esta situación son diversos, pero los metales pesados sobresalen por su variedad y peligrosidad (Ali et al., 2019; Abalaka 2020). El uso social e industrial variado y extendido de estos elementos, unido al manejo inadecuado de la actividad minero-extractiva y sus residuales han favorecido el incremento alarmante de sus concentraciones globales, a tal punto, que se les considera uno de los mayores retos de la sociedad moderna (Alam et al., 2020).
Los conocimientos acumulados sobre metales pesados indican que los componentes bióticos y abióticos de los ecosistemas de agua dulce superficial son los más afectados (Rosales et al., 2019; Aportela y Paulino, 2020); sin embargo, no siempre es posible estimar el impacto real de la interacción biotametales pesados. Influyen en este hecho la existencia de una gran variedad de elementos metálicos, la formación de mezclas difíciles de prever y cuantificar, y los complejos mecanismos de acción, así como la enorme variedad de organismos acuáticos involucrados, entre otros factores (Wu et al., 2016; Ali y Khan, 2017; Timpano et al., 2022).
En este contexto tan complejo, la histopatología puede convertirse en una valiosa herramienta en estudios ambientales de fuentes antropogénicas generadoras de especies metálicas (Van der Oost et al., 2003). El análisis de la severidad y extensión de las modificaciones en tejidos procedentes de individuos expuestos permite aportar evidencias irrefutables de sensibilidad o tolerancia a estos elementos, proponer mecanismos de acción, y además realizar inferencias sobre el estado de salud de la población a la cual pertenece (Gernhofer et al., 2001; Fagbuaro et al., 2020). A pesar de estas ventajas, no es frecuente encontrar en la literatura especializada experiencias prácticas en peces de agua dulce, aspecto que complica aún más la búsqueda de evidencias sobre la toxicidad in vivo de metales.
Estas dificultades ambientales y científicas también se visualizan en Cuba, siendo la mina grande de cobre en Santiago de Cuba el mejor ejemplo de ello. La literatura nacional consultada refiere que el vertido histórico de residuales mineros en el río aledaño (desde 1544 hasta 2001) ha provocado un deterioro de sus segmentos abióticos y bióticos (González et al., 2009; Gámez et al., 2019). Si bien la clausura de la mina constituyó un gran avance desde el punto de vista ambiental, no evitó la persistencia del impacto químico negativo en las aguas superficiales en años posteriores (Marañón et al., 2009), tal y como ha sucedido en otros casos a nivel mundial (Luís et al., 2011; Camizuli et al., 2014; Gigantone et al., 2020). Bajo estas condiciones se hace necesario profundizar en las consecuencias biológicas asociadas que las actividades minero-extractivas de cobre provocan en la ictiofauna del lugar, razón por la cual se realizó un estudio para describir la respuesta tisular del pez Gambusia punctata crecido en condiciones naturales y bajo la exposición crónica de metales pesados.
MATERIALES Y MÉTODOS
Localización y Peces
El sitio de estudio se localizó en el río Cobre (20° 02' 28" N 75° 54' 23" W), a una distancia aproximada de 10 km aguas abajo del área que ocupa la antigua gran mina de cobre a cielo abierto, cercano al canal de entrada del embalse artificial denominado Parada, ubicado en la costa sur de la provincia de Santiago de Cuba, Cuba (Figura 1).

Figura 1 Localización aproximada del área correspondiente a la antigua gran mina de cobre (AMC), y el punto de muestreo (PM). Santiago de Cuba, Cuba
Se capturaron 40 peces adultos de Gambusia punctata en horario de la mañana y en época poco lluviosa. Los especímenes de ambos sexos fueron inspeccionados in situ, desechándose los de talla menor de 2 cm de largo total, mutilados o de apariencia externa no saludable (según color y textura de la piel). Los peces seleccionados fueron colocados en bolsas plásticas, conservados en recipientes con hielo y trasladados al laboratorio.
Histoquímica e Histopatología
El material de estudio fue trasladado en un inicio al laboratorio de histopatología perteneciente al Centro de Toxicología y Biomedicina, ubicado en Santiago de Cuba, fijados en formol al 10% y ,osteriormente deshidratados con soluciones de alcohol a concentraciones crecientes (50, 70, 90 y 100%) por 5 min cada uno y aclarados con xilol. Los ejemplares por separado fueron embebidos en parafina en forma de bloques y cortados a 7 µm de grosor (Leica RM 2125 RT), e hidratados. Se obtuvieron tres cortes por individuo, con una distancia entre cortes de 14 µm.
Los ejemplares para su tinción fueron remitidos al departamento de anatomía patológica perteneciente al hospital docente-clínico-quirúrgico Dr. Joaquín Castillo Duany de Santiago de Cuba. De estos, 20 fueron teñidos con Hematoxilina-eosina y los individuos restantes fueron divididos en partes iguales para su coloración con la técnica de nitrato piridina de Cajal (para visualizar prolongaciones nerviosas) y Perls (detección de depósitos de hierro no hemático) según lo describen Corominas et al. (1992) y Meguro et al. (2007), respectivamente.
Análisis de Datos
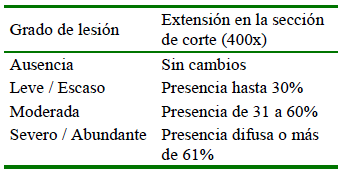
Para identificar las posibles anomalías histológicas en las estructuras que conforman a los especímenes, los cortes utilizados tenían que cumplir los criterios de integridad del tejido y epitelio claramente definido. La severidad de cada lesión (Cuadro 1) fue evaluada de acuerdo con el grado de extensión (Bernet et al., 1999).
Cuadro 1 Valoración subjetiva semicuantitativa de hallazgos tisulares microscópicos en peces Gambusia punctata según su grado de extensión
El cálculo de la frecuencia de aparición de modificaciones histológicas (MH) en los órganos se realizó según la fórmula MH (%) = (Peces con modificaciones histológicas / Total de peces) x 100.
RESULTADOS
Hallazgos Tisulares
La observación detenida de los tejidos procedentes de G. punctata permitieron identificar daños branquiales con extensión moderada en el 80% de los individuos investigados (Figura 2b). Las deformaciones branquiales se caracterizaron, en general, por pérdida irreversible de la simetría lamelar y de sus evaginaciones, lo cual condujo a una rigidez de la estructura con disminución del área de superficie para el intercambio gaseoso. En particular, la deformación branquial se caracterizó por pérdida del epitelio simple plano que recubre la estructura, engrosamiento lamelar con pérdida completa de su morfología normal (Figura 2a), desorganización epitelial, congestión venosa y fusión de las lamelas secundarias en diferentes grados de evolución (Figura 2b). Teniendo en cuenta la importancia de las branquias en el proceso respiratorio (Roa et al., 2011) y el número elevado de individuos afectados por las deformaciones, se infiere que la población de esta especie en condiciones naturales está sometida a continuas situaciones de hipoxia.
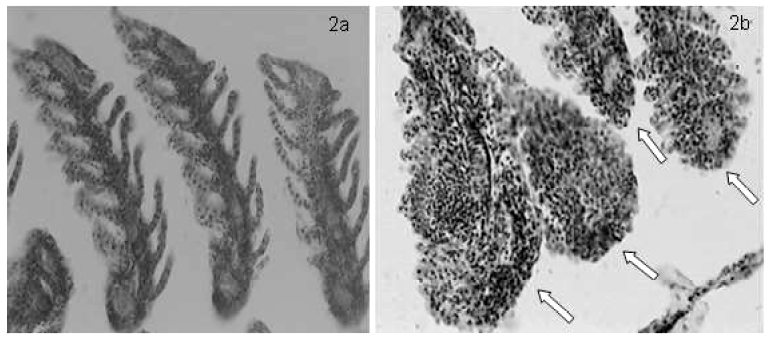
Figura 2 Microfotografía de estructuras branquiales de Gambusia punctata sin lesiones aparentes (a) y con pérdida total de la morfología tisular típica en diferentes grados de evolución (b). H&E. 400x
El análisis comparativo del cuadro histopatológico observado en G. punctata con estudios similares corroboró la sensibilidad del tejido branquial frente a bioagresores con independencia de la especie (Bibi et al., 2021) y, por tanto, su utilidad para reflejar las condiciones ambientales próximas a los sitios de captura (Oliveira et al., 2021). Asimismo, se reveló un patrón lesional común con Oreochromis niloticus, Clarias gariepinus y salmónidos expuestos a mezclas de metales pesados (Roa et al., 2011; Oladapo et al., 2019; Abalaka et al., 2020), incluyendo el cobre (Wani et al., 2011). Estas similitudes, unido a los antecedentes de contaminación minera del ecosistema por más de 400 años (Marañón et al., 2009; Gámez et al., 2019) y la ausencia de lesiones compatibles con agentes infecciosos, señalan como probable responsable a los metales pesados.
Otro hallazgo tisular que dio una clara idea del posible y persistente impacto minero en G. punctata fue el hallazgo donde se visualizan numerosos agregados (gránulos) de hierro insolubles en forma de hemosiderina, ubicados en el interior las células epiteliales intestinales (Figura 3). La abundancia de depósitos observados por campo visual en todos los especímenes analizados permitió inferir la existencia de una sobrecarga férrica del ecosistema, biodisponibilidad del metal, existencia de receptores específicos para captarlo y vías para almacenarlo intracelularmente (Chifman et al., 2014; Forrellat et al., 2000).
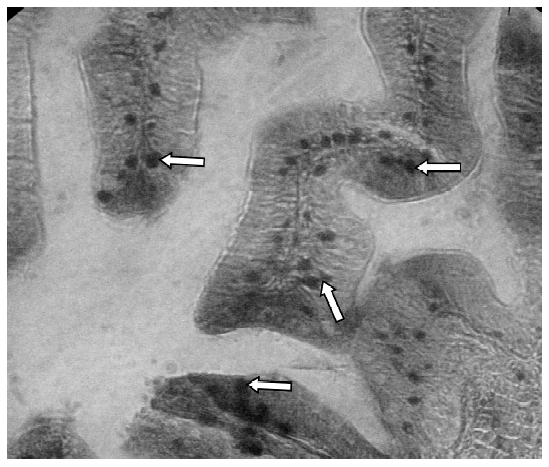
Figura 3 Epitelio entérico de Gambusia punctata con presencia de numerosas zonas de hemosiderina (flechas). Tinción de Perls. 400x
Explicar la presencia de depósitos corporales de hierro en el 100% de los individuos de vida libre, capturados aguas abajo de una mina de cobre abandonada, puede resultar complicado por los múltiples factores a tener en cuenta (Brázová et al., 2012). La entrada del hierro por la membrana apical de los enterocitos (sistema digestivo) y su permanencia intracelular es consistente con la biodisponibilidad del metal, el hábito de esta especie de ingerir sedimentos (Falcón-Hidalgo et al., 2011), y con el papel que desempeña este último en la acumulación de metales pesados por periodos prolongados (Niu et al., 2020), lo cual permite que interactúe a largo plazo con la biota local (Jones et al., 2020). Es así que la llegada de grandes cantidades de hierro al sedimento y, en consecuencia, a G. punctata pudo facilitarse por la combinación de vertimientos mineros y la alta carga orgánica que impactó al ecosistema tiempo atrás, producto del rápido incremento poblacional generado por la industrialización del yacimiento (Marañón et al., 2009).
De acuerdo con los conocimientos sobre el metabolismo del hierro en mamíferos se puede afirmar que su permanencia en las células entéricas es temporal (Bury y Grosell, 2003; Chifman et al., 2014); sin embargo, su destino final en G. punctata no está del todo esclarecido, pues podría excretarse en el próximo recambio celular normal o transportarse hacia otros tejidos para bioacumularse, tal y como ocurre en otras especies (Abalaka et al., 2020). De confirmarse una o las dos vías propuestas, se estaría en condiciones de entender mejor los posibles mecanismos moleculares adaptativos o de tolerancia desarrollados por G. punctata para reducir sus cargas corporales de hierro y poder habitar ecosistemas contaminados. De manera general, en este caso, se puede asegurar que la transferencia de metales pesados procedente de la antigua mina de cobre hacia organismos vivos no es historia pasada.
Con tales hallazgos tisulares, se esperó encontrar otras señales de alarma en diversos órganos, pero no fue así. La observación de los tejidos óseo, conectivo, muscular, nervioso (columna vertebral) e intestinal (Figura 4) mostró ausencia de daños histológicos en todos los especímenes evaluados. Estos resultados no son del todo desconcertantes, pues estos tejidos no están expuestos de forma directa al contaminante, ni son lugares activos de detoxificación (Abalaka et al., 2020).

Figura 4 Microfotografía de los tejidos óseo y conectivo (a), muscular estriado (b), nervioso y óseo (c), e intestinal (d) de Gambusia punctata sin lesiones aparentes. H&E (a, b, d). Tinción de Cajal (c). 400x
Los resultados en su conjunto permiten inferir que la mina a pesar de haber cesado sus labores extractivas continúa siendo una fuente contaminante para la biota residente aguas abajo, lo cual se corresponde en términos generales con investigaciones realizadas en antiguos sitios de extracción de oro (Soto-Benavente et al., 2020). En el presente caso, la extensa área que ocupa la mina a cielo abierto sin cubierta vegetal (Figura 1), propicia que gran cantidad de desechos mineros continúen en contacto directo con el oxígeno y la lluvia (Marañón et al., 2009). Bajo estas condiciones, se liberan constantemente pequeñas partículas conteniendo metales pesados, proceso que se acelera por las altas temperaturas. Estas partículas son dispersadas por los vientos o arrastradas por las precipitaciones hacia las aguas dulces superficiales cercanas, provocando la persistente contaminación (Punia, 2020; Perlatti et al., 2021) y los efectos biológicos en G. punctata descritos en este estudio.












 uBio
uBio 


