INTRODUCCIÓN
El mercurio (Hg) es un metal que se encuentra en la naturaleza, y que en elevadas concentraciones puede causar daño a nivel fisiológico y genético en organismos expuestos (Oze et al., 2006; Raissy, 2013). Este metal en su forma inorgánica se puede encontrar como cloruro de mercurio (HgCl2) debido a la presencia de actividades antropogénicas como minería y agricultura (Gómez et al., 2001; Weinberg, 2007).
HgCl2 es un agente genotóxico que puede causar fracturas cromosómicas o disfunción del huso mitótico, generando anormalidades nucleares (AN) y micronúcleos (MN) (Nirchio et al., 2019). Peñaloza et al. (2003) expusieron a peces Prochilodus magdalenae y Oreochromis sp a tres concentraciones de HgCl2 (0.001, 0.003 y 0.027 mg L-1) durante 7 días encontrando daños en el ADN de los especímenes. Por otro lado, el efecto del mercurio también podría alterarse por acción de factores fisicoquímicos en los ecosistemas acuáticos, un ejemplo de esta variación sería el ocasionado por la acidificación de los cuerpos de agua y el cambio climático (De la Vega, 2018). Tsai et al. (1975), trabajando con las especies Pimephales promelas y Notropis atherinoides bajo condiciones de laboratorio, demostraron que el HgCl2 al ser disuelto en un pH alcalino (7.59.0) redujo su transferencia del agua hacia los peces, pero se incrementó en ambientes acuáticos de pH ácido (4.0-6.5). Así mismo, Ávila y Loor (2018) evaluaron la concentración de Hg en músculo, hígado y branquias de en Oreochromis niloticus encontrando niveles mayores de Hg en el mes de octubre (24-28 °C, 0.36 ppm de Hg) y menores en el mes de agosto (21-26 °C, 0.28 ppm de Hg), lo cual se relaciona con el aumento de temperatura.
En los últimos años se vienen registrando incrementos de temperatura a nivel global, causado por la generación de gases de efecto invernadero, lo puede afectar los ecosistemas de agua dulce al cambiar la cantidad, calidad y tiempo de suministro de agua (García-Estrada, 2001; Bates et al., 2008). El Perú está considerado entre los tres países de Latinoamérica más afectados por el cambio climático, provocando deshielos, he-ladas, deforestación, oleadas de calor y cambios en sistemas de agua, como el incremento de temperatura de 2 a 3 °C en la cuenca del río Amazonas (Vargas, 2009; Pajares, 2014).
La variación de temperatura puede llegar a alterar el metabolismo y comportamiento de los animales acuáticos, como es el caso de O. niloticus, que, al percibir temperaturas altas, sobrepasando su temperatura óptima (28-31 °C), tiende a acelerar su apetito, tasa metabólica y consumo de oxígeno (Tsang y Quintanilla, 2008). Del mismo modo, juveniles de Colossoma macropomum expuestos a 35 °C, mostraron alteraciones histológicas, como eritrocitos con morfología anormal, hepatocitos con núcleos picnóticos y reducción del espacio de la cápsula de Bowman en los glomérulos (Rojas et al., 2013). Igualmente, ejemplares de Poecilia reticulata sometidos a cambios repentinos de temperatura (de 28 a 34 °C, 28 a 36 °C, y 28 a 38 °C) revelaron un porcentaje elevado de MN de 1.81 y 1.91% a 34 y 36 °C, respectivamente, mientras que a 38 °C se inhibió la proliferación celular (Tapia, 2017).
El efecto tóxico de los metales puede ser influenciado por la temperatura, como se demostró en el trabajo de Salazar et al. (2009), donde juveniles de C. macropomum fueron expuestos a 0.5mgL-1 de cadmio (Cd)a 25y 30 °C, provocando un incremento de linfocitos (74.3 a 79.4%) y una disminución de eosinófilos (1.44 a 1.12%), respuesta observada generalmente ante una infección. Del mismo modo, se sabe que la temperatura puede modificar la velocidad de absorción y acción de productos químicos y contaminantes ambientales en los organismos acuáticos, como metales, contaminantes orgánicos persistentes -COP, hidrocarburos aromáticos policíclicos -HAP y plaguicidas (Noyes et al., 2009; Holmstrup et al., 2010). Por ejemplo, en la especie amazónica Lepomis cyanellus (Nervárez-Rodriguez et al., 2013), se reportó altas concentraciones de Hg en músculos durante los meses de verano (0.098 mg kg-1) a diferencia de los meses de invierno (0.034 mg kg-1), debido a la biodisponibilidad del metal por el aumento de temperatura.
Por lo tanto, el presente estudio tuvo como objetivo determinar la CL50 para HgCl2 y su efecto genotóxico (AN y MN) frente al incremento de temperatura (28 y 32 °C) en alevines de O. niloticus, con la finalidad de demostrar la influencia de la temperatura en el daño producido por metales en ambientes acuáticos.
MATERIALES Y MÉTODOS
El estudio siguió los lineamientos del Reglamento del Comité Institucional de Ética en Investigación con Animales y Biodiversidad (2017), según Capítulo 2, Artículo 5, de la Universidad Científica del Sur.
Material Biológico
Se utilizaron alevines de O. niloticus (n = 500) con peso de 0.46 ± 0.09 g y longitud total de 31.9 ± 1.7 mm (media ± DE), procedentes del Centro de Investigación Piscícola de la Facultad de Pesquería de la Universidad Nacional Agraria La Molina (UNALM). Los alevinos fueron transportados al laboratorio de Biología Molecular de la Universidad Científica del Sur, Lima, Perú.
Los peces fueron aclimatados por 15 días a dos temperaturas (28 y 32 °C) en unidades experimentales de 45 L, con una biomasa total de 116.78 g y densidad de cultivo 1.46 g L-1. Como dieta se suministró Tilapia -40 (Aquatech) (proteína: 40%, grasa: 5%, fibra: 4%, ceniza: 12% y humedad: 12%), con una tasa de alimentación al 10%, y frecuencia alimentaria de cinco veces al día.
Cloruro de Mercurio (II) -HgCl 2
Se empleó cloruro de mercurio II (JT Baker(r), HgCl2, PM: 271.492 g mol-1), con una pureza del 99.5%, a partir del cual se preparó una solución inicial al disolver 1 g de HgCl2 en 1 L de agua destilada.
Ensayos de Toxicidad
Determinación de CL50 de HgCl2
Los alevines (n = 120) se distribuyeron en 20 acuarios de 2 L c/u a una densidad de 1.84 g L-1. Los individuos fueron expuestos a una concentración control (sin HgCl2) y diferentes concentraciones de HgCl2 (0.13,0.25, 0.38, 0.50 mg L-1) a temperaturas de 28 y 32 °C, con dos réplicas por tratamiento. Se evaluó la mortalidad a las 48, 72 y 96 h (Naranjo-Gómez et al., 2014).
Ensayo subletal de HgCl2
Se emplearon alevinos (n = 240) distribuidos aleatoriamente en 40 unidades experimentales con capacidad de 2 L c/u, a una densidad de 1.47 g L-1. Los especímenes fueron expuestos a una concentración control (sin HgCl2) y dos concentraciones de HgCl2 (0.04 y 0.07 mg L-1) con nueve réplicas establecidas a partir de la determinación de CL50-96h de HgCl2 y según las temperaturas de experimentación (28 y 32 °C) (Naranjo-Gómez et al., 2014).
El ensayo duró 30 días, tomándose muestras de sangre periférica cada 15 días para la evaluación de genotoxicidad, según lo indicado por Ayllon y García-Vazquez (2000). Asimismo, parámetros fisicoquímicos de calidad de agua con la temperatura (°C) se midieron diariamente y el oxígeno disuelto (mg L-1) y pH cada dos días (Cuadro 1).
Datos Biométricos
Los datos de peso (g) y longitud total (mm) se midieron utilizando una balanza digital (Ohaus Traveler TA 152, 0.01 g) y un vernier (Karson 150 mm, material ABS, margen de error ± 0.05 mm), considerando la metodología de Mariluz (2015).
Tasa de crecimiento absoluto (TCA) y específico (TCE)
La TCA es un coeficiente que evalúa el cambio de peso (g) y longitud total (mm) de un individuo o población por unidad de tiempo (Brown et al., 1988). La TCE mide el porcentaje de aumento de peso (g) y longitud total (mm) por día de los alevines evaluados (Hopkins, 1992) mediante las siguientes fórmulas:
TCA (g/día-1) = (Pf-Pi/N° días), donde Pf= Promedio final de peso (g) y Pi = Promedio inicial de peso (g).
TCA (mm día-1) = (Lf-Li/N° días), donde Lf = Promedio final de longitud total (mm) y Li = Promedio inicial de longitud total (mm).
TCA (% día-1) = (LN[Pf] -LN[Pi]/N'días) *100, donde LN(Pf) = Logaritmo natural del promedio final de peso (g) y LN(Pi) = Logaritmo natural del promedio inicial de peso (g).
TCE (% día-1) = (LN[Lf] -LN[Li]/N'días) *100, donde LN(Lf) = Logaritmo natural del promedio final de longitud total (mm) y LN(Li) = Logaritmo natural del promedio inicial de longitud total (mm).
Evaluación de Genotoxicidad
Los alevines de tilapia se sacrificaron mediante una sobredosis de metasulfonato de tricaína (MS 222) (Tamaru et al., 2001). Se extrajeron las muestras de sangre de la vena caudal, a través de un corte transversal en las colas. Se hicieron los frotis en láminas portaobjeto. Posteriormente, se procedió a evaluar la genotoxicidad mediante la estimación de anormalidades nucleares (AN) y micronúcleos (MN).
Para la identificación de AN se tomó en cuenta los criterios descritos por Carrasco et al. (1990), donde se determinaron las siguientes categorías: célula con núcleo con ampolla, presentando un pliegue en la membrana nuclear (abreviado como BL, del inglés blebbed); eritrocito binucleado, dado que tiene dos núcleos de similar tamaño (abreviado como BN, del inglés binoclei); célula con núcleo con muesca (abreviado como NT, del inglés notched); y eritrocito con núcleo lobulado (abreviado como LB, del inglés lobed).
Los MN fueron caracterizados según lo establecido por Grisolia (2002), donde el MN debe estar separado del núcleo de la célula y tener una coloración similar a este. Además, el MN debe encontrarse dentro del citoplasma celular y su tamaño debe ser menor a un tercio del núcleo principal.
Las observaciones se ejecutaron empleando un microscopio Nikon Eclipse E100 con un objetivo de 100x. El conteo de AN y MN se realizó por el método descrito por Al-Sabti y Metcalfe (1995), donde se descartaron los eritrocitos sobrepuestos o dañados. Se expresó en porcentaje (%), calculado a partir de la siguiente fórmula (Santamaría et al., 2012): MN o AN (%) = (N° células con MN o AN/2000) * 100.
Mortalidad (%)
Los datos de mortalidad se tomaron cada 15 días, estimándose a partir de la fórmula descrita por Tsang y Quintanilla (2008). Mortalidad (%) = (N° muertos/Total evaluados) * 100.
Análisis de Datos
La CL50 se determinó por el método Probit empleando el programa IBM SPSS Statistics v. 23. Los valores de peso (g), longitud total (mm), TCA, TCE,AN, MN y mortalidad (%) no cumplieron con los criterios de normalidad (Shapiro Wilk) y homogeneidad de varianza (Levene), por lo que se aplicó el método no paramétrico de Scheirer Ray Hare, seguido del análisis post-hoc Dunnett, empleando el programa Rstudio v. 3.4).
RESULTADOS
Determinación de CL 50
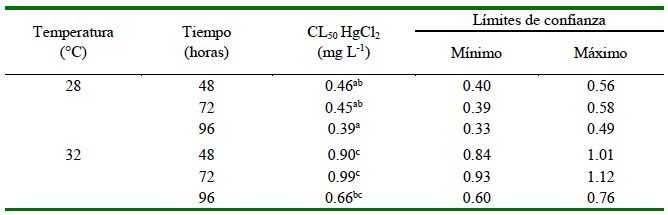
La CL50 para HgCl2 se incrementó con la temperatura (de 28 a 32 °C) a cada tiempo de evaluación (48, 72 h), pero disminuyeron a las 96 h para ambas temperaturas. No obstante, la CL50 obtenidos a 28 y 32 °C no presentaron diferencias significativas entre 48 y 72 h (p>0.05), pero hubo diferencias significativas entre temperaturas (p<0.05) (Cuadro 2).
Ensayo subletal de HgCl 2
Datos biométricos
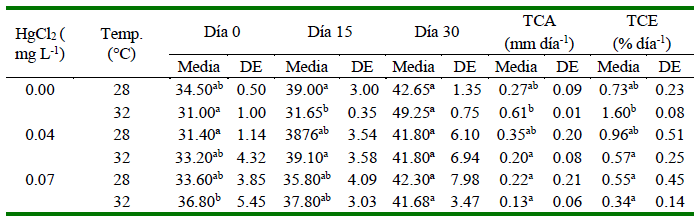
Los alevinos presentaron peso y longitud total similares entre tratamientos al inicio del experimento (p>0.05). Sin embargo, los peces en el día 15 que no fueron expuestos a HgCl2 a 32 °C y peces expuestos a 0.07 mg L-1 de HgCl2 a 28 ºC presentaron un menor crecimiento (peso y longitud total). Para el día 30, los ejemplares cultivados en ausencia de HgCl2 obtuvieron menor peso (1.08 ± 0.19 g) a 28 ºC, en comparación con los alevines sometidos a 32 ºC (1.84 ± 0.45 g). Por otro lado, los alevines mantenidos a 0.07 mg L-1 de HgCl2 y 32 ºC mostraron menores valores de peso y longitud total en comparación con el resto de los tratamientos en el día 30 (Cuadros 3 y 4).
Cuadro 3 Datos de peso (g), tasa de crecimiento absoluto (TCA) y tasa de crecimiento específico (TCE) para alevines de Oreochromis niloticus sometidos a dos temperaturas (28 y 32 °C) y tres concentraciones de HgCl2 (mg L-1)
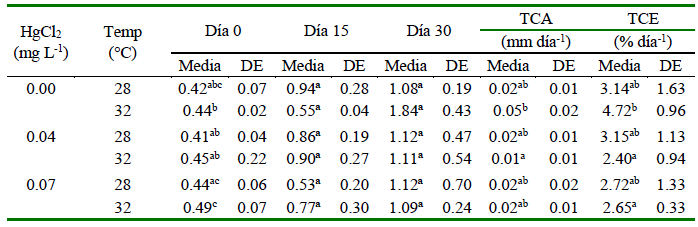
Valores con letras distintas dentro de columnas indican diferencias significativas (p<0.05)
Cuadro 4 Datos de longitud total (mm), tasa de crecimiento absoluto (TCA) y tasa de crecimiento específico (TCE) para alevines de Oreochromis niloticus sometidos a dos temperaturas (28 y 32 °C) y tres concentraciones de HgCl2 (mg L-1)
Valores con letras distintas dentro de columnas indican diferencias significativas (p<0.05)
Tasa de crecimiento absoluto (TCA) y específico (TCE)
Los resultados de TCA para peso indicaron que individuos sin exposición a HgCl2 y mantenidos a 32 ºC alcanzaron mayor crecimiento en comparación con ejemplares cultivados en presencia de 0.04 mg L-1 de HgCl2 a 32 ºC (p<0.05), y estos últimos también presentaron el menor TCA frente al resto de tratamientos. En el caso de TCA para longitud total se demostró que peces en ausencia de HgCl2 a 32 ºC mostraron mayor crecimiento (p<0.05) frente a los alevines de los tratamientos de 0.04 mg L-1 de HgCl2 y 32 ºC, y 0.07 mg L-1 de HgCl2 para 28 ºC y 32 ºC
Para TCE se determinó que los porcentajes de peso se incrementaron en tratamientos que no contenían HgCl2 para 32 ºC (p<0.05) en comparación con los alevines sometidos a 0.04 y 0.07 mg L-1 de HgCl2 a 32 ºC (Cuadro 3). Por otra parte, los valores más altos TCE para la longitud total se observaron en alevines cultivados sin HgCl2 a 32 ºC en comparación a los evaluados a 0.04 mg L-1 y 0.07 mg L-1 de HgCl2 a 32 °C (p<0.05) (Cuadro 4).
Análisis de AN y MN
En las muestras de sangre periférica de Oreochromis niloticus se observaron eritrocitos con núcleo central de forma elíptica y contornos definidos, que corresponden a células con morfología normal (Figura 1A). Además, se encontraron eritrocitos con AN (Figura 1B, C, D, E) y MN (Figura 1F).
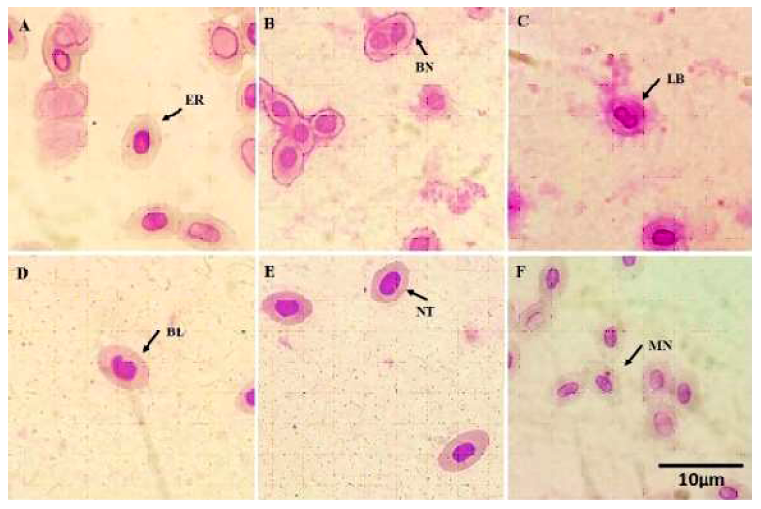
Figura 1 Eritrocitos de sangre periférica de O. niloticus A. Eritrocito con núcleo normal (ER), B. Binucleados (BN), C. núcleo lobulado o lobed (LB), D. núcleo con ampolla o blebbed (BL), E. núcleo con muesca o notched (NT) y F. micronúcleo (MN)
En la evaluación del día 0 a 28 °C se obtuvo mayor porcentaje de BN para organismos expuestos a 0.04 mg L-1 de HgCl2 (p<0.05); sin embargo, cuando la temperatura se incrementó a 32 ºC disminuyó la presencia de BN (p<0.05). No obstante, individuos que fueron sometidos a 0.07 mg L-1 de HgCl2 a 28 ºC mostraron un menor porcentaje de muestras con BN frente a los alevines mantenidos a una concentración similar de HgCl2 a 32 ºC (p<0.05). Eritrocitos con núcleo LB se observaron en peces cultivados sin HgCl2 a 28 ºC, pero no a 32 °C. Asimismo, se determinó una mayor presencia de eritrocitos con núcleo BL en los tratamientos a 32 ºC con concentraciones de 0.04 y 0.07 mg L-1 de HgCl2 (p<0.05). Además, se observó que la frecuencia de eritrocitos con núcleo NT aumentó a 32 °C, excepto en los grupos sin exposición a HgCl2, donde la presencia de células NT fue mayor a 28 °C (p<0.05) (Figura 2A).
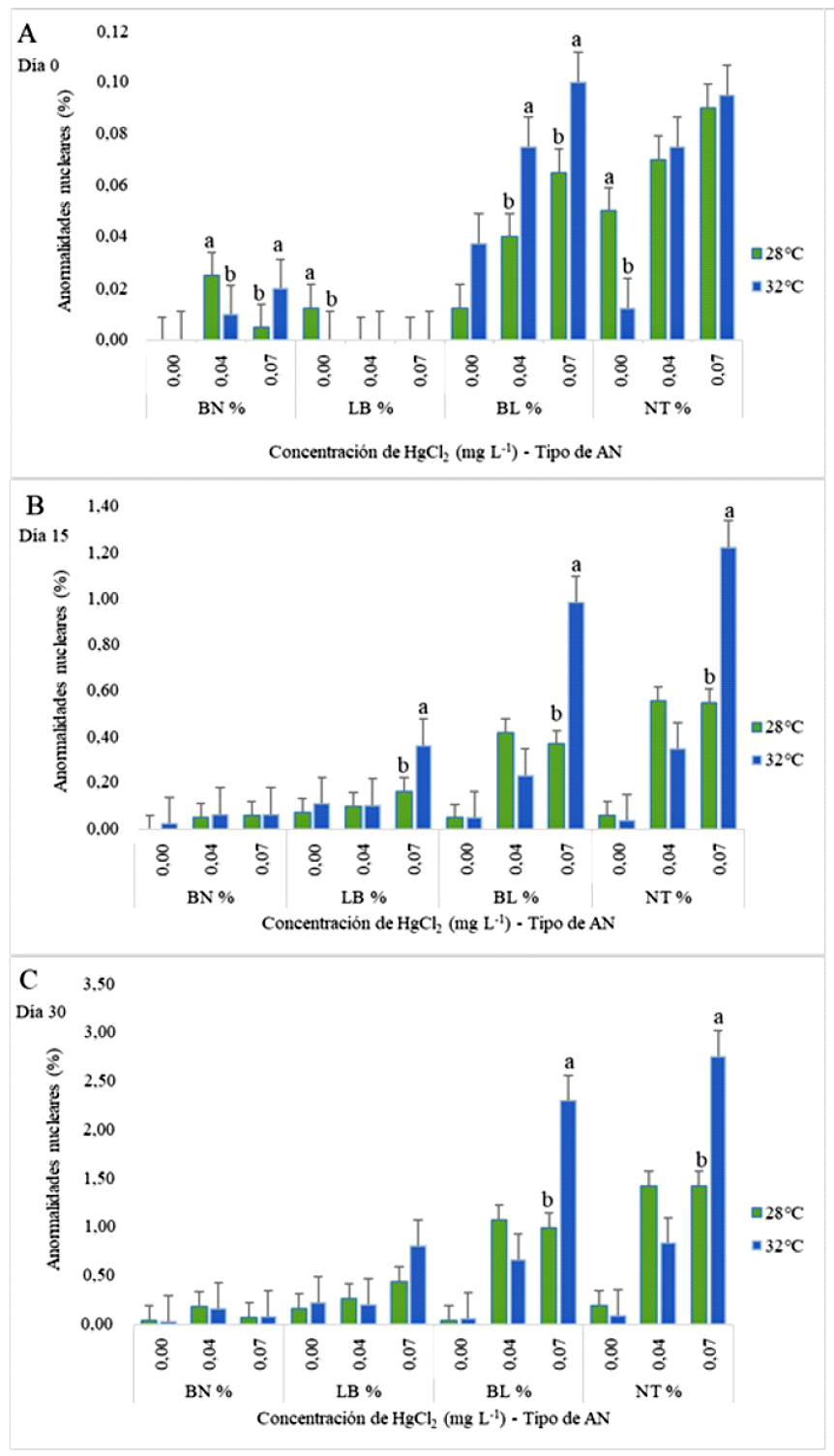
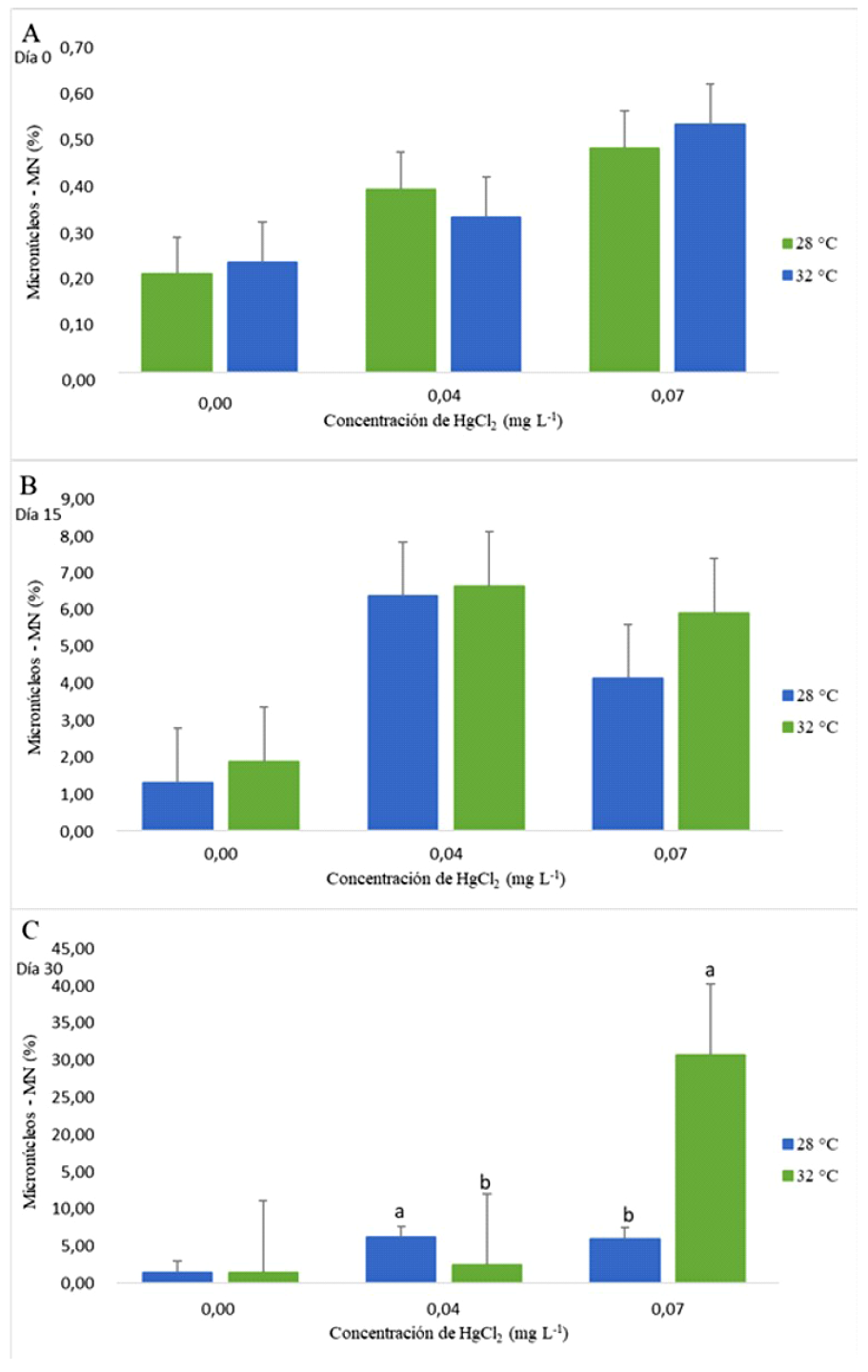
Figura 2 Células binucleadas (BN), Núcleos lobulados o lobed (LB), Núcleos con ampolla o blebbed (BL) y Núcleos con muesca o notched (NT) presentes en eritrocitos de alevines de Oreochromis niloticus expuestos a dos concentraciones de HgCL2 y temperaturas de 28 y 32 °C. A. Día 0, B. Día 15, C. Día 30. Se ilustran la media ± DE. Letras distintas indican diferencias significativas (p<0.05)
Respecto a los resultados del día 15, el porcentaje de eritrocitos BN incrementó a 32 °C para todas las concentraciones de HgCl2. Hubo mayor presencia de células con núcleo LB a 0.04 mg L-1 de HgCl2 y 0.07 mg L-1 de HgCl2 (p<0.05), ambos a 32 °C. La frecuencia de muestras con núcleo BL aumentó para el tratamiento expuesto a 0.04 mg L-1 de HgCl2 a 28 °C. No obstante, el grupo evaluado a 0.07 mg L-1 de HgCl2 y 32 °C presentó un elevado número de células con núcleos BL (p<0.05). Los eritrocitos con núcleo NT se incrementaron en el grupo de 0.04 mg L-1 de HgCl2 a 28 °C, mientras que los cultivados a 0.07 mg L-1 de HgCl2 lo hicieron a 32 °C (p<0.05) (Figura 2B).
Las observaciones de AN durante el día 30 mostraron un aumento en el porcentaje de muestras con eritrocitos BN en alevines expuestos a 0.04 mg L-1 de HgCl2 a 28 °C y 0.07 mg L-1 de HgCl2 a 32 °C. Asimismo, para células con núcleo LB se observó una mayor frecuencia en los individuos sometidos a 0.04 mg L-1 de HgCl2 y 28 °C en contraste con el grupo cultivado a 32 °C (p>0.05). Sin embargo, a una concentración de 0.07 mg L-1 de HgCl2 la presencia de estos eritrocitos se incrementó a 32 °C. Al analizar células con núcleos BL, se determinó un mayor porcentaje para alevines sometidos a 0.04 mg L-1 de HgCl2 a 28 °C y 0.07 mg L-1 de HgCl2 para 32 °C (p<0.05). Del mismo modo, la frecuencia de muestras con núcleos NT aumentó en alevines cultivados a 0.07 mg L-1 de HgCl2 a 32 °C (p<0.05) (Figura 2C).
En el caso de células con presencia de micronúcleos (MN), en el día 0 se observó una mayor frecuencia para los tratamientos de 0.04 mg L-1 de HgCl2 a 28 °C y 0.07 mg L-1 de HgCl2 a 32 °C. Asimismo, para el día 15, todos los tratamientos aumentaron el número de MN en los individuos mantenidos a 32 °C. Finalmente, la frecuencia de eritrocitos con MN a 0.07 mg L-1 de HgCl2 a 32 °C superó el porcentaje en comparación a los individuos cultivados a 28 °C para el día 30 (p<0.05) (Figura 3).
Mortalidad (%)
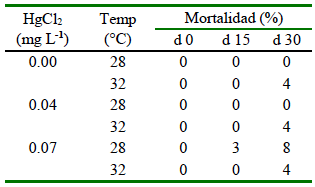
Los resultados de mortalidad (%) corresponden a cada día de evaluación. En el día 15 se observó la mayor mortalidad (3%) en organismos expuestos a 0.07 mg L-1 de HgCl2 y 28 °C, mientras que la sobrevivencia fue del 100% en los demás tratamientos. Sin embargo, para el día 30, se presentaron casos de mortalidad para alevines de tilapia cultivados a 32 °C (4%), seguido de peces expuestos a 0.04 mg L-1 de HgCl2 y 32 °C (4%), y ejemplares mantenidos a 0.07 mg L-1 de HgCl2 para 28 °C (8%) y 32 °C (4%) (Cuadro 5).
DISCUSIÓN
Los resultados descritos evidenciaron que a una mayor temperatura los organismos soportan mayor concentración de HgCl2 hasta llegar a una mortalidad de la mitad de los alevines (CL50). Resultados similares fueron demostrados por Ishikawa et al. (2007) en O. niloticus sometidos a HgCl2 a 24.4 °C, donde los datos de CL50 fueron 0.37, 0.28 y 0.22 mg L-1 de HgCl2 correspondientes a las 48, 72 y 96 horas. Asimismo, en el trabajo de Jasim et al. (2016) se encontró que en alevines O. niloticus sometidos a 26.8 °C, la CL50im para las 48, 72 y 96 horas fue 0.75, 0.54 y 0.30 mg L-1 de HgCl2, respectivamente. Los resultados de ambos trabajos demostraron que el aumento de la temperatura tiende a generar valores más altos de CL50 para HgCl2 y a su vez disminuye a medida que transcurre el tiempo de exposición.
Respecto a la TCA y TCE, la temperatura influencia el crecimiento de O. niloticus. En este sentido, Azaza et al. (2008), El-Sherif y El-Feky (2009), Pandit y Nakaura (2010) y Workagegn (2012) demostraron que el crecimiento de O. niloticus, en condiciones adecuadas, aumenta a medida que la temperatura llega a 32 °C y disminuye al exceder esta temperatura. Además, estudios realizados por Vallee y Ulmer (1972), Muñoz-Escobar y Palacio-Baena (2010), encontraron que el crecimiento se veía afectado para organismos sometidos a Hg, debido al elevado costo metabólico requerido por la depuración y detoxificación celular, realizados por el retículo endoplasmático liso de los hepatocitos. Ante esta evidencia y los resultados de este trabajo, se evidencia que la exposición al HgCl2ylainteracciónconla temperatura tiene un impacto negativo sobre el crecimiento de los alevines.
En relación con los valores obtenidos en la evaluación de genotoxicidad se observó la inducción espontánea de AN y MN, que según Prieto et al. (2008) es debido a las lesiones generadas en el ADN en las células de interfase-S. Esto ha sido observado en Astyanax bimaculatus (BN: 0.015%, BL: 0.05% y LB: 0.03%) (Santamaría et al., 2012), C. macropomum (MN: 2.4%) (Rocha et al., 2011), Salmo trutta (MN: 0.6%), Anguilla anguilla (MN: 0.2%), Phoxinus phoxinus (MN: 0.38%) (Rodríguez-Cea et al., 2003) y A. bimaculatus (MN: 0.31%) (Matsumoto y Colus, 2000). El aumento de la concentración de HgCl2 ocasionó daños en las células de O. niloticus, similar a los resultados de Nirchio et al. (2019), quienes demostraron que la frecuencia de células con núcleo NT fue mayor a la concentración más alta de HgCl2, presentando 3.84% y 7.71%, correspondiente a 0 y 0.25 mg g-1 en Andinoacara rivulatus. Esto se debe a que los compuestos de Hg causan un colapso general en los mecanismos antioxidantes de la célula al unirse a los grupos sulfhidrilo del glutatión, bloqueando su función como eliminador de radicales libres, dejándolos disponibles para causar daño en el ADN (Rodrigues et al., 2017).
Un estudio realizado por Thier et al. (2003) demostró que una de las características del HgCl2 es provocar un efecto adverso sobre la tubulina, subunidad estructural de los microtúbulos, cuya función es la organización del citoplasma, además de ser un componente de las fibras del huso. De esta forma, el HgCl2 altera la polimerización de la tubulina, ocasionando la contracción de los cromosomas metafásicos, un retraso en la división del centrómero y un movimiento anafásico más lento.
Por otro lado, el incremento de la temperatura influyó en la aparición de AN y MN en los organismos evaluados. Çavaº y Ergene-Gözükara (2005), en Mugil cephalus registraron durante los meses de verano (28 °C) un mayor número de células con MN (7.05‰), eritrocitos con núcleos LB (0.84‰) y NT (1.70‰) en comparación con las demás estaciones. Sin embargo, la mayor frecuencia de eritrocitos con núcleos BN y BL fue en primavera (22 °C) y otoño (20 °C), en contraste con los meses de invierno (14 °C), indicando que los organismos sufren mayor daño en el ADN con la aparición de AN y MN al afrontar un aumento de temperatura. La temperatura óptima para O. niloticus se encuentra entre 28 y 31 °C, de modo que, al exceder esta temperatura el organismo requiere mayor energía y, por ende, consume más oxígeno (Tsang y Quintanilla, 2008). Asimismo, se ha comprobado que los cambios en la temperatura alteran los componentes lipídicos de las células sanguíneas, además de modificar la fluidez de la membrana, el entorno de proteínas y las interacciones proteína-lípido de los eritrocitos en animales poiquilotermos (Dey et al., 1993; Avrova, 1999).
Además, se pudo evidenciar que la temperatura produjo un aumento del efecto genotóxico de HgCl2, semejante a lo descrito por Guilherme et al. (2008) que evaluaron AN en Liza aurata cultivada con Hg, quiénes encontraron que en el verano (23-27.7 °C) y otoño (18.5-20.2 °C), las células con núcleos se incrementaron frente a los meses de invierno y primavera. Asimismo, Waheed et al. (2020) mencionaron que el incremento de la temperatura en un medio acuático genera un mecanismo acelerado en las branquias, de este modo, los contaminantes o sustancias químicas tóxicas disueltas (Hg) ingresan con facilidad al tejido del pez. La toxicidad de los metales en los organismos aumenta en proporción al incremento de la temperatura, al acelerar el mecanismo toxicológico (Cairns et al., 1975; Heugens et al., 2001; Khan et al., 2006).
Finalmente, se observó que la tasa de mortalidad se incrementa a medida que aumenta la concentración del HgCl2 al que fueron sometidos los organismos evaluados. Esto podría atribuirse al efecto inmunosupresor del Hg en O. niloticus, lo que genera respuestas como leucocitosis, neutrofilia y linfopenia (El-Boshy y Taha, 2011). De igual manera, Amend et al. (1969) observaron que la mortalidad tenía relación con la necrosis y separación epitelial de las branquias. Similar a lo expresado por Muñoz-Escobar y Palacio-Baena (2010), quienes demostraron que, la mortandad de las larvas aumentaba según la concentración, como se dio en ejemplares Dendrosophus bogerti, las cuales alcanzaron un total de 5% al estar cultivados a 0.08 mg L-1 de HgCl2, a 20 °C.
CONCLUSIONES
El incremento de temperatura provocó una variación en la concentración letal media de cloruro de mercurio (HgCl2), donde los resultados de CL50 para HgCl2 obtenidos para 28 °C fueron menores a los valores de CL50 a 32 °C.
El aumento de la temperatura generó un incremento en la genotoxicidad del HgCl2 en los eritrocitos de Oreochromis niloticus, produciendo mayor frecuencia de anormalidades nucleares (AN) y micronúcleos (MN).












 uBio
uBio