INTRODUCCIÓN
La paratuberculosis bovina es una enfermedad infecciosa crónica granulomatosa que afecta el intestino delgado de los bovinos y otros rumiantes, también conocida como la enfermedad de Johne (McAloon et al., 2019). La enfermedad es causada por Mycobacterium avium subsp. paratuberculosis (MAP), bacteria Gram positiva intracelular dependiente de micobactina y, por lo tanto, incapaz de realizar una replicación en el ambiente (McAloon et al., 2019). La enfermedad se presenta con pérdida de peso, disminución en la producción de leche, diarrea crónica y edema; sin embargo, los signos clínicos pueden aparecer hasta dos años después de la infección inicial (Yoo y Shin, 2012). La ruta de transmisión más común es vía oro-fecal a través de la ingestión de alimento, ya sea pasto o leche contaminados con materia fecal. Los animales adultos infectados son los mayores diseminadores del patógeno, en tanto que los recién nacidos son los más susceptibles (Eisenberg et al., 2012). Además, se reporta la transmisión transparentaría al término de la gestación, a través del semen y por embriones contaminados (Buergelt y Williams, 2004; Bielanski et al., 2006).
La paratuberculosis es una enfermedad endémica y la WOAH declara la enfermedad de notificación obligatoria; sin embargo, no es una enfermedad prioritaria en los programas oficiales de control y prevención en muchos países (Whittington et al., 2019). La enfermedad presenta diversos desafíos para los programas de prevención y control debido a que no existe tratamiento (Beaunée et al., 2017) y es de difícil diagnóstico debido a las formas de presentación clínica, periodos prologados de incubación, presentación silenciosa y número de microorganismos por debajo del umbral de detección (Manning y Collins, 2001). Los animales en la fase subclínica no presentan signos de la enfermedad, pero pueden tener niveles detectables de anticuerpos; sin embargo, las técnicas diagnósticas son más sensibles en estados clínicos o finales de la enfermedad (Nielsen y Toft, 2008). Para erradicar la enfermedad se debe sacrificar a todos los animales infectados, lo cual implica un gran costo para el ganadero si es que no existen incentivos (Manning y Collins, 2001; Yoo y Shin, 2012). No se le considera una zoonosis, pero se debe tener en cuenta que se ha detectado el MAP en pacientes con la enfermedad de Crohn, presentando signos similares a la enfermedad de Johne (Sechi y Dow, 2015).
La enfermedad causa grandes pérdidas económicas debido a la disminución de la producción de leche, de la ganancia de peso y de bajos precios en el matadero (Garcia y Shalloo, 2015). Se estiman pérdidas económicas anuales en hatos infectados con MAP del 1% de los ingresos brutos por leche, equivalente a US$ 33 por vaca, calculándose pérdidas de anuales de US$ 198 millones en Estados Unidos de América, US$ 75 millones en Alemania y US$ 56 millones en Francia (Rasmussen et al., 2021). En Latinoamérica y el Caribe se le ha reportado por casi 100 años, pero aún no existen programas adecuados para el control y prevención de la enfermedad (Espeschit et al., 2017). En Colombia se ha reportado la presencia a de la enfermedad; sin embargo, no se cuentan con estudios suficientes para la comprensión de la enfermedad, comportamiento y factores de riesgo, de allí que el objetivo de este estudio fue determinar la seroprevalencia de MAP basada en ELISA e identificar los factores asociados a su presentación.
MATERIALES Y MÉTODOS
Ubicación del Estudio
Se realizó un estudio epidemiológico de tipo trasversal en el municipio deVillavicencio, en Meta, Colombia, considerada la zona ganadera del país, el cual cuenta con una población de 108 019 cabezas según censo del Instituto Colombiano Agropecuario (ICA, 2016). El municipio tiene una altitud media de 380 msnm, temperatura 27 °C, humedad relativa 80%, precipitación pluvial entre 3500 y 4000 mm anuales.
Población y Tamaño de Muestra
El tamaño de la muestra se determinó siguiendo los postulados de Dohoo et al. (2003), con una seroprevalencia hipotética del 21% (Caraballo-Blanco et al., 2018), 95% de confianza y efecto de diseño de 4, población de 108 019 con la siguiente fórmula: n = (1-[1-NC]1/d) (N-[d-1]/2), donde n: tamaño de la muestra requerido, N: tamaño de la población, d: número de individuos enfermos esperados en la población, NC: nivel de confianza expresado como proporción (=1-α).
Se estimó una muestra total de 1018 bovinos. La muestra fue recolectada en 2016, realizándose un muestreo aleatorio estratificado en 24 fincas de sistema de doble propósito pertenecientes a cinco veredas del municipio, las cuales son subdivisiones territoriales de la zona rural en los municipios.
Muestras
Las muestras de sangre (5.0 ml) se tomaron de la vena coccígea y se depositaron en tubos estériles sin anticoagulantes (Vacutainer(r)). Se guardaron en bodegas isotérmicas y trasportadas al Laboratorio de Reproducción y Genética Animal de la Universidad de los Llanos, Villavicencio. Las muestras fueron centrifugadas a 5000 x g por 10 min y los sueros resultantes se almacenaron a -70 °C hasta su análisis.
Prueba de ELISA
Del total de muestras colectadas, 1000 fueron viables para análisis. Se realizó la prueba de ELISA indirecta utilizando el kit de diagnóstico comercial Parachek(r)2 (PrionicsAG) para la detección de anticuerpos específicos frente a Mycobacterium avium subsp. paratuberculosis en muestras de suero, siguiendo las directrices del fabricante. La lectura se hizo mediante espectrometría considerando una densidad óptica de 450 nm y un punto de corte de 0.350. Muestras con porcentajes e"70% se consideraron positivos para la presencia de anticuerpos contra MAP.
Estadísticas y Análisis de Riesgo
La seroprevalencia se determinó dividiendo el número de animales seropositivos con animales muestreados, con 95 % de intervalo de confianza (IC), utilizando el software Epiinfo(tm) v. 7. Para el análisis de riesgo se llevó a cabo una encuesta presencial por finca, donde se recolectó la información de variables sobre poblaciones y especies de animales domésticos, actividades productivas, asistencia técnica, saneamiento, infraestructura y eventos de salud que fueron categorizados como presencia y ausencia (variables dicotómicas). La encuesta se realizó en coordinación con las autoridades colombianas del ICA. El análisis univariable se realizó mediante la prueba Chi-cuadrado de Pearson para determinar la relación entre la presencia de paratuberculosis y las variables en estudio, donde aquellas con p<0.05 se incluyeron en el modelo de regresión logística multivariable. Se consideraron las variables sexo (macho, hembra,), edad (<1, 1-2, 3-4, >4 años), venta de animales (no, sí), grupo racial (Holstein, Gyr, Pardo Suizo, cebú, criollo, Girolando, Angus), presencia de animales (porcinos, caninos y aves). Los análisis estadísticos se realizaron utilizando el software SPSS v. 20 (SPSS, USA).
Ética
El estudio se realizó bajo la normatividad del Código de Ética para Medicina Veterinaria de Colombia, regidas por Ley N.° 576 de 2000 y la Ley N.° 84 de 1989 de la República de Colombia. El protocolo del estudio fue aprobado por el Comité de Ética de la Universidad de Ciencias Aplicadas y Ambientales (UDCA) N.1-2019. En los predios se obtuvo el consentimiento informado por parte de los propietarios.
RESULTADOS
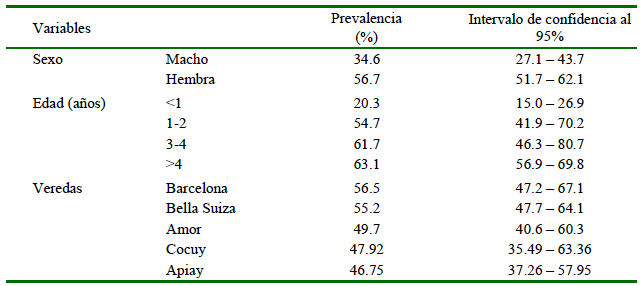
La seroprevalencia general de Mycobacterium avium subs. paratuber-culosis fue 52.4% (95% CI: 48.0-57.0%) y de 100% para los hatos. La seroprevalencia por sexo, grupo etario y ubicación de los hatos se presenta en el Cuadro 1.
Cuadro 1 Seroprevalencia de Mycobacterium avium subs. Paratuberculosis en vacas de hatos de doble propósito en el Municipio de Villavicencia, Meta, Colombia (2016)
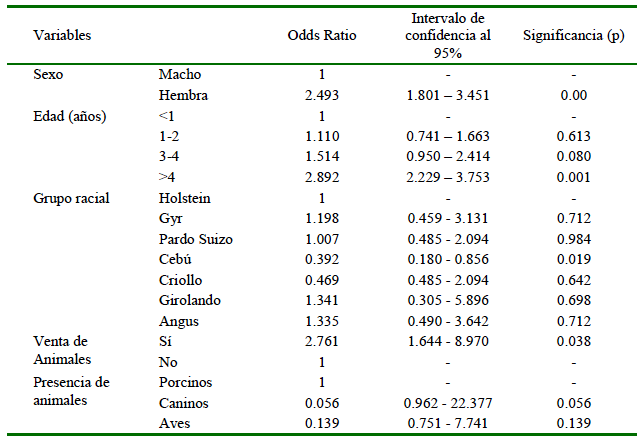
Con base en los resultados obtenidos en el análisis se identificaron como factores de riesgo al sexo hembra con un OR=2.493 más riesgo de infectarse en comparación con el estrato basal (macho), animales mayores de 4 años OR =2.892 (menores de 1 año), venta de animales OR=2.761 (no venta de animales) (Cuadro 2). El análisis de las razas mostró como factor de protección al Cebú con OR=0.392. El estudio de la presencia de otras especies como factor de riesgo en los hatos no fue estadísticamente significativo.
DISCUSIÓN
Es el primer estudio de seroprevalencia de Mycobacterium avium subsp. paratuberculosis en los llanos orientales de Colombia, con una prevalencia a nivel animal de 52.4%, y a nivel hato de 100%. Los resultados coinciden con los hallazgos encontrados por Whittington et al. (2019), en su estudio con 27 países, donde 48.2% de los países presentaron una prevalencia mayor de 40%. En Europa se observan diferencias notables en prevalencia, así en Inglaterra se analizaron 15 737 muestras mediante ELISA encontrando una seroprevalencia de 7.1% (Woodbine et al., 2009), mientras que, en Galicia, España, en 93 rebaños se encontró una seroprevalencia de 40.5% (Villamil et al., 2020). No obstante, en Colorado, Estados Unidos, se reportó 4.12% en vacas y la prevalencia por hato estuvo entre el rango de 0 a 7.82% (Hirst et al., 2004). En América Latina la paratuberculosis es endémica, habiéndose realizado estudios en Brasil, Argentina y Chile mediante diferentes pruebas diagnósticas lo que dificulta la comparación (Espeschit et al., 2017); sin embargo, Fernández-Silva et al. (2014) estimaron una prevalencia general de 16.9% a nivel animal y de 75.8% a nivel de hato en la región.
En Colombia se reportan altas tasas de prevalencia. En Nariño 94% de las fincas fueron positivas a paratuberculosis bovina con pruebas de ELISA (Benavides et al., 2016), en Antioquia se encontró una prevalencia de 33.8% en 105 animales de orientación cárnica (Vélez et al., 2016). Asimismo, en la región Caribe, Sucre, se reportó 21.1% de positividad en las muestras de heces con la técnica de tinción Ziehl Neelsen y de 11.5% con PCR (Caraballo-Blanco et al., 2018) mostrando diferencias entre técnicas diagnósticas; en tanto que en la sabana de Boyacá se encontró una seroprevalencia del 10.9% (Bulla-Castañeda et al., 2020). Los resultados encontrados indican que la enfermedad se encuentra extendida en el país y, por tanto, se requiere instaurar programas oficiales para el control y prevención de la enfermedad a fin de controlar la diseminación de la enfermedad, programas que pueden integrar estrategias como pruebas diagnósticas, control en la comercialización, vacunación, sacrificio temprano, manejo de terneros, mejora de la higiene y medidas de bioseguridad.
La implementación del diagnóstico puede ser difícil debido a la complejidad inmunológica y al prolongado periodo subclínico de la enfermedad. El diagnostico mediante ELISA es una prueba de tamizaje que identifica niveles de anticuerpos en las etapas finales de la enfermedad, por tanto, es difícil determinar la presencia de la enfermedad con un solo diagnóstico de referencia. El uso de técnicas diagnósticas en los programas de control debe considerar las limitaciones de cada prueba, determinar el uso de más de una prueba repetidas en el tiempo en el mismo animal para establecer el estadio de la enfermedad tanto en el animal como en el rebaño (Gilardoni et al., 2012). Nuevos avances podrían ser considerados en la construcción de programas de control, como los estudios de modelos multiescala de rutas de comercio, evaluación de medidas de control y estudios genéticos (Ruiz-Larrañaga et al., 2010; Beaunée et al., 2017).
La edad también fue un factor relevante en el estudio. Se identificó una mayor prevalencia en animales mayores de 4 años en comparación con los menores de 1 año, concordando con otros estudios en Dinamarca (Nielsen y Ersboll, 2006), Brasil (Vilar et al., 2015) Egipto (Selim et al., 2019) y Colombia (Bulla-Castañeda et al., 2020). Sin embargo, animales jóvenes son más susceptibles, habiéndose identificado que el acceso de animales jóvenes a pastos contaminados con estiércol adulto es un factor de riesgo (Villamil et al., 2020). Es importante considerar que la enfermedad presenta largos periodos de incubación y que los niveles de anticuerpos de MAP se identifican principalmente al final de periodo de incubación (McAloon et al., 2019), de allí la dificultad de identificar la enfermedad en edades tempranas.
No se observó una raza en particular como factor de riesgo de la enfermedad. Por otro lado, el cebú fue factor de protección. Diversos estudios han identificado la influencia de la raza; así en Nariño se identificó una menor seroprevalencia paratuberculosis (6.7%) en animales Holstein frente al ganado cruzado (12.2%) (Benavides et al., 2016). En este sentido, Bulla-Castañeda et al. (2020) en Boyacá, Colombia, evaluaron animales de las razas Jersey, Holstein, Ayrshire y Normando, determinando una mayor tasa de prevalencia en el Jersey, en tanto que Doria et al. (2020) en Córdoba encontraron 3.8% de seroprevalencia en el ganado Costeño con Cuernos en comparación con el 0.74% en el Romosinuano. También se ha demostrado que algunas razas Bos indicus presentan una predisposición genética a la infección al contar con genes que interfieren en la transducción de señales inmunológicas de las células huéspedes (Fecteau, 2018). Se han realizado estudios que analizan el papel de los genes en la respuesta inmune innata y la variación genética en los procesos infecciosos. buscando identificar variantes alélicas de los genes responsables de la resistencia o la susceptibilidad. Se han identificado polimorfismos en genes como SLC11A1, NOD2, SP110, TLR2, SP110, CLEC7A, CD209 y TLR4 (Ruiz-Larrañaga et al., 2010). Por lo tanto, la selección genética de animales resistentes puede ser una de las estrategias promisorias en el control de la paratuberculosis.
El estudio identificó una mayor presencia de la enfermedad en las hembras. Doria et al. (2006) en su estudio en Córdoba (Colombia) determinó que las hembras fueron 4.3 veces más afectadas que los machos, atribuyendo el resultado a una mayor predisposición a alteraciones inmunológicas y al estrés ocasionado durante el parto y la lactancia. Las prácticas de ordeño, asimismo, pueden ser un factor influyente en la transmisión de enfermedad, pues se han identificado MAP en ubre, ganglios linfáticos mamarios y muestras de leche de hembras positivas de la paratuberculosis (Eisenberg et al., 2012; Khol et al., 2017). Los resultados del estudio muestran una asociación con el ordeño mecánico, lo cual puede estar asociado a la falta de limpieza y desinfección de los equipos y ubres. La inseminación artificial se identificó como factor de riesgo, habiendo reportes de la presencia del patógeno en semen (Bielanski et al., 2006); sin embargo, se requieren más estudios para conocer la participación de MAP en reproducción animal.
Un factor relevante fue la asociación de la enfermedad con la venta de animales. La paratuberculosis es una enfermedad introducida por el comercio. En Colorado, Estados Unidos, se identificó que los rebaños que habían importado >8% de su rebaño durante los 5 años anteriores fueron 3.28 veces más propensas a ser seropositivas a MAP, así mismo, los hatos que contaban con más del 25% de las vacas nacidas en otras lecherías fueron 2.1 veces más probabilidades de ser positivas (Hirst et al., 2004). En Irlanda se encontró un incremento de los niveles de seropositividad posterior al comercio internacional de ganado (Barrett et al., 2011). En lo referente a las exposiciones ganaderas, la transmisión puede ocurrir un mayor contacto con otros animales, personas, equipos y vehículos (Villamil et al., 2020).












 uBio
uBio