INTRODUCCIÓN
La dirofilariosis, también conocida como "enfermedad del gusano del corazón", "verminosis cardiaca" o "heartworm disease", es causada por el nematodo Dirofilaria immitis. Es transmitida por la picadura de mosquitos culícidos del género Culex, Aedes, Anopheles, Culiseta y Coquillettidia (Cazaux et al., 2019), afectando principalmente a perros, pero además ha sido reportada en cánidos silvestres, gatos, hurones y humanos (Slocombe et al., 1995; Terrell, 1998; Darsie y Ward, 2005). Tiene distribución mundial; sin embargo, se presenta con mayor prevalencia en zonas tropicales y subtropicales por las condiciones ambientales que favorecen el desarrollo de las poblaciones de mosquitos (Cazaux et al., 2019).
El ciclo de vida de D. immitis es de 7 a 9 meses. Los perros domésticos y algunos cánidos silvestres son los huéspedes definitivos, siendo el principal reservorio de la infección. Los gatos, hurones e inclusive el humano tienen bajas cargas parasitarias, por lo que sirven como una fuente limitada de infección durante periodos cortos (McCall et al., 2008). El mosquito se infecta cuando se alimenta de un huésped microfilarémico en su fase infectiva L3 (Kartman, 1953; Slocombe et al., 1989). La L3 en el huésped muda a L4 donde migra a las arterias pulmonares. Las hembras al llegar a la madurez sexual producen microfilarias. Las principales arterias afectadas son las lobulares y la arteria pulmonar, pudiendo incluso ubicarse en el ventrículo derecho (Rawlings, 1986).
La American Heartworm Society (AHS, 2019) señala los puntos claves para la interpretación de las pruebas diagnósticas de la enfermedad. Las pruebas serológicas de antígeno son altamente sensibles y detectan únicamente glicoproteínas del tracto reproductivo de las hembras adultas, por lo que su utilidad en microfilaremias es nula. No hay pruebas serológicas capaces de detectar infecciones compuestas por machos adultos. Las pruebas para detección de microfilarias son la gota gruesa, método modificado de Knott, visualización del "buffy coat" y frotis sanguíneo. En algunos casos se requiere confirmar los resultados positivos de las pruebas con ultrasonografía de la arteria pulmonar o radiografía torácica. Con la ecografía es posible observar la pared del cuerpo de los parásitos del corazón ya que son altamente ecogénicos y producen una imagen de "líneas paralelas" o "signos iguales" distintiva. La ecografía también permite la evaluación anatómica y funcional del corazón identificando las consecuencias de la enfermedad (Venco et al., 2001)
En el presente reporte se describe el caso clínico de un canino con diagnóstico de dirofilariosis. La importancia de reportar este caso es la implicancia epidemiológica de la enfermedad en el contexto zoonótico, siendo Guatemala un país tropical con altas poblaciones de mosquitos. Por esta razón, un examen clínico minucioso, el abordaje integrado del paciente y el razonamiento de las pruebas diagnósticas son la clave del diagnóstico, ya que en algunos pacientes se pueden obtener resultados serológicos no concluyentes. Sin embargo, la sintomatología clínica del paciente, el área geográfica donde se encontraba y la inclusión de los protocolos de ecografía como una herramienta en el examen clínico fueron la clave para el diagnóstico.
CASO CLÍNICO
Reseña, anamnesis y hallazgos clínicos
Se presenta al Hospital Veterinario de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad de San Carlos de Guatemala, un paciente canino, macho, sin raza definida, de 6 años de edad, 21 kg de peso, condición corporal 5/9, con vacunas y desparasitaciones al día. El motivo de consulta fue tos esporádica que incrementa durante el ejercicio. Al examen clínico, los parámetros fisiológicos se encuentran dentro de los límites de referencia, a excepción del reflejo tusígeno que mostraba una respuesta incrementada.
Ayudas diagnósticas
El cuadro hemático presentó una anemia normocítica-normocrómica (eritrocitos 5.50 mill/mm3; hematocrito 34%, hemoglobina 11.3 g/dl, VCM 61.82 µl y CHCM 33.32%), sin alteraciones en leucograma. Se realizó un frotis sanguíneo donde no se observaron parásitos intra y extracelulares. Se realizó la prueba de gota gruesa y el método modificado de Knott con resultados negativos para el diagnóstico de microfilaremias.
La medición de creatinina plasmática estuvo dentro de los valores de referencia normales. Los sólidos plasmáticos totales mostraron hiperproteinemia (11 g/dl). En el análisis completo de orina solo se observó una baja densidad (1.013). Finalmente, se realizó la prueba de inmunoensayo cromatográfico (Anigen(r)) para antígeno de D. immitis siendo negativo, al igual que para anticuerpos de Ehrlichia canis, Borrelia burgdorferi, Anaplasma platys y Anaplasma phagocytophilum.
Se realizó el protocolo Vet blue (Lisciandro, 2021) para evaluar el parénquima pulmonar, observándose la presencia de líneas B en cantidad de 2 a 3 en cada una de las 4 ventanas (lóbulo pulmonar caudal, perihiliar, medio y craneal) de ambos hemitórax (Figura 1), siendo normal encontrar <3 por espacio intercostal.
El ecocardiograma (ECG) se realizó con un equipo Chison Eco 1(r), utilizando un transductor de 6.5 MHz, en modos B y M. Se observó un pericardio normal, la fracción de acortamiento fue del 35% y la fracción de eyección del 65.77% calculadas por el método Teicholz (Boon, 2022). Los valores estuvieron dentro de los límites de referencia, a excepción del septo interventricular en sístole y diástole, encontrándose por debajo del rango de referencia.
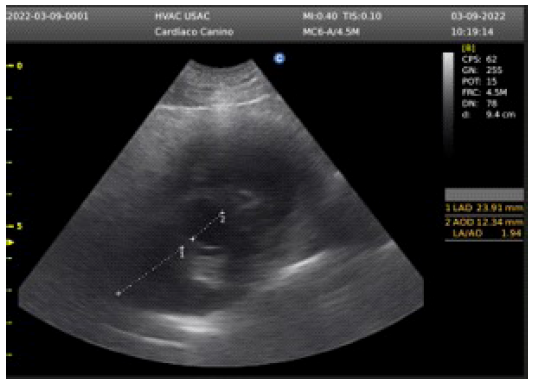
En la evaluación del eje corto paraesternal derecho, se encontró una relación atrio: aorta de 1.94, siendo el valor normal menor a 1.6 (Figura 1). El EPSS (E point septal separation) fue de 5 mm, siendo el valor normal menor a 7 mm. Se observó incremento del grosor del tracto de salida del ventrículo derecho, con presencia de estructuras hiperecoicas compatibles con la presencia de filarias (Figura 2). La relación aorta: tronco pulmonar fue normal. El índice de distensibilidad de la rama derecha de la arteria pulmonar fue de 16%, siendo el valor normal mayor a 30%.
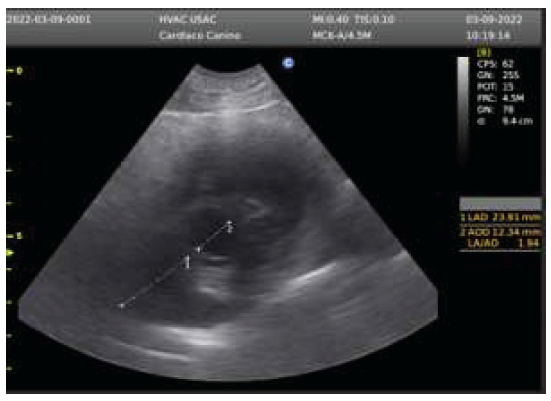
Figura 2 Paciente canino macho de 6 años. Ventrículo derecho con presencia de estructuras hiperecoicas compatibles con filarias
En el ecocardiograma fue posible observar a nivel del ventrículo derecho, cerca de la tricúspide, la imagen que sugiere un gusano (Figura 3a). Se observa también una estructura con ecogenicidad heterogénea, situada cerca de la aorta y ventrículo derecho, en la cual es posible observar varias imágenes de "signos iguales" (Figura 3b).
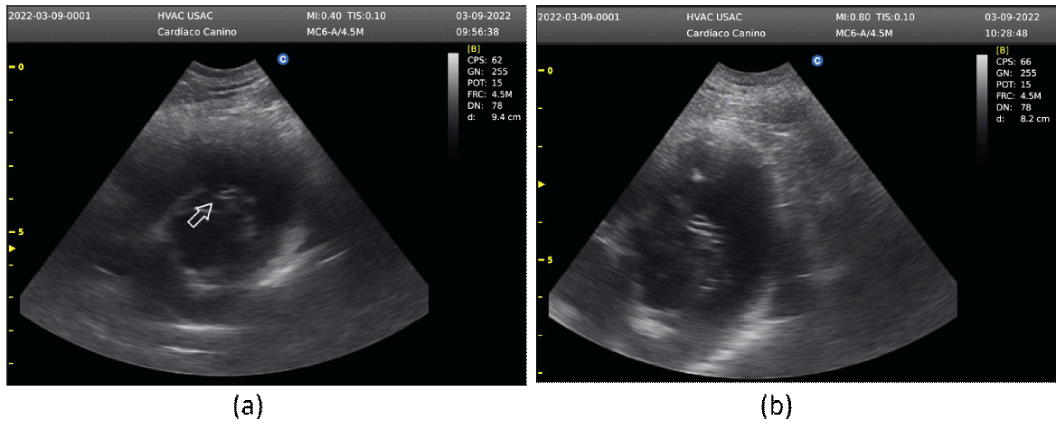
Figura 3 Paciente canino macho de 6 años. Ecocardiograma Modo B. (a) Presencia de filaria a nivel del tracto de salida del ventrículo derecho con proximidad a la válvula tricúspide. (b) Presencia de filarias con aspecto de "signos iguales" en el ventrículo derecho y cerca de la arteria aorta
Tratamiento
Se administró omeprazol 1 mg/kg bid y doxiciclina 5 mg/kg bid, ambos por un mes; este último con la finalidad de eliminar la Wolbachia (bacteria simbionte de las filarias) y reducir la población parasitaria. Para la hipertensión arterial pulmonar se suscribió sildenafil 1 mg/kg bid por tiempo indefinido. Finalmente, para el control de signos de tromboembolismo pulmonar se prescribió prednisona 0.5 mg/kg bid por una semana, seguido de la misma dosis por una semana y finalmente, la misma dosis cada 48 horas por dos semanas. Se complementa el tratamiento para control de vectores y helmenticida con lactonas macrocíclicas administrando selamectina una vez al mes.
Seguimiento
Se realizó otra evaluación del paciente a los cuatro meses de instaurado el tratamiento. En esta ocasión se utilizó el equipo Chison QBit 5 Vet(r), utilizando un transductor Phase Array MHz(r), con modos B y M, con Doppler pulsado, Doppler tisular y ECG sincrónico. Se observó que la pared libre del ventrículo derecho correspondía a menos de la mitad de la pared libre del ventrículo izquierdo, no evidenciando hipertrofia ventricular derecha. El índice de distensibilidad de la rama derecha de la arteria pulmonar fue del 43%, siendo el valor normal mayor al 30% (Figura 5a). Además, se pudo observar un par de estructuras hiperecoicas paralelas, sugerentes a presencia de una filaria (Figura 4b).
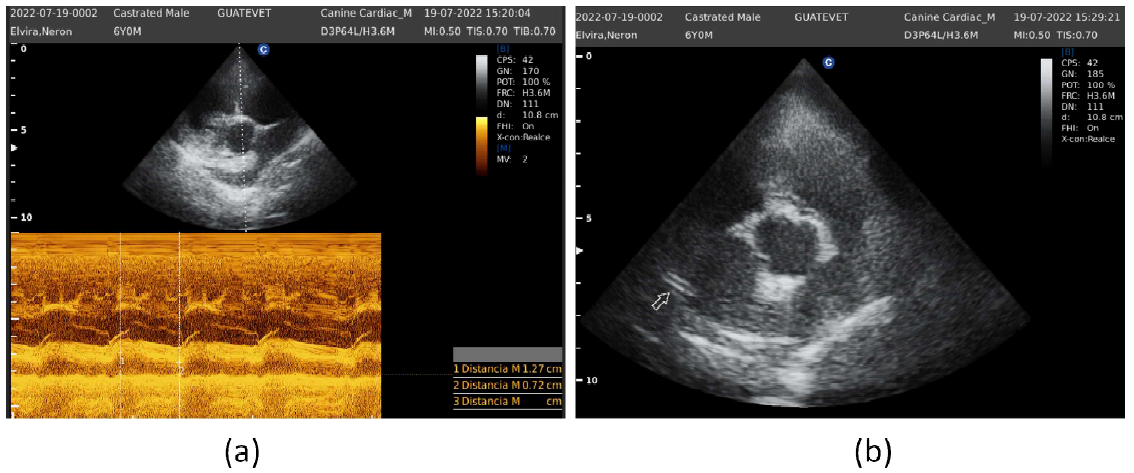
Figura 4 Paciente canino macho de 6 años. Ecocardiograma. (a) Modo M. Medición de distensibilidad de la arteria pulmonar. (b) Modo B. Presencia de estructuras hiperecoicas compatibles con filarias a nivel de la rama derecha de la arteria pulmonar
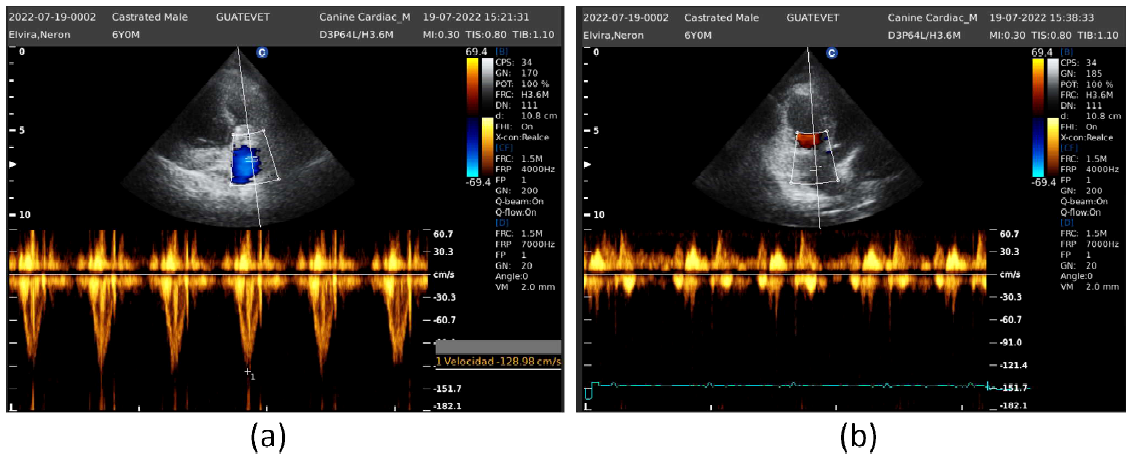
Figura 5 Paciente canino macho de 6 años. Ecocardiograma. Dopler color. (a) Perfil de flujo pulmonar laminar normal. (b) Reflujo tricíspideo de baja velocidad
En la evaluación Doppler color de la válvula pulmonar se observó un leve aliasing sistólico, sin insuficiencia valvular diastólica. El perfil de flujo pulmonar fue tipo 1 laminar, con una velocidad máxima de 128.98 cm/s (Figura 5a). La velocidad de regurgitación tricuspídea fue de 35 cm/s (Figura 5b).
El EPSS fue de 0.34 cm (valor de referencia <7 mm). La fracción de acortamiento del VI fue de 32.47% (valor de referencia de 28-44%) y la fracción de eyección de 62.12% (valor de referencia 50-72%). No se observó aplanamiento septal. El espesor parietal relativo de la pared libre del VI fue de 0.57 (valor de referencia 0.35-0.73). La relación atrio izquierdo: aorta fue de 1.01 (valor de referencia <1.6). La relación aorta: tronco pulmonar fue de 1.18 (valor de referencia <1.15). No se observó aliasing considerable en la válvula tricúspide. El TAPSE (Tricuspid annular plane systolic excursion) fue de 1.40 cm (valor de referencia de 20 a 40 kg de 1.5-2 cm). El patrón de flujo y velocidad de la onda E y onda A de ambas válvulas atrioventriculares fue normal y dentro de rango. En la evaluación del doppler tisular a nivel del anillo mitral y pared libre del VI fue normal, evidenciando ondas E' con velocidad de 10.53 cm/s y 12.03 cm/s, respectivamente. El índice de TEI (Miocardial performance index) fue de 0.97 (valor de referencia <0.25). El flujo aórtico fue laminar con una velocidad máxima de 145 cm/s.
En el cuadro hemático no se observaron alteraciones hematológicas. En el frotis se observaron eritrocitos normocíticos normocrómicos sin presencia de parásitos intracelulares y extracelulares. En la prueba de gota gruesa no se observaron microfilarias. El urianálisis mostró nuevamente una orina poco concentrada y alcaliuria, sin otros hallazgos bioquímicos relevantes (densidad 1.023, pH 8, proteínas trazas).
DISCUSIÓN
Se ha estimado una prevalencia mundial de dirofiliariasis de 10.2% (Anvari et al., 2020). Wang et al. (2014) determinó prevalencias entre 0.3 al 20%, estando las mayores prevalencias asociadas a factores tales como el clima (temperatura anual, precipitación y humedad relativa), factores geográficos (elevación, cobertura forestal y cobertura de aguas superficiales), factores sociales (densidad de población humana e ingresos familiares) y la presencia o ausencia del vector (Aedes aegypti, Aedes albopictus, entre otros). Por otra parte, Anvari et al. (2020) observaron un descenso de la prevalencia de la enfermedad en los últimos años dado por el control preventivo del vector. Sin embargo, en zonas endémicas donde no se tienen métodos profilácticos, se ha observado un incremento de los casos debido a factores climáticos asociados al calentamiento global (Anvari et al., 2020). Guatemala, al ser un país tropical, posee estos factores que favorecen la presencia de la enfermedad, así como el ciclo biológico del vector.
Los hallazgos clínicos son inespecíficos y están relacionados con la gravedad del cuadro clínico. Las escasas manifestaciones clínicas hacen que el diagnóstico temprano de la enfermedad sea poco frecuente, por lo que la mayoría de los casos son diagnosticados en la necropsia (Anvari et al., 2020).
Dentro de los hallazgos laboratoriales se ha observado anemia. Sidoti et al. (2016) señalan mayor fragilidad de los glóbulos rojos y hemólisis como causa de la misma. Por otra parte, Muñoz (2003) menciona que la vida media de los eritrocitos es de 15 días en perros sintomáticos con hipertensión pulmonar y puede alcanzar los 11 días en pacientes con dirofilariosis grave. La anemia normocítica normocrómica es el hallazgo más frecuente en estos pacientes, habiéndose asociado, además, a procesos inflamatorios y/o infecciosos, así como a la relación simbiótica de D. immitis con la bacteria Wolbachia sp (Clarke, 2006). La ocurrencia de hiperproteinemia se asocia en la mayoría de los casos a una hipoalbuminemia e hipergammaglobulinemia, siendo reportado este hallazgo en el 30% de los pacientes con dirofilariosis (Sidoti et al., 2016). La hiperproteinemia debe dar la pauta al seguimiento periódico del paciente, ya que en muchas ocasiones desencadena una glomerulonefritis (Clarke, 2006).
Existen diversos métodos para el diagnóstico de D. immitis, siendo la necropsia, la detección de antígenos y el método de Knott modificado los más comunes, y en menor frecuencia el PCR, ELISA, frotis sanguíneo y la inmunofluorescencia indirecta (IFI) (Anvari et al., 2020). Ante esto, la AHS (2020) ha establecido pautas diagnósticas, además de la imagenología, como otras alternativas que ayudan al diagnóstico temprano de la enfermedad cuando las pruebas rutinarias no son concluyentes o no están disponibles.
La serología es la prueba más utilizada para el diagnóstico de la enfermedad. Little et al. (2018) mencionan que los ensayos ELISA con placa de microtitulación se consideran las pruebas más sensibles para la detección de dirofilaria, con una sensibilidad del 85.7% y especificidad del 100%. Sin embargo, los ensayos inmunocromatográficos que están diseñados para proveer un resultado rápido en la clínica tienen menor sensibilidad (46-76.2%) en pacientes infectados con una sola dirofilaria hembra (Little et al., 2018) y están dirigidos a proteínas del tracto reproductivo de hembras adultas de D. immitis, no detectando, por lo tanto, a filarias como D. repens y Acanthocheilonema reconditum. Además, esta prueba solo detecta estadios adultos. Por esta razón, el resultado negativo de una prueba de antígeno no asegura que el paciente esté libre de una infección por dirofilaria. La AHS (2019) indica que los resultados falsos negativos pueden deberse a una baja carga de dirofilarias en sangre, así como la presencia de hembras inmaduras, infecciones monosexo en caso de machos o que existan inmunocomplejos (antígeno-anticuerpo) que pueden interferir con la prueba dando un resultado falso negativo.
La imagenología es utilizada con poca frecuencia para el diagnóstico de dirofilariasis. Sin embargo, la AHS (2019) señala su importancia no solo para el diagnóstico sino, además, para evaluar el estado cardiopulmonar y establecer la gravedad de la enfermedad. En el caso del ultrasonido cardíaco, permite evidenciar la presencia de parásitos del corazón, así como evaluar la anatomía y función cardiaca que se ven afectadas por la enfermedad (AHS, 2019). La pared cuticular del cuerpo de los gusanos del corazón adultos es altamente ecogénica y reflectiva, lo que produce imágenes lineales paralelas cortas distintivas con la apariencia de "signos iguales" (Jones, 2016). Este hallazgo fue determinante para el diagnóstico definitivo del paciente, ya que se observó un incremento del grosor del tracto de salida del ventrículo derecho, con presencia las estructuras hiperecoicas compatibles con la presencia de filarias. Estas estructuras se presentan cuando existe presencia de gusanos en atrio y ventrículo derecho, además, del movimiento retrógrado de los parásitos hacia estos sitios del corazón. Cuando esto ocurre, una masa de gusanos puede atravesar o alojarse de forma aberrante en la válvula tricúspide, ventrículo derecho, atrio y en la vena cava (Jones, 2016).
La limitante del ultrasonido cardíaco radica en pacientes con bajas cargas parasitarias, ya que los gusanos se limitan a la periferia de las ramas de las arterias pulmonares más allá del campo de visión. Cuando hay altas cargas parasitarias, es más probable que estén presentes en la arteria pulmonar principal derecha y proximal izquierda, ramas interlobulares o dentro del lado derecho del corazón donde se puedan visualizar fácilmente (AHS, 2019). En perros con hemoglobinuria, la visualización de gusanos del corazón en el orificio de la válvula tricúspide sugiere el "síndrome de la cava" (Venco et al., 2001).
Los problemas pulmonares anteceden a los cambios vasculares provocados por la acción traumática del parásito. Estos cambios incluyen la salida de proteínas y líquido por la pared de los vasos afectados produciendo edema en el parénquima (Venco et al., 2001). Durante la exploración del parénquima pulmonar con ultrasonido (Vet blue), es posible observar a nivel de los cuatro puntos distintas líneas B, las cuales indican presencia de fluido en el parénquima pulmonar (Venco et al., 2021). La hipertensión arterial pulmonar precapilar es frecuente en pacientes con dirofilariasis, por lo que la visualización del parásito es sugerente de la infección. Sin embargo, Angiostrongylus sp puede causar el mismo cuadro como consecuencia de la obstrucción del flujo sanguíneo y engrosamiento de las arterias por la endoarteritis dando como resultado cambios cardíacos que producen la hipertensión de la circulación pulmonar arterial (Reinero et al., 2020).
En el seguimiento del paciente, a pesar de visualizar una filaria en la arteria pulmonar, no se encontraron cambios en modo B, modo M, doppler color, pulsado o continuo que sugieran probabilidad de hipertensión pulmonar. Estos cambios de retorno a la normalidad pueden deberse a la terapia con selamectina (lactona macrocíclica), ya que tiene efecto microfilaricida. Así mismo, la administración conjunta de doxiciclina tuvo la finalidad de eliminar a la bacteria Wolbachia, que tiene un papel fundamental en la reproducción del parásito (Bowman yAtkins, 2009). Esto indica la eficacia del tratamiento, la mejoría clínica del paciente y el por qué se observaron menos filarias y reducción de la resistencia del flujo pulmonar que condujo a la eliminación del estímulo de hipertrofia del ventrículo derecho. El uso de sildenafil, al inhibir la fosfodiesterasa 5 (mecanismos de vasodilatación) mejoró el flujo sanguíneo arterial pulmonar y disminuyó la resistencia a vencer por el ventrículo derecho, reduciendo el estímulo para su hipertrofia. El uso de glucocorticoides para tratar la endoarteritis inmunomediada, así como la posible reacción por muerte de microfilarias, tuvo un efecto benéfico en el control sintomático de la tos, reportando mejoría clínica durante su administración.
CONCLUSIÓN
La dirofilariasis es una enfermedad común en zonas endémicas., de diagnóstico complejo dado el ciclo biológico y periodo pre patente del parásito. Por tal razón, es de importante establecer protocolos diagnósticos que ayuden a identificar los agentes parasitarios. Sin embargo, las limitantes en las pruebas serológicas obligan al clínico a establecer otras herramientas como el ultrasonido cardiaco. Esto hace que el médico veterinario valore estas técnicas diagnósticas y utilice estos protocolos clínicos para la aproximación diagnóstica y terapéutica certera.












 uBio
uBio