INTRODUCCIÓN
Usualmente se asume que los mamíferos producen igual proporción de crías macho y hembra (Rosenfeld y Roberts, 2004), pero existen diversos factores en algunas especies domésticas y silvestres que pueden influenciar el sexo de la cría, como el momento de la inseminación artificial respecto del comienzo del estro (Wehner et al., 1997; Martínez et al., 2004), el sitio de deposición del semen (Zobel et al., 2011), la concentración de testosterona en el fluido folicular preovulatorio (Grant et al., 2008), el estado de maduración del ovocito al momento de la fecundación in vitro (Agung et al., 2006), la condición corporal y la dieta con alta energía de la madre (Green et al., 2008) y el grado de dominancia materna (Meikle et al., 1993), entre otros. En mamíferos, se ha establecido que el sexo primario es determinado por la probabilidad de que un espermatozoide con cromosoma X o Y fertilice un ovocito, mientras que el sexo secundario es determinado al nacimiento (crías). Actualmente, no está claro si la relación macho: hembra al momento de la concepción (sexo primario) y al nacimiento (sexo secundario) pueden ser sesgadas de la relación teórica 1:1 esperada (Jongbloet et al., 2004).
En bovinos se ha reportado que la proporción de machos gestados en el cuerno derecho de vacas apareadas naturalmente fue significativamente más alta en comparación con el sexo de los terneros gestados en el cuerno izquierdo (Hylan et al., 2009). Asimismo, estos autores determinaron una mayor proporción de embriones hembra producidos de ovocitos del ovario izquierdo en estudios in vitro; sin embargo, en vacas ovariectomizadas y superovuladas, la relación de sexos de los embriones no fue diferente entre ovarios. Por otro lado, ha ido sugerido que el ovocito ovulado podría estar adaptado a recibir espermatozoides con cromosoma X o Y (Granty Chamley, 2007). En contraste, estudios experimentales in vitro demostraron que el ovocito mamífero no es selectivo hacia espermatozoides con cromosomas X o Y (Zuccotti et al., 2005; Bermejo-Álvarez et al., 2008).
La relación de sexos de los embriones o de las crías nacidas en camélidos sudamericanos (CSA) provenientes de ovulaciones de los ovarios izquierdo o derecho es desconocida, no habiéndose hallado literatura internacional sobre este evento fisiológico. Una relación sesgada de sexos estaría indicando que el ovario de origen del ovocito podría influenciar la selección para la fecundación por un espermatozoide X o Y, ya que el 95% de los embriones/fetos se desarrollan en el cuerno uterino izquierdo (Fernández-Baca et al., 1970); en consecuencia, el cuerno de gestación tendría poca o nula incidencia en la relación de sexos secundaria. Por lo tanto, el objetivo del presente trabajo fue determinar la relación de sexos de las crías nacidas provenientes de ovulaciones de los ovarios izquierdo o derecho en llamas (Lama glama) naturalmente apareadas. Adicionalmente, se comparó el largo de la gestación y el peso al nacimiento de las crías nacidas de ambos sexos.
MATERIALES Y MÉTODOS
Lugar de Estudio
El trabajo se llevó a cabo en el rebaño de llamas (Lama glama) de la Estación Experimental Agropecuaria (EEA) Abra Pampa del Instituto Nacional de Tecnología Agropecuaria (INTA), ubicada en la provincia de Jujuy, Argentina a 3484 msnm. Esta región es una zona agroecológica de puna seca con un régimen de lluvia de 250-300 mm anuales en temporada estival (diciembre a marzo) y sin precipitación pluvial el resto del año. Los ensayos experimentales se realizaron bajo las normas de Bioética y Bienestar Animal aprobados por el Comité Institucional para el Cuidado y Uso de Animales de Experimentación (CICUAE), Protocolo CRS-J Nº 9/19 del INTA.
Animales y Diseño Experimental
En las temporadas reproductivas de 2020 y 2021 (enero-febrero) se evaluaron 188 llamas (peso: 107.4 ± 6.7 kg, condición corporal [CC]: 4.1 ± 0.5, en la escala de 1 a 9). Todos los animales tenían presencia de un folículo ovárico preovulatorio (FOP) ≥ 7 mm de diámetro observado por ultrasonografía transrectal (transductor lineal 5 MHz, Honda HS101V, Japón) y una sola monta natural controlada (Día 0). Se utilizaron 32 machos adultos en cada temporada reproductiva. En el Día 2, la ocurrencia de la ovulación fue confirmada por ultrasonografía (desaparición del FOP) y entre los días 40-45 pos-monta se realizó el diagnóstico de gestación por medio de ultrasonido.
Se registraron las fechas de nacimiento y sexo y peso vivo de 92 crías. El largo de la gestación (días) se determinó al comparar el día de nacimiento con la fecha de monta. Se relacionó el sexo de la cría nacida viva con el ovario (izquierdo o derecho) de la ovulación. Todos los animales recibieron similar régimen de manejo y fueron alimentados en pasturas naturales.
Análisis Estadístico
Los datos fueron procesados mediante el software SAS. Las variables diámetro del FOP registrado en cada ovario al momento del apareamiento (Día 0), los días de gestación y el peso vivo de las crías macho y hembra fueron comparadas por análisis de varianza. La prueba de Chi cuadrado de bondad de ajuste se utilizó para comparar la relación total de sexos de las crías (relación esperada 1:1-macho: hembra) y la relación de sexos de las crías nacidas proveniente de cada ovario (izquierdo o derecho). Se trabajó con un nivel de significancia del 5% (α=0.05).
RESULTADOS
De 146 llamas con ovulación confirmada por ultrasonografía (Día 2 pos-monta), 104 (71.2%) se diagnosticaron preñadas a los 4045 días del apareamiento. De estas, se registraron 92 crías nacidas vivas (88.5%). El diámetro del FOP no difirió entre ovarios al momento del apareamiento (p=0.20).
La frecuencia del sexo de las crías con base al ovario donde ocurrió la ovulación se presenta en el Cuadro 1. No hubo diferencias significativas (p=0.14) en la proporción de crías nacidas provenientes de ovulaciones de ambos ovarios; sin embargo, se encontró mayor proporción de crías de sexo macho que de sexo hembra producidas del ovario izquierdo que del derecho (65.2 vs. 34.8%, respectivamente; p=0.04), en tanto que la proporción de crías hembras producidas por ambos ovarios fue similar (50% de cada ovario; p=1.00). Por otro lado, las proporciones de machos nacidos originados de ovulaciones del ovario izquierdo (30/53=56.6%; p=0.33) y ovario derecho (16/39=41.0%; p=0.26) no fueron significativamente diferentes de la paridad esperada 50:50. El largo de la gestación y el peso vivo al nacimiento fueron similares para ambos sexos (Cuadro 2).
Cuadro 1 Distribución del sexo de la cría según ovulación de los ovarios izquierdo y derecho en llamas (Lama glama)
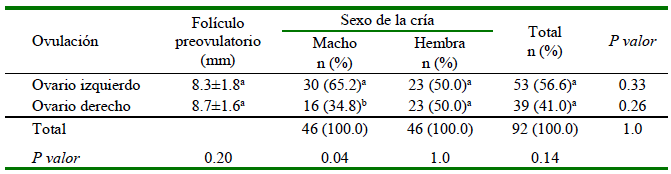
a,b Porcentajes con diferentes letras dentro de una misma columna son significativamente diferentes (X2 bondad de ajuste) y difieren de la paridad 1:1
DISCUSIÓN
Los resultados demuestran que, en llamas apareadas naturalmente, la relación de sexo de crías nacidas no fue diferente de la paridad esperada (50:50). Asimismo, los registros de 4615 hembras apareadas entre 2007 y 2022 en la población de llamas de la EEA Abra Pampa (INTA), indican el nacimiento de 2843 (61.6%) crías, de las cuales 1427 (50.2%) fueron machos y 1416 (49.8%) fueron hembras, demostrando que las proporciones de sexos no difieren de lo esperado (1:1). En este sentido, los resultados de la relación del sexo de crías del presente trabajo coinciden con los datos de nacimientos registrados en la población del centro experimental. Por otro lado, una mayor proporción de crías de sexo macho fueron originadas de ovulaciones del ovario izquierdo. En este trabajo, la tasa de natalidad fue 48.9% (92/188), lo que se encuentra dentro de los rangos esperados, teniendo en cuenta que se realizó una sola monta natural por hembra.
El diámetro folicular promedio de ambos ovarios al momento previo al apareamiento fue similar y no tuvo influencia sobre el sexo de la cría nacida. Este resultado coincide con lo observado en ensayos de fecundación in vitro en bovinos (García-Herreros et al., 2010).
Es ampliamente establecido que el sexo de la cría en los mamíferos es un tema de probabilidad, dependiendo si un espermatozoide con cromosoma X o Y del macho arriba primero al ovocito. Sin embargo, un número importante de estudios publicados reportaron la ocurrencia de una relación de sexos secundaria atípica en una gran variedad de mamíferos, y en casi todos esos estudios, la relación de sexos atípica estuvo asociada con características o comportamiento maternos (Meikle et al., 1993; Green et al., 2008; Grant y Chambley, 2010).
Hylan et al. (2009) observaron en bovinos que no hubo selección preferencial para el sexo del embrión en los cuernos uterinos. Más aún, la relación de sexo en embriones y teneros producidos del apareamiento natural en aquel estudio, sugiere que el ovario de origen de la cual la preñez es derivada puede influenciar el sexo de la cría antes que el cuerno uterino de gestación. En consecuencia, los CSA son un excelente modelo animal para estudiar el origen ovárico del sexo de la cría, debido a que el embrión proveniente de la ovulación del ovario derecho permanece muy pocos días en el cuerno derecho y migra al cuerno izquierdo (Picha et al., 2013), donde el 98% de los fetos se desarrollan en ese cuerno uterino (Bravo y Varela, 1993).
En el presente trabajo, es sorprendente que una mayor proporción de machos hayan sido originados de ovulaciones del ovario izquierdo, por lo que el sexo de la cría nacida puede proveer evidencias acerca del ovario de origen, indicando que el ovocito podría influenciar la selección para la fecundación de un espermatozoide con cromosoma Y. Sin embargo, estudios experimentales demostraron que los ovocitos no son selectivos hacia espermatozoides de un sexo u otro (Zuccotti et al., 2005; Bermejo-Álvarez et al., 2008).
Tratando de encontrar alguna explicación a aquel evento fisiológico observado en el presente trabajo, Zobel et al., (2011) demostraron en bovinos, que la deposición intrauterina profunda en la inseminación artificial resultó en una más alta proporción de terneras hembra, mientras que la deposición del semen en el cuerpo del útero resultó en una más alta proporción de terneros macho, probablemente debido a las diferencias fisiológicas en motilidad, periodo de capacitación y vida media de los espermatozoides con cromosomas X o Y. Sin embargo, en los CSA la deposición natural del semen es intrauterina distribuida en los dos cuernos uterinos y la relación de sexos secundaria observada en el presente trabajo y en las estadísticas poblacionales de la EEA Abra Pampa no difiere de la paridad esperada.
Se ha sugerido que la concentración de testosterona en el fluido folicular preovulatorio puede predisponer al ovocito ovulado a ser preferencialmente fertilizado por un espermatozoide X o Y (Grant et al., 2008). Estos autores demostraron una correlación positiva entre la concentración de testosterona en el fluido folicular in vivo y la probabilidad que el ovocito recuperado sea fertilizado in vitro por espermatozoides con cromosoma Y. Estudios similares deberían ser llevados a cabo en CSA para tratar de explicar la mayor proporción de crías de sexo macho originada del ovario izquierdo.
La duración de la gestación fue mayor que la reportada por San Martín et al. (1968), que fue de 342 a 350 días. El peso vivo al nacimiento de las crías fue similar entre sexos en el presente estudio y no difiere de lo informado por Brown (2000), ni por lo registrado en la población de la EEA Abra Pampa (machos: 10.4 kg y hembras: 10.2 kg).
En resumen, los cambios en la relación de sexos de los embriones o crías resultan de mecanismos que ocurren tanto previo a la fertilización a través de la habilidad de un espermatozoide X o Y alcance o penetre el ovocito, como después de la fertilización, vía pérdida selectiva del concepto de un sexo relativo al otro sexo. Aunque el mecanismo para el sesgo de la relación de sexos sigue sin estar claro y discutido en la literatura internacional, los resultados preliminares del presente trabajo podrían tener una considerable implicancia práctica en el manejo comercial de los rebaños de CSA, cuando las crías de un sexo pueden ser preferidas por sobre el otro sexo.
CONCLUSIONES
Los resultados proveen evidencias que las ovulaciones de ambos ovarios producen similar proporción de crías nacidas y que las ovulaciones del ovario izquierdo producen mayor proporción de crías de sexo macho. La duración de la gestación y el peso vivo al nacimiento fueron similares para ambos sexos.












 uBio
uBio 



