INTRODUCCIÓN
Los peces nativos de aguas continentales tienen baja riqueza, alto endemismo y distribución geográfica restringida en Chile. Se reconocen 43 especies (Ruiz y Marchant, 2004), habiendo realizado estudios parasitológicos en solo 17 de ellas (Muñoz y Olmos, 2008). En especies nativas se han identificado parásitos zoonóticos como Dibothriocephalus spp en Galaxias maculatus, Galaxias platei, Basilichthys australis, Odontesthes mauleanum y Diplomystes camposensis (Torres y Yera, 2018), Anisakis sp en Eleginops maclovinus y Pseudoterranova sp en Mugil cephalus (Muñoz y Olmos, 2008).
La cuenca del río Valdivia (CRV), asociada al bosque templado lluvioso en el sur de Chile (Soto y Campos, 1996) se localiza entre 39°20' y 40°10' de latitud sur e incluye los lagos Pirehueico, Neltume, Pellaifa, Panguipulli, Calafquén, Pullinque y Riñihue. Entre ellos, el lago Pullinque es el de menor superficie (Steffen, 2006) y no cuenta con estudios parasitológicos en sus peces. No obstante, se han identificado endohelmintos en peces nativos en los siguientes lagos de la CRV:
Lago Riñihue [Hysterothylacium sp, Contracaeccum sp, Camallanus corderoi, Limnoderetrema tolosai, Austrodiplostomum mordax, Tylodelphys destructor y Dibothriocephalus dendriticus en B. australis; Dibothriocephalus latus, D. dendriticus, Contracaecum sp y C. corderoi en Perchcihthys trucha; Acanthostomoides apophalliformis, D. latus y D. dendriticus en G. maculatus; A. apophalliformis en Galaxias platei; C. corderoi en O. mauleanum y G. maculatus; y larvas de Gordiida en Aplochiton zebra y Trichomycterus areolatus (Torres et al., 1988a,b; 1990a,b; 1996; Torres y Neira, 1991; Torres y Yera, 2018; Torres, 2021)].
Lago Panguipulli [D. latus, D. dendriticus e Hysterothylacium geschei en P. trucha, O. mauleanum y B. australis, así como D. latus en P. trucha y G. maculatus (Raddatz et al., 2015; Torres y Yera, 2018)],
Lago Calafquén [A. apophalliformis en A. zebra, Hysterothylacium sp y C. corderoi en O. mauleanum, Contracaecum sp en G. platei y Aplochiton taeniatus y C. corderoi en B. australis y A. taeniatus (Torres et al., 1988a,b; 1990b)].
Lago Pellaifa [Contracaecum sp y C. corderoi en B. australis y A. apophalliformis en G. platei (Torres et al., 1988a,b, 1990b)].
Por otro lado, los estudios histopatológicos por endohelmintos de peces nativos se limitan a A. mordax y T. destructor en B. australis (Siegmund et al., 1997), Dibothriocephalus spp en B. australis, P. trucha y O mauleanum (Torres et al., 2012), y A. aphophalliformis en G. maculatus (Torres et al., 1988a).
Debido a la falta de información sobre parásitos en peces del lago Pullinque se propuso estudiar a G. maculatus, también presente en lagos de países como Australia, Nueva Zelanda y Argentina (McDowall y Frankenberg, 1981), y B. australis, endémico de Chile. Estas dos especies son parte de las especies cultivables en Chile (Ruiz y Marchant, 2004). Los objetivos del estudio fueron identificar los endohelmintos en ambas especies en el lago Pullinque, determinar su prevalencia, intensidad media, abundancia media, señalar su potencial zoonótico, describir los taxones nuevos para Chile y evaluar potencial cambio histopatológico en muestras parasitadas del intestino de B. australis.
MATERIALES Y MÉTODOS
En diciembre de 2011, se colectaron 48 peces distribuidos en G. maculatus (17 hembras, 10 machos y dos indeterminados de 2344 mm de longitud total [media: 33.5]), y B. australis (nueve hembras, cuatro machos y uno indeterminado de 24-39 cm de longitud total [media: 31]), en el lago Pullinque (39°33´S; 72°08´O), Chile. La muestra de G. maculatus fue colectada con pesca eléctrica, manteniendo los peces vivos a 4 °C, en tanto que la muestra de B. australis fue obtenida con redes colocadas por una noche en el lago. Los peces fueron conservados a 4 °C y examinados dentro de las 48 h de su captura.
El estómago, intestinos, hígado, vesícula biliar, bazo, páncreas, vejiga natatoria, gónadas, mesenterios, corazón y cerebro fueron examinados para la búsqueda de endohelmintos siguiendo estudios previos (Torres y Puga, 2011). La musculatura fue examinada, previa compresión en placas de vidrio, bajo microscopio estereoscópico (Torres y Puga, 2011).
Los nematodos fueron fijados en etanol de 70% y diafanizados en lactofenol. Los trematodos y acantocéfalos fueron fijados en AFA, preservados en etanol de 70%, teñidos con hematoxilina de Mayer o carmín acético de Semichon (Pritchard y Kruse, 1982), deshidratados, diafanizados en salicilato de metilo y montados en bálsamo de Canadá.
Los acantocéfalos, previo a su fijación, fueron colocados en agua destilada a 4 °C para evertir su probóscide (Pritchard y Kruse, 1982). Algunas muestras de intestino de B. australis infectadas con helmintos fueron fijadas en formol-salino e incluidas en parafina para efectuar cortes sub-seriados de 8 µm, y teñidos con hematoxilina eosina. Para las mediciones de los endohelmintos fue utilizado un microscopio Zeiss Axiostar Plus con objetivos de 5x, 10x y 40 x.
Los términos de prevalencia (P), intensidad media (I) y abundancia media (A) fueron usados de acuerdo con Bush et al. (1997). Especímenes de una especie descrita por primera vez en Chile fueron depositados en la Colección del Museo de Zoología, Universidad de Concepción, Chile (MZUC 4671146712).
RESULTADOS
Cada pez examinado presentó uno o más taxones de endohelmintos cuya P, I, A, estadio de desarrollo y localización se indican en el Cuadro 1. G. maculatus y B. australis presentaron 8 y 6 taxones de endohelmintos, respectivamente. Seis de los taxones identificados en G. maculatus correspondieron a estados larvarios, cuatro con P mayores de 50% (A. apophalliformis, Tylodelphys sp., Posthodiplostomum sp y Contracaecum sp). Tylodelphys sp y Posthodiplostomum sp mostraron la mayor I yA (Cuadro 1). Cuatro de los taxones identificados en B. australis fueron estados larvarios, tres de ellos con P igual o mayor al 50% (A. mordax, T. destructor, Contracaecum sp) (Cuadro 1). Limnoderetrema tolosai presentó la mayor P, I y A de infección (Cuadro 1).
Cuadro 1 Prevalencia, intensidad media y abundancia media de infección por endohelmintos parásitos en los peces nativos Galaxias maculatus y Basilichthys australis del lago Pullinque, Chile
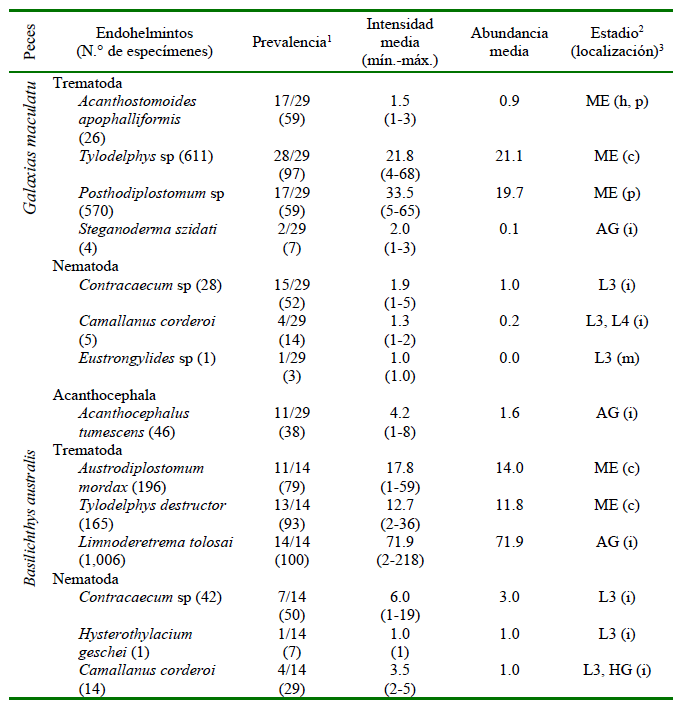
1 Peces infectados/examinados (porcentaje)
2 ME = metacercarias, AG = adultos grávidos, L3 = larvas del tercer estadio; L4 = larvas del cuarto estadio, HG = hembras grávidas
3 h=hígado, p=peritoneo, c=cerebro, i= intestino, m=músculos
Steganoderma szidati y Eustrongylides sp encontradas en G. maculatus son descritas por primera vez en Chile. Las medidas son expresadas en micrómetros [media (mínima y máxima)], a menos que se indique lo contrario:
a) Steganoderma szidati (Descripción basada en cuatro especímenes adultos encontrados en el intestino). Figura 1. A-D, Zoogonidae Odhner, 1902, Lepydophyllinae Stossich, 1903, Steganoderma Stafford, 1904.
Cuerpo 1.8 (1.5-2.0) mm de largo por 938 (710-1150) de ancho. Tegumento espinoso.
Distancia borde anterior de la ventosa oral-borde anterior de la ventosa posterior 517 (490-560), ocupa el 28.7% (26.0-32.0%) de la longitud corporal.
Distancia borde posterior de la ventosa posterior-borde posterior del cuerpo 942 (760-1100), ocupa el 51.7% (45.7-54.3%) de la longitud corporal.
Ventosa oral subterminal 198 (170-225) de largo y 211 (200-225) de ancho.
Ventosa posterior situada detrás del saco del cirro, 356 (280-470) de largo y 399 (307-500) de ancho.
Razón largo de la ventosa oral: largo ventosa posterior 1: 1.8 (1.4-2.2); razón ancho de la ventosa oral: ancho ventosa posterior 1:1.9 (1.4-2.3).
Pre-faringe aparentemente ausente. Faringe ovalada 76 (55-100) de largo y 84 (70-92) de ancho. Esófago 79 (50-100) de largo.
Ciegos angostos que se extienden hasta los testículos o posterior a ellos.
Testículos detrás de la ventosa posterior, simétricos, redondeados o levemente ovalados; testículo izquierdo 267 (200-350) de largo y 195 (150-250) de ancho; testículo derecho 300 (230-400) de largo y 187 (130-240) de ancho.
Saco del cirro 459 (312-725) de largo y 136 (95-222) de ancho, extendiéndose desde el borde anterior de la ventosa posterior al poro genital común marginal e izquierdo, situado entre la faringe y el esófago.
Vesícula seminal 142 (90-212) de largo y 110 (70-162) de ancho; región prostática rodeada de células glandulares alargadas.
Cirro con dos espinas en la región anterior.
Ovario redondeado, pre-testicular y anterior al testículo derecho 172 (140-242) de largo y 161 (125-200) de ancho.
Dos glándulas vitelinas con folículos agrupados lateralmente entre el margen anterior de la ventosa posterior y margen posterior de los testículos con 10-13 folículos de 93.6 (70-140) de largo y 76 (50-100) de ancho en el lado izquierdo, y 9-10 folículos de 104 (80-130) de largo y 72 (70-80) de ancho en el lado derecho del cuerpo.
Útero alcanza la región post-testicular. Metratermo muscular.
Huevos operculados, 31 (25-37) de largo y 17 (12-20) de ancho.
Vesícula excretora sacular; poro excretor terminal.
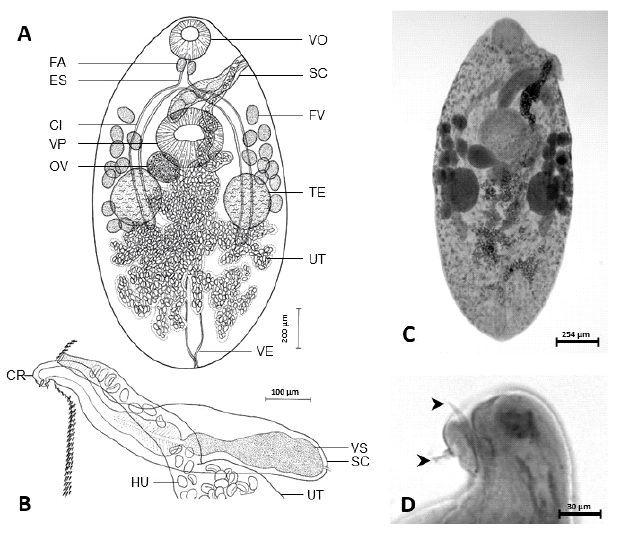
Figura 1 Adulto de Steganoderma szidati en Galaxias maculatus. A. Esquema con las características morfológicas; B. Esquema del saco del cirro; C. Espécimen teñido con hematoxilina de Mayer; D. Extremo anterior del cirro mostrando dos espinas (cabeza de flecha). VO= ventosa oral. FA= faringe. ES= esófago. SC= saco del cirro. FV= folículo vitelino. CI= ciego intestinal. VP= ventosa posterior. OV= ovario. TE= testículo. UT= útero. VE= vejiga excretora. CR= cirro. HU= huevo. VS= vesícula seminal
b) Eustrongylides sp
(Descripción basada en una larva de tercer estadio encapsulada, de color rojizo, encontrada en la musculatura dorsal del tronco, detrás de la región cefálica). Figura 2 AD, Dioctophymatidae Railliet, 1915; Eustrongylides Jägerskiöld, 1909.
Cuerpo 21.3 mm de largo provisto de dos cutículas.
Extremo cefálico cónico y 12 papilas labiales distribuidas en dos círculos de 6 papilas.
Cavidad bucal 107 de largo.
Esófago 8.1 de largo.
Ancho a nivel del anillo nervioso 165. Ancho a nivel de la región caudal 210 y en la unión esófago-intestinal 320.
Distancia anillo nervioso-extremo anterior 233.
Ano terminal.
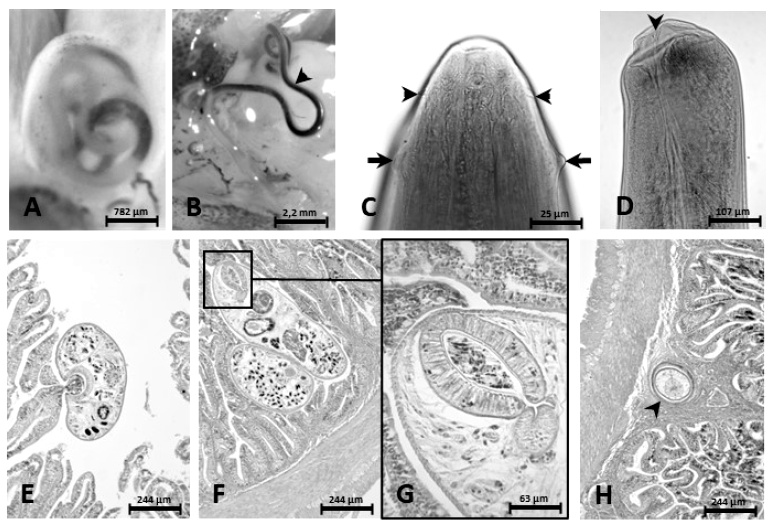
Figura 2 Eustrongylides sp y Limnoderetrema tolosai. A. Larva encapsulada del tercer estadio de Eustrongylides sp en Galaxias maculatus; B. La misma larva sin la cápsula (cabeza de flecha); C. Región anterior mostrando papilas laterales de los círculos anterior (cabezas de flecha) y posterior (flechas); D. Ano en la región caudal (cabeza de flecha); E. Corte histológico de intestino de Basilichthys australis teñido con hematoxilina eosina mostrando un adulto de L. tolosai adherido a vellosidad cercana al lumen; F. Adultos de L. tolosai en la base de las vellosidades; G. Imagen aumentada del recuadro mostrando restos de mucosa en el interior de la ventosa oral; H. Corte histológico de intestino de B. australis, teñido con hematoxilina-eosina mostrando una larva de Contracaecum sp. encapsulada en el tejido conectivo de la submucosa (cabeza de flecha)
Los cortes histológicos del intestino de B. australis mostraron adultos de L. tolosai libres entre las vellosidades intestinales cercanas al lumen o en la base de ellas, adheridos mediante sus ventosas en cuyo interior se aprecian restos de mucosa (Figura 2 EG), sin evidenciarse reacción inflamatoria. También se presentaron larvas viables encapsuladas de Contracaecum sp en el tejido conectivo de la submucosa (Figura 2 H), con leve congestión y escasas células mononucleares.
DISCUSIÓN
Todos los endohelmintos encontrados en G. maculatus y B. australis son reportados por primera vez en el Lago Pullinque. Steganoderma szidati y Eustrongylides sp se describen morfológicamente por primera vez en Chile y Posthodiplostomum sp y A. tumescens se registran por primera vez en la CRV. La mayoría de los taxones fueron encontrados en un solo hospedero, excepto Contracaecum sp y C. corderoi. Para C. corderoi la P fue duplicada, la I casi triplicada y la A quintuplicada en B. australis, respecto a G. maculatus, lo que podría atribuirse, en parte, a su mayor tamaño y probablemente mayor frecuencia y abundancia de consumo del copépodo hospedero intermediario, Mesocyclops araucanus (Torres et al., 2010). En B. australis se observaron hembras grávidas de C. corderoi, mientras que, en G. maculatus solo se registraron estados larvarios; coincidiendo con estudios previos en que solo B. australis, O. mauleanum y P. trucha presentaron hembras grávidas, mientras que en G. maculatus se encontraron lar-vas y hembras inmaduras (Torres et al., 1990a,b).
La P de Contracaecum sp fue similar en G. maculatus y B. australis, perola I y A fue tres veces más elevada en B. australis. La Pen G. maculatus fue mayor al 7.7% y 31.0% pero la I estuvo dentro del intervalo (1-3.6) reportado previamente en algunos ríos de la CRV (Torres et al., 1988b). En lagos y ríos de Argentina se señalan P de 4-70% e I de 1-3.7 en G. maculatus (Viozzi et al., 2009). En B. australis la P e I por Contracaecum sp se mantuvo en el intervalo observado en ríos del CRV y los lagos Riñihue y Pellaifa (P = 8.7-100%; I = 1-11.5) (Torres et al., 1988b), pero fueron menores a lo comprobado en el río Valdivia (P: 66.7100%; I: 249-627), donde Phalacrocorax brasilianus, hospedero definitivo de Contracaecum rudolphii (sensu lato), presentó P de 92.5% (Torres et al., 2000).
Entre los taxones identificados en su fase larvaria en G. maculatus, su estado adulto desarrolla en aves piscívoras (Tylodelphys sp., Posthodiplostomum sp, Contracaecum sp y Eustrongylides sp) (Moravec, 1998; Niewiadomska, 2002), o en peces ictiófagos como P. trucha (A. apophalliformis) (Torres et al., 1992). Tylodelphys sp presentó la mayor PyAde infección en G. maculatus. Anteriormente, Tylodelphys barilochensis (P: 4.4-31.6%; I: 9.3-73.0) y Tylodelphys crubensis (P: 7.2-100%; I: 8.6-59.9) fueron identificadas en el cerebro de G. maculatus en Argentina (Flores y Semenas 2002), comprobándose que T. barilochensis puede inducir necrosis por compresión del cerebro (Scheinert et al., 1997).
Los valores de P e I para A. apophalliformis en G. maculatus coinciden con los intervalos previamente reportados en ríos y en los lagos Calafquén y Riñihue en la CRV (P: 6.3-66.7%; I: 1-3) (Torres et al., 1988a). Las metacercarias de A. apophalliformis también han sido identificadas en G. maculatus (P: 5-100%; I: 1-13.2) en 15 ríos y lagos de Argentina (Viozzi et al., 2009). Los adultos de A. apophalliformis fueron identificados previamente en P. trucha del Lago Tagua Tagua (P: 45%; I: 3.8) (Torres et al., 1992), y en O. mykiss del lago Rupanco (Torres, 1995). La P e I de las metacercarias de Posthodiplostomum sp. en G. maculatus del lago Pullinque estuvieron dentro de los intervalos reportados en 20 lagos de Argentina (P: 4-100%; I: 2-257) (Viozzi et al., 2009).
Las características morfológicas de los adultos de S. szidati fueron similares a las descritas en G. maculatus de Argentina (Viozzi et al., 2000) y la P e I estuvieron incluidas en las cifras inferiores de los intervalos observados en 25 ríos y lagos de ese país (P: 3-88%; I: 1-22.8) (Viozzi et al., 2009).
La identificación de Eustrongylides sp fue basada en Moravec (1998). La baja P e I fueron similares a lo observado en la musculatura de G. maculatus en el lago Gutiérrez, Argentina (P: 2%; I: 1.2) (Guagliardo et al., 2019). En América del Sur también se han encontrado larvas de Eustrongylides spp en músculos y cavidad visceral en 46 y 9 especies de peces dulceacuícolas en Brasil (Eiras et al., 2016) y Perú (Murrieta Morey et al., 2022), respectivamente. Eustrongylides sp es el único taxón potencialmente zoonótico encontrado en el lago Pullinque, sumándose a D. latus y D. dendriticus, causantes de zoonosis registradas en peces nativos y salmónidos introducidos en otros lagos de la CRV (Torres y Yera, 2018). Solo siete casos de infección humana por larvas de Eustrongylides han sido identificados en el mundo, cuatro por consumo de pequeños peces vivos, uno por consumo de sushi/sashimi y dos de origen desconocido, siendo las lar-vas recuperadas en cinco casos en la cavidad abdominal por tratamiento quirúrgico y en dos casos al emerger por la piel (Guardone et al., 2021).
La P e I de A. tumescens en G. maculatus del lago Pullinque fueron más elevadas que en el lago Yelcho en Chile (P: 21.4%; I: 2.3) (Torres et al., 1992). También ha sido identificada en 18 lagos y ríos de Argentina (P:4-100%; I: 1-13.1] (Viozzi et al., 2009). La infección es trasmitida a los peces al ingerir el anfípodo hospedero intermediario, Hyalella patagonica, o por trasmisión pos-cíclica en peces ictiófagos (Rauque et al., 2002).
Tres de los cuatro taxones identificados por su estado larvario en B. australis, con prevalencias igual o mayor al 50% (A. mordax, T. destructor y Contracaecum sp), son trasmitidos a aves piscívoras como P. brasilianus (A. mordax, Contracaecum sp) (Siegmund et al., 1997; Torres et al., 2000) o aves de las familias Accipitridae, Ardeidae y Podicipedidae (Tylodelphys spp) (Niewiadomska, 2002). La P e I de A. mordax y T. destructor superaron aquellas observadas en el Lago Riñihue en distintos periodos del año (P:15.3-40% y 22.0-80.0%; I: 1-2.7 y 2.34.2, respectivamente) (Torres et al., 1996); cuyas metacercarias localizadas en las meninges, pliegues interlobulares y cavidades ventriculares no invadieron el parénquima cerebral (Siegmund et al., 1997). Tampoco, la infección por A. mordax (P: 7-10%; I: 349) y T. destructor (P: 100%; I: 35-140) provocó patología grave en Odontesthes hatcheri en el lago Pellegrini, Argentina. (Viozzi y Flores, 2002). Sin embargo, en dicho lago y hospedero se observó mortandad, deformación del cordón espinal, daño en el cerebro y cerebelo en infecciones con más de 200 metacercarias (Szidat y Nani, 1951).
También, en infecciones intensas por A. mordax se han descrito hemorragias, necrosis y daño de las fibras nerviosas durante su migración por el cerebro y cerebelo en Orestias sp y Odontesthes bonariensis en el lago Titicaca, Perú (Heckmann, 1992).
Solo en un espécimen de B. australis se encontró una larva de H. geschei. Previamente, solo estados larvarios han sido reportadas en B. australis (P: 8%; I: 8.8), mientras que los adultos grávidos solo desarrollarían en O. mauleanum (Raddatz et al., 2015). Limnoderetrema tolosai con la mayor P, I y A de infección en B. australis, también fue observada previamente en la totalidad de los peces examinados en los lagos Riñihue y Ranco (Torres y Neira, 1991).
En el estudio histopatológico se observa que los adultos de L. tolosai adheridos a la superficie de la mucosa intestinal dañan el epitelio de las vellosidades encontrando fragmentos de este en el interior de las ventosas, que servirían de alimento al parásito, como ha sido descrito en otros trematodos intestinales de peces (Dezfuli et al., 2017; Dumbo y Avenant-Oldewage, 2019). La ausencia de respuesta inflamatoria a la infección por L. tolosai, al igual que en otros trematodos como Didymodiclinus sp en Epinephelus marginatus, podría sugerir una adaptación evolutiva y probables mecanismos de evasión inmune (Polinas et al., 2018). Las larvas de Contracaecum sp encapsuladas en el tejido conectivo de la submucosa del intestino de B. australis, asociadas a leve congestión y escasas células mononucleares, fueron similares a las observadas en la mucosa y capas musculares con abundantes células inflamatorias en S. trutta (Torres y Cubillos, 1987) y A. taeniatus (Torres et al., 1992).
El presente estudio aporta nuevos registros de taxones de endohelmintos para Chile, aumentándose de los 15 ya conocidos (Paterson et al., 2021) a 17 en G. maculatus. En Argentina, Australia y Nueva Zelanda se han reportado 28, 11 y 16 taxones para este hospedero, respectivamente (Paterson et al., 2021), mientras que en B. australis, solo se conocen 11 endohelmintos (Muñoz y Olmos, 2008; Torres et al., 2012; Raddatz et al., 2015). Ambos hospederos son reconocidos como especies cultivables (Ruiz y Marchant, 2004), por lo cual los helmintos identificados en el presente estudio deberían ser considerados como riesgo potencial en futuros proyectos acerca de su cultivo y producción.
CONCLUSIONES
Se registraron por primera vez endohelmintos en peces nativos del lago Pullinque, Chile, incluyendo 8 y 6 taxones en Galaxias maculatus y Basilichthys australis, respectivamente; describiéndose Steganoderma szidati y Eustrongylides sp por primera vez en el país.
La mayor prevalencia (97%) y abundancia media (21.1) de infección en G. maculatus correspondió a Tylodelphys sp y la mayor intensidad media (33.5) a Posthodiplostomum sp.
La mayor prevalencia (100%), intensidad media (71.9) y abundancia media (71.9) de infección correspondieron a Limnoderetrema tolosai en Basilichthys australis.
Los adultos de L. tolosai, adheridos a la mucosa intestinal de B. australis, dañaban el epitelio de las vellosidades, mientras que las larvas encapsuladas de Contracaecum sp en la submucosa estuvieron asociadas a leve congestión y escasas células mononucleares.












 uBio
uBio 


