INTRODUCCIÓN
La llama (Lama glama) (Linnaeus, 1758), especie doméstica dentro de la familia Camelidae está adaptada a las condiciones de altura y tiene la característica de aprovechar alimentos de baja calidad con alta eficiencia (Nuevo Freire, 1994; Lichtenstein et al., 2010). Esta particularidad sustenta la necesidad de ampliar los conocimientos sobre el sistema digestivo de esta especie.
El hígado de los camélidos presenta una conformación macroscópica muy peculiar que ha despertado el interés de los anatomistas (Endo et al., 2000). En la llama se encuentra ubicado en la región abdominal craneal, hipocondrio derecho, con relación a las últimas seis costillas (Castro et al., 2001). Presenta dos superficies (parietal y visceral), tres bordes (craneal, caudal y ventral) y tres ángulos (dorsal, craneal y caudal). El borde ventral presenta profundas incisuras irregulares que le otorgan un aspecto complicado a la superficie del órgano y determinan su lobulación (Castro et al., 2009). Una disposición similar fue reportada para el camello dromedario (Camelus dromedarius) (Ouhsine y Zguigal, 1983; Lalla y Drommer, 1997). En el hígado de la llama se observan los lóbulos lateral izquierdo, medial izquierdo, cuadrado, derecho y caudado; este último conformado por los procesos caudado y papilar (Castro et al., 2009). Las vías biliares carecen de vesícula biliar (Vallenas, 1991).
En la familia Camelidae, la estructura microscópica del hígado ha sido descrita en el camello dromedario (Lalla y Drommer, 1997), en el camello bactriano (Camelus bactrianus) (Endo et al., 2000) y en la alpaca (Vicugna pacos) (Castro et al., 2016), pero no en la llama. El hígado en el camello dromedario (Lalla y Drommer, 1997) y en el camello bactriano (Endo et al., 2000) presenta abundante tejido conectivo interlobulillar que forma gruesos tabiques que delimitan lobulillos poligonales. Esta disposición es similar a lo descrito en la familia Suidae (Steiner y Ratcliffe, 1968), mientras que, en la alpaca, el tejido conectivo es escaso y está limitado exclusivamente a los canales portales (Castro et al., 2016). Asimismo, el endotelio que tapiza los sinusoides hepáticos ha sido descrito en el camello dromedario (Lalla y Drommer, 1997), donde las células endoteliales poseen múltiples fenestraciones y presentan la membrana basal sinusoidal discontinua.
El objetivo de este trabajo fue analizar las características histológicas del parénquima y del estroma hepático en la llama, con el fin de brindar un sustento morfológico para las técnicas de diagnóstico específicas del órgano y para las áreas de aplicación como la fisiología y la clínica en esta especie.
MATERIALES Y MÉTODOS
Muestreo
La población en estudio estuvo constituida por 20 llamas adultas, machos y hembras, de 99 ± 14 kg de peso y una edad promedio de dos años. Las muestras fueron obtenidas de los rebaños experimentales de la Facultad de Ciencias Veterinarias de la Universidad Nacional del Centro de la Provincia de Buenos Aires, Argentina, de la Facultad de Veterinaria y Zootecnia de la Universidad Peruana Cayetano Heredia, Lima, Perú, y de los camales municipales de Huancavelica y Pilpichaca, ambos ubicados en el departamento de Huancavelica, Perú.
Técnicas Histológicas
Para la descripción microscópica se tomaron muestras post mortem de los lóbulos del hígado. Las muestras se fijaron en formol tamponado (tampón de fosfato al 10%, pH 7.2-7.4) durante 48 h para luego iniciar su procesamiento mediante técnicas histológicas de rutina. Se realizaron cortes de 5 µm de espesor. En las láminas se empleó la tinción con hematoxilina-eosina para la observación de la estructura histológica y la tinción tricrómica de Masson para localizar el tejido conectivo, así como impregnación argéntica de Gomori para determinar la presencia de fibras reticulares, orceína para identificar fibras elásticas y ácido peryódico-Schiff (PAS) con y sin digestión con diastasa para localizar glucógeno.
Técnicas Inmunohistoquímicas
Los cortes, montados en portaobjetos positivados, fueron desparafinados, deshidratados e incubados con H2O2 al 3% en metanol durante 30 min a temperatura ambiente y aclarados en solución salina tamponada con fosfato (PBS, pH 7.4). La recuperación antigénica se realizó mediante una irradiación de microondas de 750 W, dos veces durante 5 min, en tampón de citrato (pH 6.0). Los sitios de unión no específicos se bloquearon con albúmina de suero bovino (BSA) al 2% durante 30 min en una cámara húmeda a 4 °C, seguido de la incubación del anticuerpo primario durante 1 h a 37 °C.
Se utilizaron los siguientes anticuerpos monoclonales primarios comerciales: antivimentina porcina, clon V9 (prediluido) (Dako(r), USA) para la identificación de endotelios y macrófagos y anti-desmina porcina clon DE R 11 (Dako(r), USA) (1: 100), para la identificación de tejido muscular. Para la detección de vimentina y desmina se aplicó el método Envision Dako(r), de acuerdo con las instrucciones del fabricante. El revelado se efectuó mediante el cromógeno di amino bencidina (DAB Kit Vector DAKO(r)) y hematoxilina como contraste. Algunas secciones se usaron como control negativo incubadas con albúmina de suero bovino (BSA) al 1%, omitiendo el anticuerpo primario. Se utilizaron como control positivo muestras de otros órganos de llama (intestino, lengua), con reactividad positiva reconocida, para convalidar la distribución específica de la marcación positiva.
Microscopía Electrónica de Transmisión
Las muestras destinadas a esta técnica se fijaron por inmersión en glutaraldehído al 4%, posteriormente en tetróxido de osmio al 1% y se embebieron en EPON 812. Los cortes ultrafinos se contrastaron con acetato de uranilo y citrato de plomo para su observación en el microscopio electrónico de transmisión (JEOL JEM 1200-EXII(r)) de la Facultad de Ciencias Veterinarias de la Universidad Nacional de La Plata, Buenos Aires, Argentina.
Nomenclatura
Las descripciones se basaron en la nomenclatura propuesta por la Nómina Histológica Veterinaria (NHV) (International Committee on Veterinary Histological Nomenclature, 2017). En el caso específico de aquellas estructuras cuya denominación anterior sea de utilización frecuente, se indicó entre paréntesis, a continuación del término propuesto por la NHV.
RESULTADOS
El parénquima hepático estuvo constituido por láminas de hepatocitos dispuestas radialmente a partir de una vena central (Figura 1). Los hepatocitos tenían forma poliédrica, con núcleos esféricos de ubicación central y nucléolos prominentes. En su citoplasma se observaron inclusiones de glucógeno mediante la técnica PAS (Figura 2). Entre las láminas de hepatocitos se ubicaron los capilares sinusoidales. Estos se observaron revestidos por células endoteliales, evidenciadas mediante inmunomarcación con vimentina. Intercalados entre las células endoteliales se identificaron macrófagos residentes (células de Kupffer), mediante inmunomarcación con vimentina (Figura 3).
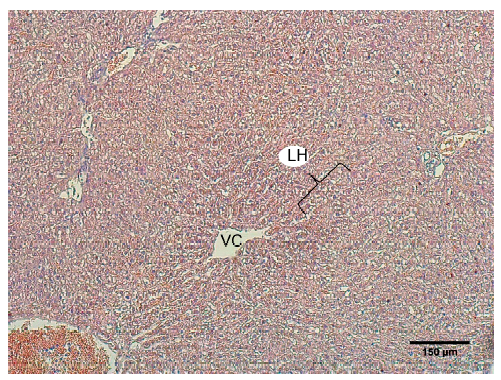
Figura 1. Lobulillo hepático de llama (Lama glama). Láminas de hepatocitos (LH), vena central (VC). H/E, x10
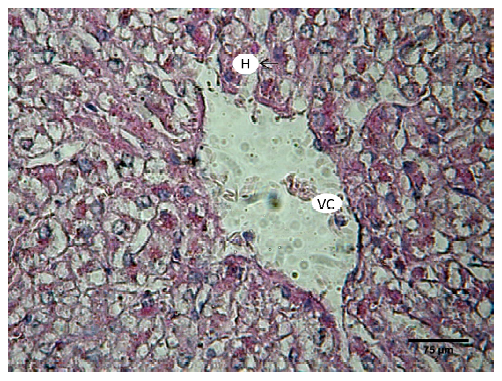
Figura 2. Parénquima hepático de llama (Lama glama). Hepatocitos con gránulos de glucógeno (H), vena central (VC). PAS, x40
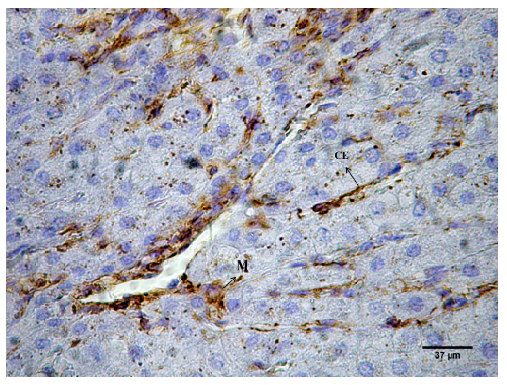
Figura 3. Capilares sinusoidales en el hígado de llama (Lama glama). Células endoteliales (CE), macrófagos residentes (M). Vimentina. x40
Las células endoteliales se caracterizaron por poseer los núcleos aplanados. Mediante microscopía electrónica de transmisión se observó que presentaban fenestraciones y la membrana basal discontinua (Figura 4).
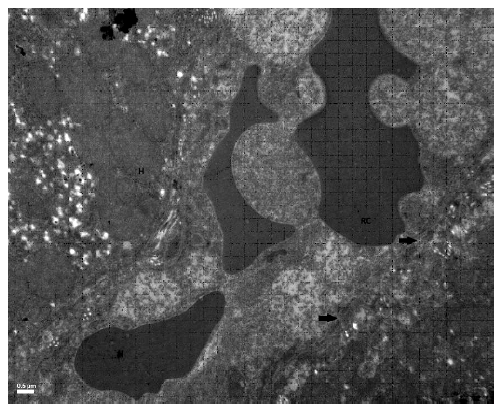
Figura 4. Ultraestructura de los capilares sinusoidales en el hígado de llama (Lama glama). Las flechas muestran las fenestraciones endoteliales. Hepatocitos (H), eritrocitos (RC). ME. x50 000
Los conductos biliares interlobulillares se observaron formados por células cilíndricas, los colangiocitos. Estos se identificaron en el canal portal, espacio de confluencia de los lobulillos, constituyendo las tríadas hepáticas juntamente con las venas interlobulillares, ramas de la vena porta, y las arteriolas interlobulillares, ramas de la arteria hepática. Además, se observaron pequeños vasos linfáticos periportales (Figura 5).
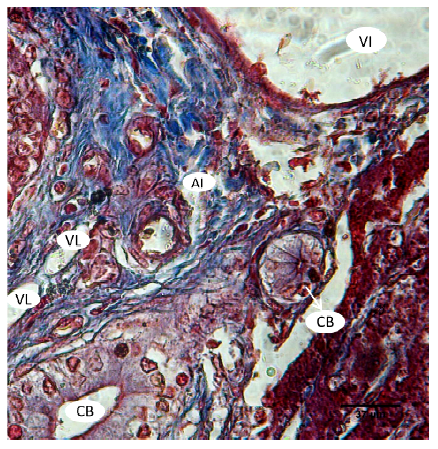
Figura 5. Canal portal en el hígado de llama (Lama glama). Conducto biliar interlobulillar (CB), vena interlobulillar (VI), arteriola interlobulillar (AI), vaso linfático periportal (VL). Tinción tricrómica de Masson. x40
En cuanto al estroma, el hígado se observó cubierto por una cápsula fibrosa de tejido conectivo denso. Esta carecía de fibras elásticas y de músculo liso (Desmina negativo) (Figura 6). No se observaron proyecciones en forma de tabiques dividiendo el parénquima. El tejido conectivo interlobulillar era extremadamente escaso, excepto en la zona del canal portal (Figura 7). El tejido conectivo intralobulillar estaba constituido por una red de fibras reticulares, que se continuaba con el tejido conectivo interlobulillar en el espacio periportal (Figura 8).
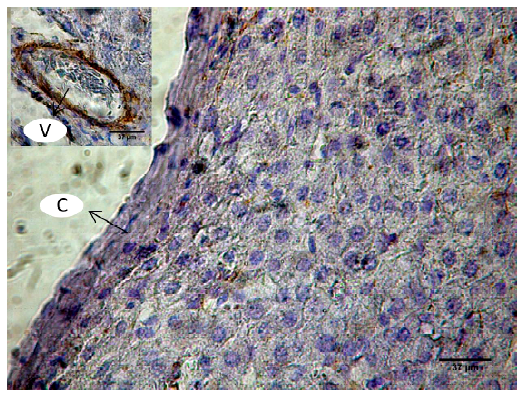
Figura 6. Cápsula fibrosa (C) del hígado de llama (Lama glama). Inserto con vaso sanguíneo como control positivo (V). Desmina. x40
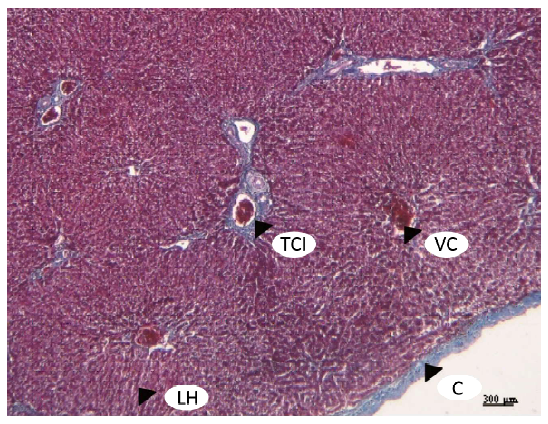
Figura 7. Estroma hepático de llama (Lama glama). Cápsula (C), tejido conectivo interlobulillar (TCI), lámina de hepatocitos (LH), vena central (VC).Tinción tricrómica de Masson. x4
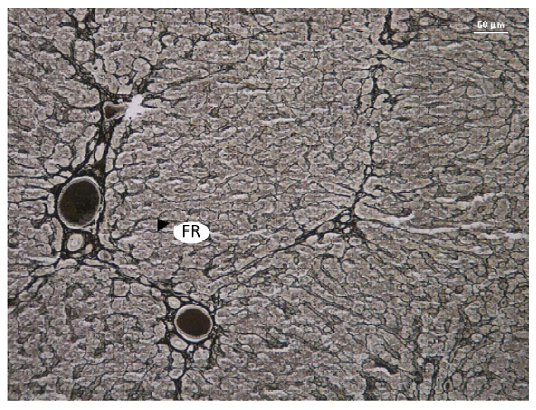
Figura 8. Estroma hepático de llama (Lama glama). Fibras reticulares (FR). Impregnación argéntica de Gomori. x20
No hubo diferencias morfológicas relacionadas con el sexo, la edad, la etapa reproductiva o el lóbulo analizado.
DISCUSIÓN
Las observaciones del parénquima hepático concuerdan con las descripciones realizadas en otros mamíferos como el ratón (Baratta et al., 2009), cobayo (Rosas et al., 2010), bisonte europeo (Bison bonasus) (Prunescu et al., 2002), cerdo y cabra (Nishimura et al., 2009).
Durante mucho tiempo se ha discutido si el revestimiento endotelial de los capilares sinusoidales hepáticos es continuo o tiene soluciones de continuidad. De acuerdo con Wood (1963), existen diferencias significativas entre especies en el grado de discontinuidad endotelial. Se ha consensuado que la pared de los capilares sinusoidales es discon-tinua en la mayoría de los mamíferos, incluido el hombre (Bloom y Fawcett, 1968). En la llama, las células endoteliales de los capilares sinusoidales mostraron fenestraciones y estaban rodeadas por una membrana basal discontinua. Esta observación es coincidente con lo descrito en el camello dromedario (Lalla y Drommer, 1997) y contrasta con lo informado en terneros (Wood, 1963), donde el revestimiento endotelial se caracteriza por presentar continuidad y poseer una membrana basal prominente. En ovejas adultas los capilares tienen un revestimiento endotelial con numerosos espacios y fenestraciones y están rodeados por una membrana basal completa, en tanto que en corderos recién nacidos tienen un endotelio relativamente grueso con menor cantidad de fenestraciones (Gemmell y Heath, 1971). Estudios realizados en ratas, indican que los capilares sinusoidales hepáticos pueden considerarse fenestrados, pero se diferencian de otras especies por la ausencia de un diafragma en las fenestraciones y por la ausencia de una membrana basal que rodea al capilar (Wisse, 1970).
El estroma hepático en los mamíferos presenta diferentes patrones de distribución. La presencia de tejido conectivo interlobulillar continuo es exclusiva de la familia Suidae (Steiner y Ratcliffe, 1968) y de los camellos del Viejo Mundo (Lalla y Drommer, 1997; Endo et al., 2000). En los mapaches, a pesar de tener abundante tejido conectivo, es discontinuo (Steiner y Ratcliffe, 1968). En la llama, el estroma del tejido conectivo no divide completamente el parénquima en lobulillos como resultado de la ausencia de tabiques de este tejido que se proyecten a partir de la cápsula. Estas observaciones son coincidentes con los resultados obtenidos en el hígado de la alpaca (Castro et al., 2016).
En otras especies, como focas y osos, las descripciones originales que indicaban la existencia de un tejido conectivo interlobulillar bien desarrollado han sido refutadas por otros estudios (Stewardson et al., 1999; Prunescu et al., 2003). La diferencia encontrada entre especies altamente emparentadas, como los camélidos del Viejo Mundo y los sudamericanos, se opone a las descripciones de la familia Suidae, en la que todos sus miembros tienen tejido conectivo interlobulillar y que está ausente en otras familias relacionadas, como Tayassuidae e Hippopotamidae (Steiner y Ratcliffe, 1968).
Las diferencias en el hígado de especies del género Camelus y Lama demuestran la necesidad de realizar estudios de órganos normales en todas las especies y destaca la importancia de no generalizar a partir de otras especies de la misma familia. La escasa presencia de tejido conectivo en el hígado de los camélidos sudamericanos puede tener implicancias en la patología hepática. Esto puede estar relacionado, por ejemplo, con la mayor susceptibilidad que presentan a la fasciolasis hepática (Leguía, 1991).












 uBio
uBio 


