INTRODUCCIÓN
La actividad antrópica viene impactando los ambientes marinos con desechos de contaminantes como agentes físicos y químicos (Ragagnin y Turra, 2022), agentes que afectan las condiciones ambientales y a los seres vivos ocasionando efectos nocivos en la salud, fecundidad y supervivencia (Stickle y Zhang, 2003; França et al., 2021). El efecto de un contaminante en un ser vivo puede ser perjudicial para su vida, más aún si el número de contaminantes aumenta (Caja-Molina y Iannacone, 2021; Dellafredad & Iannacone, 2021; Ragagnin y Turra, 2022).
Las pinturas anti-incrustantes aún son de uso común en las embarcaciones de los pescadores artesanales (França et al., 2021). Algunas de estas tintas contienen aditivos, como el compuesto organoestañoso (TBT, por sus siglas en inglés), el cual permanece en el ambiente marino y está asociado a la ocurrencia del fenómeno de imposex (IMP) en las hembras de caracoles (Otegui et al., 2019), causando su masculinización (Mensink et al., 2002; Rivas et al., 2017; Castro et al., 2018; Ragagnin y Turra, 2022), afectando la fertilidad y, por lo tanto, reduciendo considerablemente la densidad poblacional, llegando incluso a la desaparición de estas a nivel local, al afectar el equilibrio del ecosistema marino (Enrique et al., 2019; França et al., 2021; Gomes et al., 2021a,b).
El IMP fue inicialmente conceptualizado por Smith (1971) y estudiado en cuatro continentes (Titley-O'Neal et al., 2011); sin embargo, las investigaciones se concentran en países europeos y en Estados Unidos (Titley O'Neal et al., 2011), con resultados de hasta 100% de ocurrencia en zonas de impacto directo de puertos. En Sudamérica, Brasil es el país con mayor número de investigaciones asociadas al IMP (Castro et al., 2012; França et al., 2021), mientras que en Perú se han hecho estudios en los puestos del Callao en Thaisella chocolata y Xanthochorus buxeus (Castro y Fillman, 2012; Castro et al., 2018; Enrique et al., 2019); Chimbote en T. chocolata (Castro y Fillman, 2012); Paracas en T. chocolata (Chumbimune y Ponce, 2015); Pucusana en Stramonita haemastoma y Crassilabrum crassilabrum (Guabloche et al., 2017; Rivas et al., 2017), Ancón en X. buxeus y C. crassilabrum (Guabloche et al., 2013; Rivas et al., 2017), Paita en T. chocolata (Villegas et al., 2021) y en Matarani-Arequipa en T. chocolata (Luna-Pacompea et al., 2022).
A la fecha, pocos estudios analizan el efecto del IMP en caracoles marinos en forma interanual. Una evaluación temporal del IMP entre 2007 al 2018 en Brasil en Stramonita brasiliensis reportó que los índices de IMP fluctuaron entre 0 a 100%, el índice de secuencia de deferencia de vaso (VDSI) de 0 a 4.11 y el índice de longitud relativa del pene (RPLI) de 0 a 51 (França et al., 2021). El IMP en Nucella lapillus fue monitoreado en Portugal para evaluar la evolución de la contaminación por compuestos organoestañicos (OT) después de la prohibición de la Unión Europea de las pinturas antiincrustantes basadas en OT, donde, si bien se produjo una rápida disminución del IMP, entre 2018-2019 se observó un ligero aumento del IMP en algunas localidades (Gomes et al., 2021a). Asimismo, el IMP fue evaluado en Gemophos viverratus alrededor de la isla de São Vicente -Cabo Verde, encontrando que el índice de VDSI, la RPLI, el porcentaje de las hembras con IMP (%I) y el porcentaje de hembras esterilizadas en 2019 oscilaron entre 0 y 4.0, entre 0 y 84.4%, entre 0 y 100 % y entre 0 y 5.1%, respectivamente, siendo los valores similares a los de 2012 (Gomes et al., 2021b).
La persistencia del IMP en los ambientes acuáticos puede conducir a riesgos serios para la salud de la biota marina, en especial en la reproducción de los caracoles marinos de la familia Muricidae y los organismos que lo habitan (Ribeiro-Brasil et al., 2021; Viana et al., 2021). El poblador peruano está expuesto a la contaminación de estaño al consumir los caracoles marinos con IMP en platillos culinarios de mucha demanda. Varios estudios describen los niveles de compuestos orgánicos de estaño en los alimentos marinos y abordan los riesgos de su consumo hacia los seres humanos (Chamorro-García et al., 2021; Jiang et al., 2021). La normativa evidencia que siguen siendo escasos los estudios disponibles sobre el tema, haciendo que no existan leyes específicas en el Perú que regulen el uso de los OT en el ambiente marino (Batista et al., 2016; Gerres et al., 2021; Gomes et al., 2021a; Uc-Peraza et al., 2022).
Con relación a la evaluación del riesgo ambiental asociado a TBT, el Convenio para la Protección Ambiental del Atlántico Nordeste (OSPAR, 2008), estableció un estándar de monitoreo específico para N. lapillus, Nassarius reticulatus y Neptunea antiqua (Martínez-Llado et al., 2007; Maciel et al., 2018; Gomes et al., 2021a,b).Al respecto, se pensaba que los puertos internacionales y de alto tráfico marino de grandes embarcaciones eran la fuente principal de contaminación por TBT; sin embargo, se ha encontrado que los puertos artesanales tendrían un aporte importante de OT, ocasionando altos niveles de IMP (Enrique et al., 2019; França et al., 2021). De otro lado, si bien el indicador principal de contaminación por OT en el medio marino es el IMP (Bennett, 1996; Guabloche et al., 2017; Enrique et al., 2019; França et al., 2021), los gasterópodos no son los únicos organismos expuestos a un riesgo ambiental por estos químicos residuales en el mar (Primost et al., 2021), pues se han detectado restos de TBT en tejidos de mamíferos marinos como ballenas, delfines, focas y en otros organismos de alta mar (Bandara et al., 2021).
El Perú no cuenta con información sobre la variación interanual del estado del IMP en el caracol marino T. chocolata (Muricidae). Por eso, surgen la siguiente pregunta de investigación: ¿Cuál es la variación interanual del IMP para los años 2013 al 2106 en el caracol marino T. chocolata en la costa central del Perú? El objetivo del presente estudio fue caracterizar la variación interanual del IMP en el caracol marino T. chocolata en la costa central del Perú.
MATERIALES Y MÉTODOS
Muestreos
Se obtuvieron ejemplares adultos (conchilla entre 40 y 70 mm) de T. chocolata procedentes de varias localidades del departamento de Lima y del Callao, Perú (Castro y Fillmann, 2012), recolectados mediante buceo por compresión a una profundidad entre los 60 cm y 20 m, y a una distancia de la orilla de hasta 250 m. Se trabajó como unidad de análisis con 1188 especímenes, los cuales se depositaron en formalina al 10% en la colección biológica del Museo de Historia Natural de la Facultad de Ciencias Naturales y Matemática de la Universidad Nacional Federico Villarreal (MHN-UNFV), según lo señalado en el Cuadro 1.
Cuadro 1. Ámbito espacial y temporal según año, mes, localidad, región y número de caracoles marinos Thaisella chocolata (Muricidae) registrados en la colección biológica del Museo de Historia Natural de la Facultad de Ciencias Naturales y Matemática de la Universidad Nacional Federico Villarreal (MHN-UNFV)
| Data | Año | Mes | Localidad | Región | Coordenadas | Caracoles (n) |
|---|---|---|---|---|---|---|
| 1 | 2013 | Junio | Chorrillos | Lima | 12°9'58"LS 77°1'46"LO | 78 |
| 2 | 2013 | Junio | Chorrillos | Lima | 12°9'58"LS 77°1'46"LO | 123 |
| 3 | 2013 | Junio | Chorrillos | Lima | 12°9'58"LS 77°1'46"LO | 40 |
| 3 | 2014 | Noviembre | Chorrillos | Lima | 12°9'58"LS 77°1'46"LO | 106 |
| 4 | 2014 | Junio | San Bartolo | Lima | 12°23'22'' LS 76°46'49'' LO | 105 |
| 5 | 2014 | Junio | Pucusana | Lima | 12°28'54'' L 76°47'51'' LO | 100 |
| 6 | 2015 | Mayo | La Punta | Callao | 12°4′22″ LS 77°9′48″ LO | 55 |
| 7 | 2015 | Mayo | San Bartolo | Lima | 12°23'22'' LS 76°46'49'' LO | 53 |
| 8 | 2016 | Junio | Pucusana | Lima | 12°28'54'' L 76°47'51'' LO | 85 |
| 9 | 2016 | Junio | Chorrillos | Lima | 12°9'58"LS 77°1'46"LO | 54 |
| 10 | 2016 | Junio | Chorrillos | Lima | 12°9'58"LS 77°1'46"LO | 55 |
| 11 | 2016 | Junio | Callao | Callao | 12°02′49″S 77°08′34″O | 90 |
| 12 | 2016 | Junio | Agua dulce | Lima | 12°9'45"LS 77°1'38"LO | 60 |
| 13 | 2016 | Junio | Chorrillos | Lima | 12°9'58"LS 77°1'46"LO | 61 |
| 14 | 2016 | Junio | Isla San | Callao | 12°4'60" LS 77°15'0" LO | 62 |
| Lorenzo | ||||||
| 15 | 2016 | Junio | Callao | Callao | 12°02′49″S 77°08′34″O | 60 |
| Total | 1,188 |
Procedimiento
Los moluscos fueron anestesiados con una disolución de cloruro de magnesio (3.5%) por 1 hora de exposición (Castro y Fillman, 2012). La longitud de la conchilla del molusco (LC) se midió empleando un instrumental tipo vernier (±0.01 mm de grado de precisión) desde el ápex hasta la base del molusco. La identificación sexual se efectuó usando un estereoscopio y fue sustentado por presentar o tener ausente la glándula de la cápsula y los ovarios en los caracoles femeninos, y testículos y la presencia de la vesícula seminal para los moluscos masculinos (Collado et al., 2010). Se registró el tamaño del pene (LP) y la ocurrencia del vaso deferente para los moluscos machos y para las hembras con IMP. La catalogación del IMP se evaluó con base a los siguientes indicadores: IMP en las hembras (I%), índices de LP (longitud promedio del pene) en hembras (FPL, por sus siglas en inglés), el RPLI ([longitud promedio del pene de hembras / longitud promedio del pene de machos]*100) y el Índice del tamaño relativo del pene (RPSI) (Castro y Fillman, 2012; Castro et al., 2018; Monteiro-Rodrigues et al., 2020):
El IMP fue caracterizado en cuatro niveles: ausente (% de IMP = cero), bajo (% de IMP = 0.1 a 33%), medio (% de IMP = 33.1 a 66) y alto (% de IMP = 66.1 a 100%) (Luna-Pacompea et al., 2022; Ragagnin y Turra, 2022).Además, para minimizar el efecto del tamaño en los parámetros de IMP, FPL y RPLI se estandarizaron con la longitud de la conchilla (Castro y Fillmann, 2012):
FLP estándar = FPL / LC de las hembras
RPLI estándar = LP en hembras o machos / LC en hembras o machos) * 100
Asimismo, se determinó el índice de severidad del IMP en base a la escala de seis niveles del VDSI, que proporciona una indicación del impacto reproductivo de la población de caracoles. El VDSI fue evaluado en función a los estadios propuestos por Terlizzi et al. (1999):
Estadio 1: Desarrollo de una pequeña sección de vasos deferentes en la región ventral.
Estadio 2: Desarrollo inicial del pene, pequeña formación de una cresta a una corta distancia.
Estadio 3: Formación de pene pequeño y desarrollo de vasos deferentes iniciando desde la base del pene.
Estadio 4: Alargamiento del pene, cercano al de un macho.
Estadio 5: Tejidos de vasos deferentes creciendo sobre el área genital, causando desplazamiento de la vulva.
Estadio 6: En la glándula capsular se encuentra material de cápsulas abortadas que, en caso de estar acopladas, se puede observar una masa traslúcida o marrón (claro u oscuro).
Análisis de Datos
La normalidad y la homogeneidad de los datos (LC, LP, e índices de IMP) se verificaron con el uso de pruebas de Shapiro-Wilks y Levene, respectivamente. Para verificar si LP se ve afectada por LC en T. chocolata se realizó una gráfica de la regresión lineal múltiple entre estos parámetros para las hembras y los machos. Se utilizó el análisis de correlación de Pearson para determinar la relación de los parámetros de IMP (RPLI, RPSI y VDSI) entre los cuatro años examinados (2013 al 2016). Todos los análisis estadísticos se realizaron con el programa estadístico SPPS v. 28.00, con un nivel de p<0.05.
Aspectos Éticos
Los investigadores indican que aplicaron todas las normativas peruanas e internacionales respecto a las autorizaciones, normas de bioseguridad y descarte de sustancias de naturaleza química y biológica. Los caracoles no son incluidos como restos no peligrosos; por lo tanto, su disposición final consideró el Decreto Supremo N° 014-2017 Art. 43 del Ministerio del Ambiente. Los moluscos fueron adquiridos de los pescadores en cada ámbito geográfico por lo que no se necesitaron permisos específicos. En el laboratorio se siguió lo señalado en la guía para la gestión y eliminación de residuos del Laboratorio de Ecología y biodiversidad Animal (LEBA) de la UNFV. Ejemplares representativos de T. chocolata fueron depositados en la colección biológica del Museo de Historia Natural de UNFV.
RESULTADOS
En la muestra de 1188 especímenes, la LC fue de mayor tamaño en las hembras (Cuadro 2). Asimismo, al evaluar los cuatro años de datos solo se encontró diferencias significativas en 2015, siendo los machos de mayor tamaño que las hembras, en tanto que, con relación a la localidad, solo hubo diferencias significativas para Pucusana, presentando las hembras de T. chocolata un mayor tamaño con base a la LC en comparación a los machos (Cuadro 2).
Cuadro 2. Variaciones temporales entre el 2013 al 2016 y espaciales en Lima y Callao para la longitud de la conchilla (LC) de Thaisella chocolata
| LC | Macho | Hembra | t | p |
|---|---|---|---|---|
| Año | ||||
| 2013 | 53.06 | 51.10 | 0.81 | 0.41 |
| 2014 | 58.12 | 59.18 | 1.36 | 0.17 |
| 2015 | 57.36 | 53.04 | 33.80 | 0.001 |
| 2016 | 51.17 | 51.76 | 13.82 | 0.16 |
| Localidad | ||||
| Pucusana | 52.44 | 56.63 | 44.04 | 0.001 |
| San Bartolo | 59.56 | 61.33 | 18.79 | 0.06 |
| Chorrillos | 53.13 | 53.70 | 0.86 | 0.38 |
| Agua Dulce | 51.33 | 51.41 | 0.10 | 0.91 |
| Callao | 51.21 | 50.44 | 10.29 | 0.30 |
| La Punta | 50.90 | 51.50 | 0.42 | 0.67 |
| I. San Lorenzo | 50.14 | 52.38 | 13.24 | 0.19 |
| Global | 53.45 | 54.38 | 22.75 | 0.02 |
t = Estadístico de t de Student. p = probabilidad. Valores en negrita indican diferencias significativas (p<0.05)
En la evaluación de la LP de T. choco-lata se observaron oscilaciones significativas, siendo la LP mayor en las hembras en 2013, y mayor en los machos en 2015 y 2016 (Cuadro 3). Asimismo, la LP fue mayor en las localidades de San Bartolo, Callao, La Punta e Isla San Lorenzo, con relación a las hembras (Cuadro 3).
Cuadro 3. Variaciones temporales entre 2013 al 2016 y espaciales en Lima y Callao para la longitud del pene (LP) de Thaisella chocolata
| LP | Macho | Hembra | t | p |
|---|---|---|---|---|
| Año | ||||
| 2013 | 9.45 | 11.72 | 1.99 | 0.04 |
| 2014 | 11.75 | 10.18 | 1.32 | 0.18 |
| 2015 | 8.69 | 6.66 | 2.39 | 0.02 |
| 2016 | 10.99 | 3.81 | 11.72 | 0.0001 |
| Localidad | ||||
| Pucusana | 10.74 | 10.14 | 0.65 | 0.51 |
| San Bartolo | 9.92 | 7.03 | 2.48 | 0.01 |
| Chorrillos | 10.21 | 9.93 | 0.33 | 0.73 |
| Agua Dulce | 11.77 | 7.14 | 1.29 | 0.25 |
| Callao | 11.66 | 1.75 | 15.05 | 0.0001 |
| La Punta | 10.41 | 6.24 | 5.07 | 0.0001 |
| I. San Lorenzo | 10.46 | 6.66 | 2.36 | 0.03 |
| Global | 10.61 | 9.01 | 3.38 | 0.0007 |
t = Estadístico de t de Student. p = probabilidad. Valores en negrita indican diferencias significativas (p<0.05)
El Cuadro 4 muestra las variaciones de los parámetros de IMP e índices de severidad de T. chocolata entre los años 2013 al 2016, así como las variaciones espaciales. Se observó un % global de IMP de 36.39 (medio), y una tendencia a la disminución del 2013 (alto) al 2016 (bajo) del % IMP, RPLI, RPSI y VDSI. El %IMP varió entre 58.8% (bajo) hasta 52.10% (medio), según la localidad. De igual manera, el índice de severidad con base al RPLI y RPSI presentaron la siguiente secuencia en orden descendente: Chorrillos > Pucusana > San Bartolo > Isla San Lorenzo > Agua Dulce > La Punta > Callao, en tanto que para el VDSI fue de: Pucusana > La Punta = San Bartolo = Isla San Lorenzo > Chorrillos > Agua Dulce > Callao.
Cuadro 4. Variaciones temporales y espaciales entre 2013 a 2016 del monitoreo biológico de los parámetros de Imposex (IMP) en hembras e índices de severidad de Thaisella chocolata
| Año | n | Macho | Hembra | Nº IMP | % IMP | RPLI | RPSI | VDSI |
|---|---|---|---|---|---|---|---|---|
| Año | ||||||||
| 2013 | 241 | 84 | 157 | 110 | 70.06 | 123.92 | 190.29 | 3.16 |
| 2014 | 311 | 92 | 219 | 54 | 24.66 | 86.68 | 65.13 | 3.19 |
| 2015 | 108 | 64 | 44 | 15 | 34.09 | 76.72 | 45.17 | 3.00 |
| 2016 | 528 | 283 | 245 | 63 | 25.71 | 29.32 | 4.17 | 2.13 |
| Localidad | ||||||||
| Pucusana | 185 | 78 | 107 | 25 | 23.36 | 94.46 | 84.29 | 3.48 |
| San Bartolo | 158 | 91 | 67 | 8 | 11.94 | 70.93 | 35.68 | 3.00 |
| Chorrillos | 517 | 183 | 334 | 174 | 52.10 | 97.31 | 92.14 | 2.96 |
| Agua Dulce | 61 | 26 | 35 | 7 | 20.00 | 60.69 | 22.35 | 2.86 |
| Callao | 150 | 97 | 53 | 19 | 35.85 | 15.02 | 0.34 | 1.37 |
| La Punta | 55 | 20 | 35 | 7 | 20.00 | 59.97 | 21.57 | 3.00 |
| I. San Lorenzo | 62 | 28 | 34 | 2 | 5.88 | 62.12 | 23.97 | 3.00 |
| Global | 1188 | 523 | 665 | 242 | 36.39 | 84.88 | 61.14 | 2.89 |
RPLI = Índice de longitud relativo del pene; RPSI= Índice del tamaño relativo del pene; VDSI = Índice de Secuencia del Vaso Deferente.
El Cuadro 5 evidencia una correlación negativa entre los años y la LP de hembras, y entre los años con el RPLI de T. chocolata. La Figura 1 muestra las gráficas de relación entre la LC y LP de hembras y machos para el monitoreo biológico de 2013 a 2016 en la región de Lima y Callao. En ambos casos las ecuaciones de regresión lineal generadas no fueron significativas y presentaron un bajo coeficiente de determinación.
Cuadro 5. Matriz de correlación de Pearson (rp)i (parte inferior) y nivel de significancia (parte superior) para el monitoreo biológico de los años de evaluación, parámetros de Imposex (IMP) e índices de severidad de Thaisella chocolata
| Año | LC hembras | LC machos | LP machos | LP hembras | % IMP | RPLI | RPSI | VDSI | |
|---|---|---|---|---|---|---|---|---|---|
| Año | 0.85 | 0.75 | 0.85 | 0.01 | 0.25 | 0.02 | 0.06 | 0.15 | |
| LC hembras | -0.14 | 0.24 | 0.36 | 0.71 | 0.45 | 0.94 | 0.77 | 0.57 | |
| LC machos | -0.24 | 0.75 | 0.97 | 0.65 | 0.69 | 0.68 | 0.93 | 0.28 | |
| LP machos | 0.14 | 0.63 | -0.02 | 0.95 | 0.45 | 0.64 | 0.66 | 0.76 | |
| LP hembras | -0.98 | 0.28 | 0.34 | -0.04 | 0.35 | 0.04 | 0.13 | 0.11 | |
| % IMP | -0.74 | -0.54 | -0.30 | -0.54 | 0.64 | 0.21 | 0.06 | 0.57 | |
| RPLI | -0.97 | 0.05 | 0.31 | -0.35 | 0.95 | 0.78 | 0.07 | 0.11 | |
| RPSI | -0.93 | -0.22 | -0.06 | -0.33 | 0.86 | 0.93 | 0.92 | 0.34 | |
| VDSI | -0.84 | 0.42 | 0.71 | -0.23 | 0.88 | 0.42 | 0.88 | 0.65 |
LC = longitud de la conchilla; LP = Longitud del pene; RPLI = Índice de longitud relativo del pene; RPSI= Índice del tamaño relativo del pene; VDSI = Índice de secuencia del vaso deferente
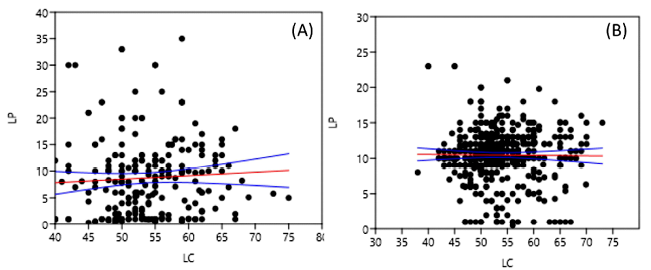
(A) Ecuación de regresión: y(LP)= 0.06+51.36x(LC), Coeficiente de determinación: r2= 0.003, p=0.35
(B) Ecuación de regresión: y(LP)= -0.006+10.80x(LC), Coeficiente de determinación: r2= 0.0001, p=0.80
Figura 1. Gráfica de relación entre la LC y LP de las hembras (A) y machos (B) de Thaisella chocolata para el monitoreo biológico de los años 2013 a 2016 en la región de Lima y Callao, Perú. La línea media representa la regresión lineal de las variables y las líneas laterales los límites de confianza al 95%
DISCUSIÓN
En el presente trabajo se encontraron oscilaciones en el IMP y en los índices de severidad del caracol T. chocolata entre 2013 (alto) a 2016 (bajo) en 1188 especímenes. Se observó un porcentaje global de IMP de 36.39 (medio), con una variación entre 5.88% (bajo) hasta 52.10% (medio). Los valores globales de los índices de severidad RPLI, RPSI y VDSI fueron 84.88, 61.14 y 2.89, respectivamente. Este fenotipo denominado IMP, definido como la presencia de órganos sexuales masculinos no funcionales se desarrolla en los caracoles hembras de T. chocolata (Luna-Pacompea et al., 2022). Esta condición fenológica atípica es irreversible, lo que conduce a una reproducción deficiente, proporciones sexuales sesgadas, disminución de la fertilidad y finalmente riesgo de disminución concomitante en la diversidad de especies y poblaciones en el ambiente acuático (Marlatt et al., 2022). La literatura científica evidencia que las hembras jóvenes de varias especies de caracoles marinos son extremadamente sensibles a desarrollar IMP cuando se exponen a concentraciones de TBT a partir de 1 ng·L-1 en agua de mar, pudiéndose tornarse infértiles a concentraciones de 3-5 ng·L-1 (Beyer et al., 2022). Los resultados sugieren que se empleó el TBT en las pinturas anti-incrustantes en las localidades evaluadas en el periodo del estudio.
Los efectos adversos del disruptor endocrino TBT como el IMP en caracoles marinos están disminuyendo a nivel mundial (Fernandez, 2019; Beyer et al., 2022), tal como fue observado en el presente estudio para %IMP, RPLI, RPSI y VDSI de T. chocolata. Este patrón se debe al compromiso global de eliminar gradualmente las pinturas marinas basadas en TBT. La documentación de muchas encuestas de campo y programas de monitoreo sugiere que la prohibición de las pinturas anti-incrustantes con base al TBT ha sido en gran medida efectiva (Lahbib et al., 2018; Lee et al., 2022), aunque algunas empresas siguen produciendo y vendiendo estas pinturas (Beyer et al., 2022), lo que sugiere una recuperación ambiental del ecosistema marino (Slama et al., 2022).
Se observaron diferencias en la LC para la localidad de Pucusana y en 2015 donde los machos presentaron un mayor tamaño. En este aspecto, si bien la literatura señala que la estructura de población actual con base a la LC refleja la combinación de corrientes oceanográficas, rasgos de historia de vida y eventos históricos, el estudio de Zelada-Mázmela et al. (2022) respalda la existencia de una sola población de T. chocolata genéticamente homogénea entre Bayovar (Piura) y Marcona (Ica) en el Perú, lo que incluye el área de estudio de la presente investigación, conciliando los criterios biológicos con base a la LC y el manejo para este molusco.
Se ha notado diferencias significativas entre los años 2013, 2015 y 2016 con relación a la LP. Para el 2013, La LP fue mayor en las hembras en 2013, pero en 2015 y 2016 fue mayor en los machos. Se dispone de escasa información sobre el impacto del tamaño de la LP y del IMP en caracoles marinos a través de los años. França et al. (2021) observó en su estudio de 12 años de evaluación en el caracol marino S. brasiliensis oscilaciones en el IMP, el VDSI y el RPLI; asimismo, Gomes et al. (2021a) encontraron una rápida disminución del IMP en el caracol marino N. lapillus en dos años, después de la prohibición de la Unión Europea de las pinturas anti-incrustantes basados en OT. Además, Gomes et al. (2021b) determinaron oscilaciones en datos de 2012 y 2019 sobre el VDSI, RPLI y el porcentaje de hembras con IMP.
Uno de los parámetros más importantes en el IMP es la medida del pene del caracol, lo cual permitió determinar el RPLI y el RPSI. El pene es un órgano muscular y, por lo tanto, sujeto a contracción con estimulación táctil (Vasconcelos et al., 2011). Si bien la manipulación extendida, la anestesia, el preservante químico usado, la congelación y descongelación pueden alterar las mediciones del pene (Vasconcelos et al., 2011), se tiene evidencia de que la formalina no afecta significativamente estas mediciones. Así, se tienen estudios del IMP con material fijado en caracoles murícidos como Hexaplex trunculus (Terlizzi et al., 1999); H. trunculus, Bolinus brandaris y Thais haemastoma (Chiavarini et al., 2003); Cantharus cecillei (Shi et al., 2005); Mauritia arabica (Huang et al., 2008), y Nassarius reticulatus (Sousa et al., 2009), entre otros.
Las variaciones espaciales para el IMP, RPLI, RPSI y VDSI entre las localidades muestreadas se encuentran directamente relacionadas con el tráfico de las embarcaciones y la actividad antrópica como turismo, pesquería comercial y artesanal (Ragagnin y Turra, 2022). Asimismo, se ha sugerido que los barcos de pesca artesanal y de turismo, como los observados en Chorrillos, Pucusana, San Bartolo, Isla San Lorenzo y Agua Dulce son potencialmente las mayores y progresivas fuentes de TBT al mar, y por ende causantes del IMP (Villegas et al., 2021).
CONCLUSIONES
El porcentaje global de Imposex (IMP) en las hembras fue de 36.39% con variaciones entre localidades de 5.88 hasta 52.10%.
Se observó una tendencia a la disminución entre 2013 a 2016 del %IMP y del Índice relativo de longitud del pene (RPLI), el Índice del tamaño relativo del pene (RPSI) y el Índice de Secuencia del Vaso Deferente (VDSI).
Los índices de severidad con base al RPLI y RPSI según localidades presentaron la siguiente secuencia: Chorrillos > Pucusana > San Bartolo > Isla San Lorenzo > Agua Dulce > La Punta > Callao., en tanto que para el VDSI fue de: Pucusana > La Punta = San Bartolo = Isla San Lorenzo > Chorrillos > Agua Dulce > Callao.
Se evidenció una reducción de la LP de hembras y del RPLI de T. chocolata entre los años de evaluación.












 uBio
uBio 


