INTRODUCCIÓN
La elevada producción global de plástico en las últimas décadas alcanzó los 368 millones de toneladas métricas en 2019, lo que sumado a su inadecuada gestión una vez que han sido desechados, ha conllevado a que más de 36 millones de toneladas ingresen al ambiente marino cada año (Besley et al., 2017; Mazariegos-Ortíz et al., 2020), convirtiéndose en uno de los más importantes contaminantes que amenaza a la biota (Xu et al., 2020a; Iannacone et al., 2021); preocupación que no solo se ha hecho presente entre la comunidad científica, sino también entre el público en general (De la Torre et al. 2020a,b). Esto a causa de su persistencia, a su potencial toxicidad inherente y a su propensión a atraer otros contaminantes hacia su superficie (Li et al., 2016; De la Torre, 2019; Paredes-Osses et al., 2021; Iannacone et al., 2022).
Entre los desechos plásticos, los microplásticos (MP) son los que concentran la atención de los investigadores debido a su tamaño y ubicuidad (Ogonowski et al., 2018). Los MP tiene un tamaño menor a 5 mm (Paredes-Osses et al., 2021). Estos, según su origen, pueden ser clasificados en primarios si han sido intencionalmente fabricados de tamaño pequeño (como las microesferas, empleadas en productos cosméticos y de limpieza facial o los pellets, empleados en la manufactura de plásticos) o secundarios, cuando a partir de plásticos de gran tamaño, por la acción de las corrientes, la radiación UV, las propiedades oxidativas de la atmosfera, y las hidrolíticas del agua, los han fraccionado hasta convertirlos en pequeñas partículas (Morais et al., 2020; Zhang et al., 2020). El reducido tamaño los convierte en uno de los principales riesgos ambientales, debido a que incrementan su biodisponibilidad para los organismos de ambientes marinos o de agua dulce (Cheung et al., 2016; Qu et al., 2018; Eo et al., 2019; De la Torre, 2020).
Las playas arenosas alrededor del mundo constituyen lugares de depósito natural de sedimentos, por lo que acumulan MPs (Torrez-Pérez et al., 2021), exponiendo a su abundante fauna a un alto riesgo de captación de estos (Brazeiro, 2005; Horn et al., 2020; Xu et al., 2020a,b). La ingesta constituye la forma de captación más frecuente de MP (Waddell et al., 2020). El consumo de MP, ha sido registrado en una gran variedad de especies en los ecosistemas marinos (Rochman et al., 2015; Bour et al., 2018; Mazariegos-Ortíz et al., 2020; Iannacone et al., 2021).
En las playas arenosas de la costa central del Perú se han encontrado entre 4.7 y 489.7 partículas de MP por metro cuadrado de sedimento (Purca e Henostroza, 2017; Iannacone et al., 2019; De la Torre et al., 2020b; Pretell et al., 2020; Zarate y Iannacone, 2021). De la Torre et al. (2019) presentaron el primer registro de presencia de MP en peces comerciales de la costa de Lima, Perú. Un año después se daría a conocer que los MP también eran captados por moluscos de importancia económica, llegándose a encontrar entre 1.5 y 11.48 MP por individuo aproximadamente (De la Torre et al., 2020a; Valencia et al., 2020). Una investigación reciente en el cangrejo peludo Romaleon setosum reportó en el tracto digestivo una abundancia promedio de 7.93 MP por individuo (Iannacone et al., 2022).
Hoy se conoce que el cambio en las temporadas estacionales trae consigo oscilaciones en las abundancias y características de los MP de determinado ambiente (Cheung et al., 2016; Chen y Chen, 2020; Gao et al., 2021). Estudios realizados en una sola temporada han generado valores promedio de abundancias sub-o sobreestimados, evidenciando la necesidad de considerar varias temporadas para producir estimaciones más realistas y representativas (Cheung et al., 2016). De la misma manera, las actividades desarrolladas por la población cercana, las medidas para la gestión de residuos, y la presencia de un punto de descarga de efluentes, entre otros, pueden alterar estas variables (Zhou et al., 2020).
Las playas arenosas en la zona intermareal suelen presentar una mayor cantidad de MP (Mazariegos-Ortíz et al., 2020; Astorga-Pérez et al., 2022), afectando principalmente a los organismos que se alimentan por filtración en la columna de agua o directamente del sedimento (Horn et al., 2019, 2020; Mohsen et al., 2021). Uno de los organismos más abundantes es Emerita analoga, conocido comúnmente como "muy muy". Este constituye uno de los eslabones más importantes en la cadena trófica de la zona intermareal arenosa peruana (Iannacone et al., 2007; Torres et al., 2020), debido a que de esta especie sirve de alimento a las aves marinas y peces de importancia económica. Esta característica, sumadas a su capacidad de respuesta ante alteraciones en su medio, le han permitido ser exitosamente empleado como bioindicador de diversos contaminantes (Huaraca et al., 2020; Torres et al., 2020).
Por este motivo, en este trabajo se evalúa la variación temporal y espacial en la ocurrencia, abundancia y distribución de los MP en E. analoga y los sedimentos de ocho playas localizadas al norte y sur de Lima, Perú.
MATERIALES Y MÉTODOS
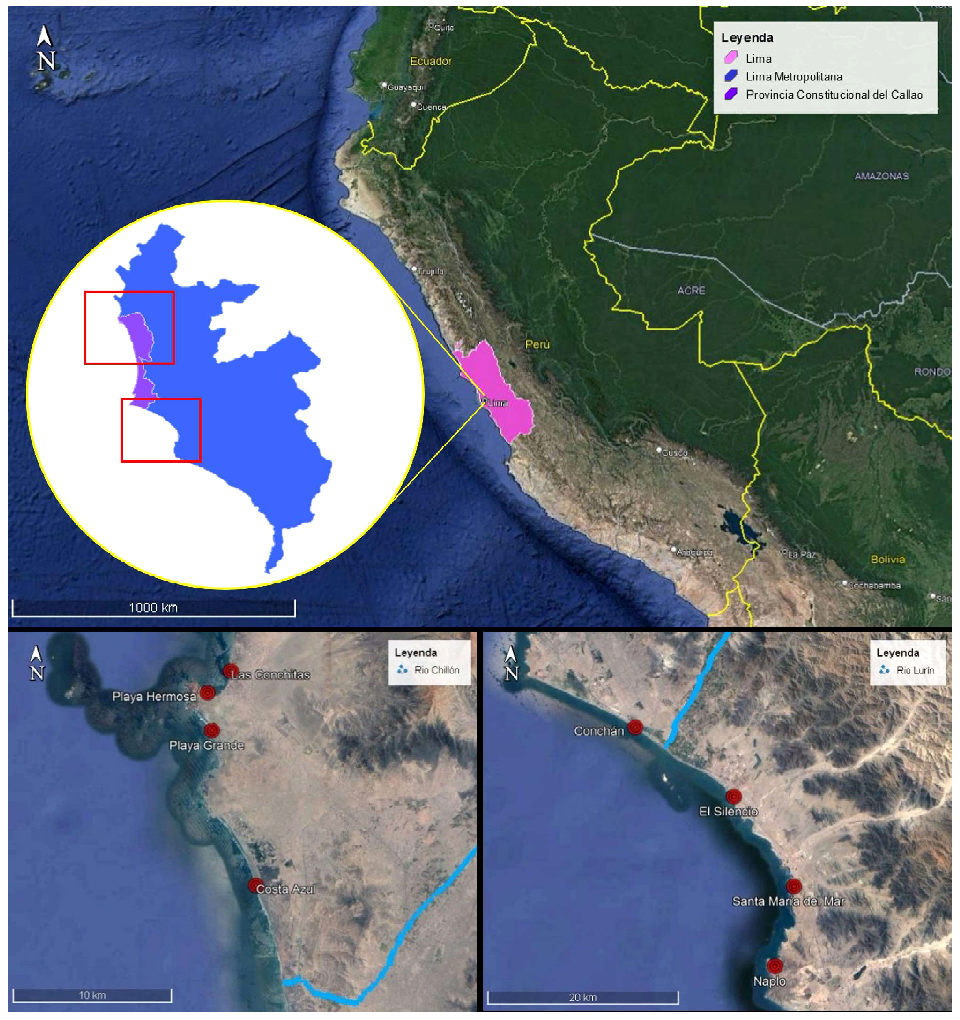
Las muestras de E. analoga y de sedimento fueron colectadas en dos temporadas, en invierno de 2019 y en verano de 2020, en ocho playas arenosas distribuidas tanto en la zona norte (Las Conchitas, Playa Hermosa, Playa Grande y Costa Azul) como en la zona sur (Conchán, El Silencio, Santa María del Mar y Naplo) de Lima (Figura 1; Cuadro 1). En cada playa se colectaron manualmente, al azar y en ambas temporadas, 30 E. analoga de la zona intermareal. Los especímenes fueron colocados en bolsas de papel aluminio y transportados en frío hasta el laboratorio, donde fueron congelados hasta su análisis.
Cuadro1. Características de las ocho playas estudiadas en el departamento de Lima, Perú
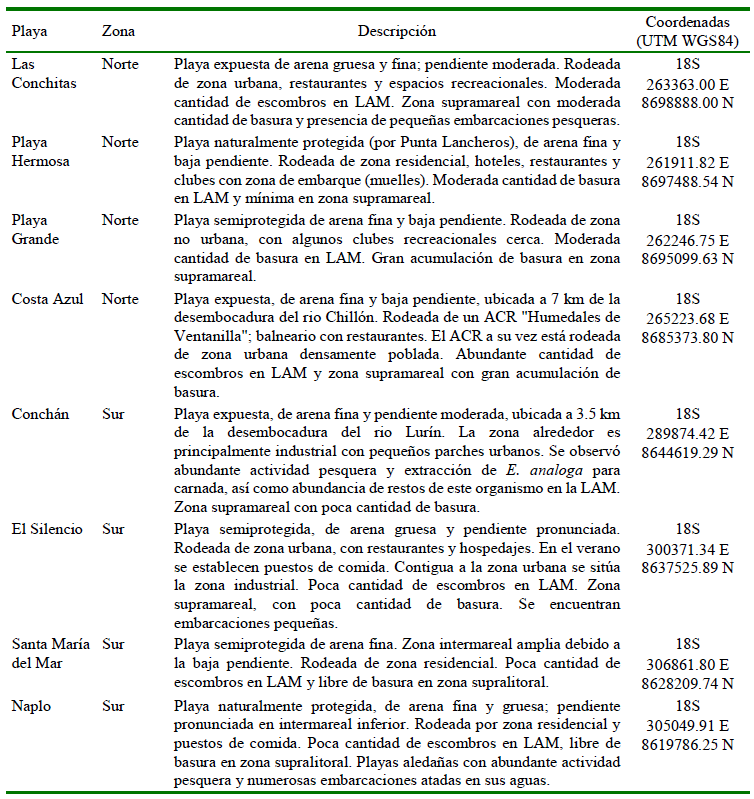
LAM = Línea de alta marea; ACR= Área de Conservación Regional
Para la colecta de sedimentos y para la extracción de los MP se siguió a Besley et al. (2017), con modificaciones mínimas en el área colectada en cada punto de muestreo (0.01 m2 en lugar de 0.25 m2), y en el volumen de sedimento empleado para la extracción (100 g en lugar de 50 g). En cada playa se trazó un transecto de 100 m de largo, paralelo a la costa, en la línea de alta marea y se establecieron cinco puntos de muestreo. De cada punto se colectó una muestra de 100 g de sedimento como mínimo (peso húmedo), escarbando en la superficie con ayuda de una pala metálica (0.10 x 0.10 m), hasta una profundidad de 5 cm. Las muestras fueron colocadas en frascos de vidrio o sobres de papel aluminio para su transporte al laboratorio. Los instrumentos fueron enjuagados con agua destilada filtrada entre muestra y muestra.
La extracción de MP del sedimento se realizó en tres etapas: secado, separación por densidades y filtración (Bangun et al., 2018). El secado se realizó por 48 h en una estufa a 60 °C. La separación por densidades se realizó mezclando 100 g de sedimento (peso seco) con 400 mL de solución saturada de NaCl (358.9 g·L-1) y removiendo la mezcla por 2 min a 600 rpm en un agitador magnético (Corning PC-620D(r)). Una vez removida, la muestra se dejó reposar hasta no observar turbidez en el sobrenadante. Finalmente, el sobrenadante fue tamizado a través de un filtro de nitrocelulosa de 47 mm de diámetro y 0.45 µm de poro, ayudado por una bomba de vacío (Rocker 400(r)). El proceso de extracción se repitió tres veces por cada muestra (Besley et al., 2017). Los filtros se dejaron secar a temperatura ambiente al interior de placas Petri de vidrio para prevenir su contaminación.
A fin de evitar que las muestras fueran contaminadas por MP presentes en el ambiente, los instrumentos o la ropa durante su proceso, se tomaron las siguientes medidas: se emplearon guantes de nitrilo y batas de algodón; todas las soluciones empleadas fueron filtradas antes de su uso mediante un filtro de nitrocelulosa de 47 mm de diámetro y 0.45 µm de poro; y todos los instrumentos y materiales empleados fueron enjuagados tres veces con agua filtrada antes y después de su uso (Horn et al., 2019).
El análisis de las muestras de E. analoga se inició midiendo el largo del caparazón con ayuda de un vernier (0.01 mm) y se determinó el sexo de los individuos mediante la observación de las características del telson y los pleópodos (Brazeiro, 2005). Seguidamente los individuos fueron disectados y los tractos gastrointestinales fueron removidos y separados individualmente en tubos de ensayo, cuya boca se cubrió con papel aluminio. La extracción de MP se realizó mediante digestión alcalina seguida por filtrado, siguiendo el protocolo propuesto por Foekema et al. (2013) y modificado por Dehaut et al. (2016). Cada tubo con muestra fue llenado hasta tres veces del volumen del tejido con una solución de KOH al 10% e incubado durante 24 h a 60 °C para digerir la materia orgánica. Posteriormente, todo el contenido del tubo fue filtrado al vacío a través de papel filtro sin ceniza (Whatman grado 41), cuyo tamaño de poro osciló entre los 20 y 25 µm. De igual manera, los filtros se dejaron secar a temperatura ambiente dentro de placas Petri.
Los MP retenidos en los filtros fueron contabilizados y caracterizados según su categoría (fragmento, fibra, espuma, film y pellet) (Crawford y Quinn, 2017), tamaño y color (Foekema et al., 2013). Los MP fueron identificados mediante inspección visual a través de un estereoscopio, confirmados mediante el test de la aguja caliente (Devriese et al., 2015) y agrupados según tipo y color. Además, se tomaron fotografías a los MP empleando un ocular con micrómetro (Rochman et al., 2015). Los tamaños (eje de mayor longitud) de cada MP fueron calculados analizando las fotografías con el Software ImageJ (Isobe et al., 2015).
Si bien los MP son por definición partículas entre 1 y 5000 µm (Crawford y Quinn, 2017); en este trabajo se consideraron como MP partículas entre 20 y 5000 µm debido a limitaciones del protocolo (las muestras digeridas no pasaron a través de un filtro de tamaño de poro más pequeño). Los resultados son reportados en: (1) abundancia de items de MP en E. analoga en ítems/individuo, considerando al individuo sin discriminar que presentara o no MP, (2) número promedio de items de MP/individuo de E. analoga, considerando solo los que presentaron MP y finalmente (3) sedimentos en ítems/kg de sedimento seco, respectivamente. De igual forma se determinó la frecuencia de ocurrencia (FO%) como el porcentaje de E. analoga y de sedimentos con MP (Pérez-Alvelo et al., 2021).
El análisis de datos fue desarrollado empleando Microsoft Excel 2013 y SPSS v. 26.0. La normalidad de los datos fue evaluada mediante las pruebas de Kolmogorov-Smirnov o Shapiro-Wilk, dependiendo del número de datos analizados y luego fue utilizada la prueba de Levene para evaluar la homogeneidad de varianzas. En general, los datos no cumplieron con las asunciones de normalidad y homogeneidad de varianzas por lo que fueron empleadas pruebas no paramétricas, exceptuando algunas pruebas aplicadas a subgrupos de datos que llegaron a cumplir estas asunciones. La prueba de Kruskal Wallis (H'), seguida por una prueba de comparación múltiple de Dunn-Bonferroni, se aplicaron para determinar diferencias entre las abundancias de MP presentes en E. analoga y sedimentos en las ocho playas.
Se usó la prueba U de Mann-Whitney para evaluar los efectos de la localización, temporada, cercanía de la playa a un río río (Chillón para las playas del norte y Lurín para las playas del sur) y sexo de E. analoga sobre el número de MP por individuo; así como del número de ítems/kg de sedimento. Esta prueba también fue empleada para evaluar si hubo diferencias entre los tamaños del caparazón de aquellos individuos de E. analoga que ingirieron MP y aquellos que no. La prueba de correlación de Spearman (rho) fue usada para determinar la relación entre la cantidad de MP en E. analoga y en el sedimento de su entorno, así como para probar si la proporción de individuos con MP presentes en E. analoga en una determinada playa estuvo relacionada a la abundancia de MP en el sedimento de dicha playa. Por último, esta prueba fue empleada, además, para determinar si el número de MP ingeridos por determinado individuo en E. analoga estuvo relacionado con su tamaño.
Aspectos Éticos
El proyecto fue aprobado por el Comité Institucional de Ética en Investigación con Animales y Biodiversidad de la Universidad Científica del Sur, Lima, Perú (Código 0062019-PRO99), mediante Constancia N.° 27CIEI-AB-CIENTÍFICA-2019. Además, el estudio se realizó bajo autorización del Ministerio de la Producción del Perú (PRODUCE), según Resolución Directoral N.° 740-2019-PRODUCE/DGPCHDI.
RESULTADOS
Emerita analoga
Un total de 480 individuos de E. analoga fueron analizados para evaluar la ingesta de MP (240 colectados en el verano y 240 en el invierno). El largo del caparazón (tamaño) de los machos (n=267) durante el invierno osciló entre 12.2 y 19.3 mm (14.88 ± 1.09 mm), y en el verano entre 13.7 a 22.0 mm (15.82 ± 1.98 mm). Respecto a las hembras, en el invierno sus tamaños fueron de 13.0 a 31.1 mm (20.51 ± 3.13 mm) y en verano (n=213), de 13.7 a 29.0 mm (21.32 ± 2.73 mm). En general, el tamaño de las hembras (20.96 ± 2.94 mm) fue significativamente superior al de los machos (15.15 ± 1.46 mm) (U = 1980, p=0.000).
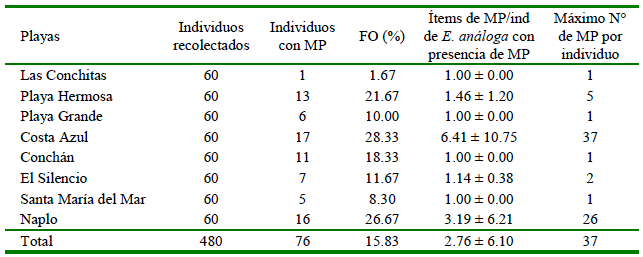
Se encontraron 210 ítems de MP en los tractos digestivos de 76 individuos de E. analoga. La FO% de MP promedio general fue 15.83% (Cuadro 2). La abundancia de MP promedio (± DE) en general fue de 0.44 ± 2.62 ítems/individuo. En ambas temporadas, la playa Las Conchitas presentó el valor más bajo y Costa Azul el más alto (Cuadro 3).
Cuadro 2. Frecuencia de ocurrencia (FO%) (proporcion de individuos de Emerita analoga con microplásticos -MPs -en su tracto digestivo), número promedio de MP por individuo con presencia de MPs en sus tractos digestivos (media ± DE) y máximo número de MP por individuo
Cuadro 3. Abundancias de ítems de microplásticos (MP) por individuo de Emerita analoga por cada temporada: invierno de 2019 y verano de 2020
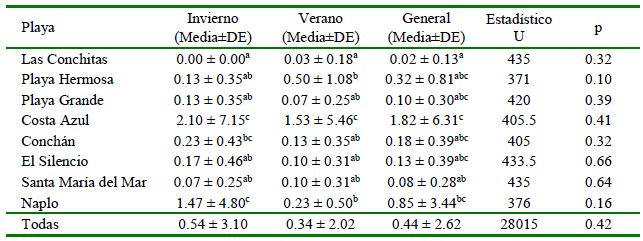
abc Letras distintan indican diferencias significativas entre playas (prueba de Kruskal Wallis, seguida por una prueba de comparación múltiple de Dunn-Bonferroni, p<0.05). DE = Desviación estándar
En ambas temporadas el tipo de MP más consumido por E. analoga fueron las fibras, conformando un 83.72% en el invierno y un 96.30%, en el verano (Figura 2). Respecto a los tamaños, los MPs más consumidos fueron aquellos con longitudes menores a las 1000 µm (62.38%; Cuadro 4; Figura 2). Los MP transparentes fueron los más consumidos tanto en invierno como en el verano, con 27.91 y 45.68%, respectivamente: El segundo color más consumido fue el negro con 25.71% (Figura 2). La abundancia de MP en E. analoga no evidenció diferencias significativas entre estaciones. Tampoco hubo diferencias significativas entre el número de MP por individuo de E. analoga de playas del norte y del sur, ya sea en general (U = 28605.50; p=0.84) en invierno (U = 6889.50; p=0.38) o en verano (U = 6987.50; p=0.52).
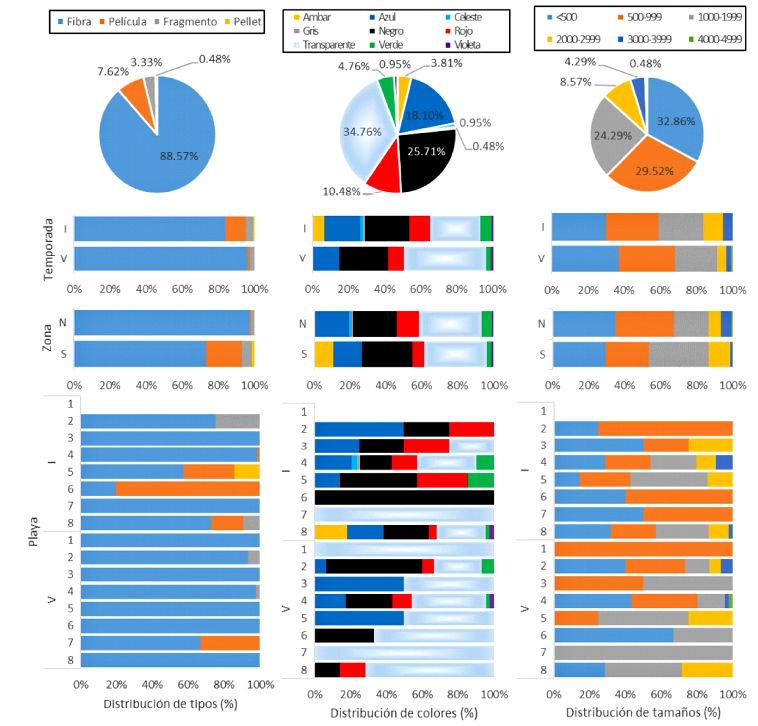
Figura 2. Distribucion de microplásticos (MP) según su tipo, color y tamaño en Emerita analoga. I=Invierno; V=Verano; N=Norte; S=Sur; 1=Las Conchitas; 2=Playa hermosa; 3=Playa Grande; 4=CostaAzul; 5=Conchán; 6=El Silencio; 7=Santa María del Mar; 8=Naplo. Tamaños en µm
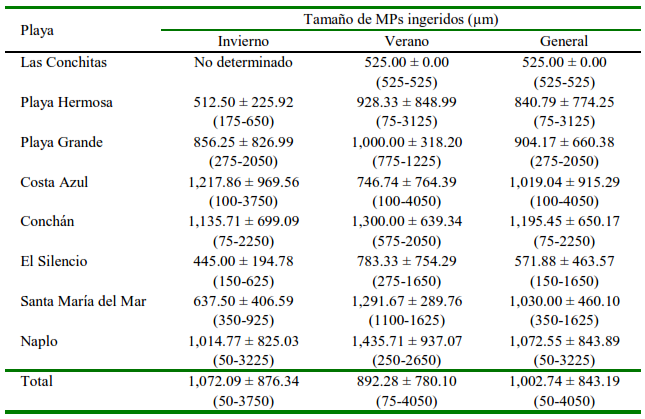
Cuadro 4. Tamaño de las micropartículas (MPs) presentes en el tracto digestivo de Emerita análoga (media + DE y rango)
La presencia del río Chillón entre las playas del norte generó diferencias significativas en la abundancia de MP presentes en E. analoga, siendo de 1.82 ± 6.31 MP por individuo en las playas cercanas al río y de 0.14 ± 0.52 en playas sin río cercano (U = 4415.50; p=0.001). Estas diferencias se observaron tanto en el promedio general (U = 1850, p=0.001); como en la temporada de invierno (U = 1004; p=0.001), pero no en el verano (U = 2103; p=0.16). Sin embargo, estas diferencias no fueron observadas entre las playas del sur (U = 5294; p=0.72). Por otro lado, hubo diferencias significativas entre el número de MP por individuo de las ocho playas en el invierno (H = 23.18; p=0.002), verano (H = 14.58; p=0.04) y de forma general (H = 30.02; p=<0.001) (Cuadro 3).
No se identificaron diferencias significativas entre el tamaño del caparazón de aquellos individuos de E. analoga en cuyos tractos digestivos se encontraron MP y aquellos en los que no, ya sea que se evaluaran en invierno (U = 3944.50; p=0.74), verano (U = 3317.50; p=0.48) o en conjunto (U = 14874.50; p=0.67). Se identificó una relación directa entre el tamaño de los individuos de E. analoga y el número de MPs ingeridos (rho = 0.25; p=0.03), donde los individuos de mayor tamaño que ingirieron MPs tuvieron significativamente más MP en su tracto digestivo que los más pequeños (Figura 3). Esta relación cobra mayor fuerza durante el verano (rho = 0.41; p=0.02), pero fue ausente en el invierno (rho = 0.19; p=0.24).
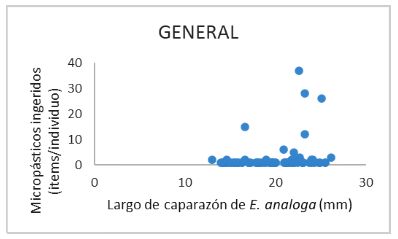
Figura 3. Gráfica entre la relación de los microplásticos (MP) ingeridos de Emerita analoga (ítems/individuo) con el largo del caparazón (mm) en ocho playas del departamento de Lima, Perú
La abundancia de MP en los individuos machos no difirió significativamente del número ingerido por las hembras en general (U = 17391; p=0.33). Sin embargo, la abundancia de MPs en hembras en el invierno (0.63 ± 3.47) fue superior a la de los machos (0.30 ± 1.84) (U = 5132.50; p=0.04).
Sedimentos
Se encontraron MP en los sedimentos de las ocho playas y en ambas estaciones. El número de MP por kilogramo de sedimento en invierno fluctuó entre 0 y 3890 y en verano entre 0 y 13310. Los fragmentos conformaron la mayor parte de los MP (80.07 en invierno y 94.24% en verano), seguido por las fibras y las espumas. La distribución del tamaño fue bastante similar entre estaciones, siendo en general, los ítems de MP entre 2000 a 3000 µm con 35.69%, seguido por ítems con tamaños entre 1000 y 2000 µm con 33.19%. En la distribución por colores tampoco se observó gran variación entre estaciones, habiendo un predominio de MP transparentes (27.57%) y blancos (23.16%).
La abundancia de MP en el sedimento fue mayor en el verano en cinco playas (Cuadro 5). No se observaron diferencias significativas en las abundancias de MPs en los sedimentos de las playas del norte y sur de Lima (U = 684.50, p=0.27). Sin embargo, al evaluar por estaciones, el número de ítems de MP por kilogramo de sedimentos en las playas del norte (729.50 ± 1044.59) fue significativamente mayor que las playas del sur (141.00 ± 134.86) en la temporada de invierno (U = 116.50; p=0.02); más aún en el verano (playas del norte: 3,592.00 ± 3557;) playas del sur: 71.00 ± 100.05; p=< 0.001).
Cuadro 5. Abundancia en sedimentos en en invierno de 2019 y verano de 2020
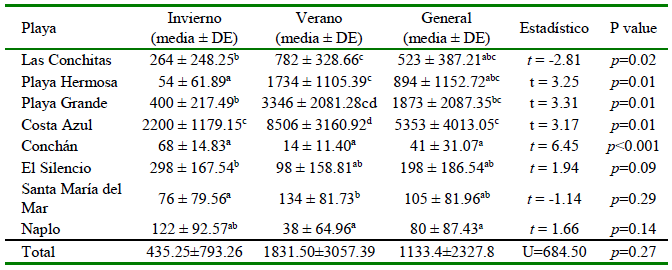
abcd Letras distintan indican diferencias significativas entre playas (prueba de Kruskal Wallis, seguida por una prueba de comparación múltiple de Dunn-Bonferroni, p<0.05)
La presencia de un río cercano a las playas no evidenció diferencias significativas en las abundancias de ítems de MP por kilogramo por estaciones (invierno: U = 104.50; p=0.16); verano (U = 130.00; p=0.53) o en ambas temporadas (U = 507; p=0.30). Por otro lado, se encontraron diferencias significativas entre las abundancias de ítems de MPs por kilogramo de sedimento para las ocho playas; tanto en invierno (H = 27.28, p=<0.001) como en verano (H = 34.86, p=<0.001), así como en el global (H = 47.14, p=<0.001) (Cuadro 5).
Relación entre Emerita analoga y Sedimentos
No hubo una general relación significativa entre la abundancia de MP en E. analoga y en los sedimentos de las playas marinas (rho = 0.12; p=0.78), ni en la estación de verano (rho = 0.11; p=0.80) o invierno (rho = 0.26; p=0.53). La FO % de E. analoga que presentaron MP en su tracto digestivo en una playa no estuvo relacionada a la abundancia de MP en el sedimento de dicha playa, tanto en general (rho = 0.12; p=0.78), como en invierno (rho = 0.17; p=0.68) o verano (rho = 0.06; p=0.89).
DISCUSIÓN
Emerita analoga
Los resultados mostraron que el 15.88% de los individuos de E. analoga en las ocho playas arenosas de Lima contenían MP en sus tractos digestivos, sin variaciones significativas entre el verano e invierno o entre las zonas norte y sur. E. analoga es habitante habitual en estas playas y, por tanto, expuestos a la captación de MP (Brazeiro, 2005). La proporción de organismos afectados fluctuó entre 1.67 y 28.33%, dependiendo de la playa. En un estudio en especímenes del "cangrejo peludo" R. setosum se determinó que el 100% de los individuos contenían MPs en su tracto digestivo (Iannacone et al., 2022). Los valores reportados en otros países, en organismos de varios taxones animales que comparten el mismo hábitat y cuyo tipo de alimentación los expone a la ingesta de MP varían desde 1 a 100% (Bour et al., 2018; Piarulli et al., 2020), y considerando únicamente a crustáceos se reportan entre 5.50 y 100% de individuos con MP (Piarulli et al., 2019; Iwalaye et al., 2020).
Se ha observado ingesta de MP en invertebrados diversos países (Waddell et al., 2020). Horn et al. (2019), encontraron una abundancia de 0.65 ± 1.64 items de MP/ind en E. analoga en las playas arenosas de California. La abundancia promedio de MP/ind en este estudio (0.44 ± 0.65) fue cercana a los valores encontrados para los crustáceos omnívoros Lithodes santolla (0.33 MP/ind) de playas chilenas (Andrade y Ovando, 2017) y Callinectes sapidus (0.44-0.72 MP/ind) en Texas, USA (Waddell et al., 2020), así como en los crustáceos Pandalus borealis y Chionoecetes opilio (0.04-1.67 MP/ind) de los mares de Bering y de Chukchi en Rusia (Fang et al., 2018). Valores menores fueron encontrados en el anfípodo Cymadusa sp (0.07 MP/ind) de las costas de Brasil (Da Silva et al., 2021).
Los crustáceos no son los únicos que se han evaluado en zonas costeras. Valores mayores a los del presente estudio han sido reportados en bivalvos (0.01-0.25 MP/ind) y en gusanos poliquetos (0.10 MP/ind) de la costa norte del mar Adriático, quienes son suspensívoros y omnívoros, respectivamente (Piarulli et al., 2020). En la ascidia Phallusia nigra se han contabilizado 0.17 MP/ind (Da Silva et al., 2021). En general, los estudios en bivalvos, tanto en Perú como alrededor del mundo, muestran abundancias superiores a lo encontrado en E. analoga, partiendo de 0.60 hasta 11.48 MP/ind (Rochman et al., 2015; Li et al., 2016, 2018; Bråte et al., 2018; Qu et al., 2018; Baechler et al., 2020; De la Torre et al., 2020a; Valencia et al., 2020; Ding et al., 2021).
Al solo considerar individuos de E. analoga con MP, la abundancia promedio general fue de 2.76 ± 6.10 MO/ind. En 77.63% de los casos, los individuos solo ingirieron 1 MP, pero algunos de ellos contuvieron hasta 37 ítems. Este hecho también fue observado en invertebrados bentónicos de hábitos suspensívoros y sedimentívoros de Noruega (Bour et al., 2018), y en poblaciones del cangrejo omnívoro Carcinus aestuarii del norte del Mar Adriático (Piarulli et al., 2019).
Iwalaye et al. (2020) señalan que el incremento en la temperatura del agua durante el verano trae consigo un aumento del metabolismo de organismos ectotermos, favoreciendo una mayor ingestión de alimentos (incluyendo MPs). Sin embargo, en este estudio no hubo diferencias en la abundancia de MP{ durante el invierno (0.54 ± 3.10 MP/ind) en comparación con el verano (0.34 ± 2.02 MP/ind). Esta falta de variación de las abundancias entre temporadas fue observada también por Ding et al. (2021) en moluscos bivalvos en Qingdao, China.
No hubo diferencias en la ingestión de MP entre las playas del norte con las del sur; sin embargo, la playa Costa Azul del norte registró la mayor cantidad de MP en el sedimento y la mayor cantidad de MP ingeridos por E. analoga (1.82 ± 6.31 MP/ind) en comparación con las otras siete playas (0.02-0.85 MP/ind). Un factor que tuvo un impacto significativo en la cantidad de MP ingeridos por E. analoga en la zona norte fue la presencia del río Chillón, el cual constituye una de las vías de constante ingreso de MPs provenientes de áreas urbanas zona, incrementando su biodisponibilidad para los organismos que habitan las playas costeras de los alrededores.
El tamaño de E. analoga no determinó la cantidad de consumo de MP, lo cual estuvo acorde con lo obtenido por Horn et al. (2019), Costa et al. (2019) y Morais et al. (2020). Por otro lado, estudios en langostas y almejas indican que los organismos pequeños contenían altas concentraciones de MP en comparación con aquellos de gran tamaño (Murray y Cowie, 2011; Narmatha-Sathish et al., 2020). Este hecho se respalda en que organismos de mayor tamaño poseen tractos gastrointestinales con suficiente espacio para permitir que las partículas los recorran sin adherirse o engancharse en alguna estructura interna, facilitando su eliminación natural. Asimismo, los bivalvos tienen la capacidad de eliminar partículas por medio de pseudoheces (Murray y Cowie, 2011; Bråte et al., 2018).
El sexo de los individuos no influyó significativamente en la cantidad de MP ingeridos (Murray y Cowie, 2011); resultado similar al hallazgo de Iannacone et al. (2022) en R. setosum. Por otro lado, se ha reportado en hembras de N. norvegicus una mayor abundancia de MP presentes en el tracto digestivo de las hembrasen el invierno (Welden y Cowie, 2016, 2018), especialmente durante el periodo de incubación, donde cambian su tipo de alimentación tornándose a un mecanismo suspensívoro (Murray y Cowie, 2011). También se han detectado mayores abundancias en cangrejos machos Lithodes santolla de las costas de Chile (Andrade y Ovando, 2017).
Entre los factores que intervienen en la cantidad de MP que ingiere un organismo determinado se encuentran los ambiente donde residen y se alimentan. La literatura muestra que la concentración de MP en los sedimentos es mayor que en la columna de agua, debido a que una parte de las MP poseen una densidad mayor a la del agua, lo que no les permite flotar (Ding et al., 2021); asimismo, la bioincrustación (formación de biopelículas en la superficie de las partículas) aumenta su densidad haciéndolas propensas a hundirse. Esta condición pone de manifiesto un alto riesgo de exposición para organismos suspensívoros y sedimentívoros que habitan esta zona (Su et al., 2018; Morais et al., 2020).
El consumo de MP es predominante en organismos de hábitos suspensívoros como mejillones, ostras, almejas y ascidias (Su et al., 2018; Baechler et al., 2020; Valencia et al., 2020; Xu et al., 2020a); sedimentívoros como pepinos de mar, anélidos, cangrejos y otros crustáceos bentónicos (Bour et al., 2018; Iwalaye et al., 2020; Zhang et al., 2021), y filtradores propiamente dichos, como E. analoga (Horn et al., 2019, 2020; Xu et al., 2020a,b). Estos últimos habitan en los sedimentos y son incapaces de diferenciar entre partículas de alimento o MP; además, no cuentan con algún mecanismo para eliminar las partículas captadas antes de que estas ingresen a su tracto digestivo (Horn et al., 2020).
Las bajas frecuencia de ingesta y abundancia de MP en E. analoga en comparación con otros grupos de invertebrados bentónicos de la zona intermareal, a pesar de ser un organismo altamente expuesto a la ingesta de MP, se pueden atribuir a su mecanismo de alimentación (Awuor et al., 2020; Waddell et al., 2020). Esto igualmente sucede en crustáceos como los percebes Lepas spp, que en ambientes contaminados por MP solo 33.5% presentó MP en el tracto gastrointestinal y en rangos de 1 a 30 partículas (Goldstein y Goodwin, 2013).
El predominio del consumo de fibras por E. analoga (88.57%) ha sido observado también en bivalvos, moluscos quitones y cangrejos de las playas de Lima, constituyendo entre el 59.09 y 92.68% de los MPs en estos organismos (De la Torre et al., 2020a; Valencia et al., 2020; Iannacone et al., 2022). Resultados similares han sido observados en diversos grupos de organismos en otros países (Bråte et al., 2018; Fang et al., 2018; Costa et al., 2019; Mohsen et al., 2019; Morais et al., 2020; Waddell et al., 2020; Xu et al., 2020ab; Zhang et al., 2021; Astorga-Pérez et al., 2022). Por otro lado, la estación no influyó en el tipo de fibras consumidas. Las fibras posen la densidad suficiente como para hundirse (Waddell et al., 2020), además de que son fácilmente resuspensibles por el constante rompimiento de las olas de la zona intermareal (Sayogo et al., 2020), dando como resultado una constante lluvia de fibras que son atrapadas por las antenas de E. analoga. Además, una vez ingeridas, tienden a adherirse en las estructuras internas, llegando a enredarse entre sí, dificultando su eliminación (Piarulli et al., 2019; Narmatha-Sathish et al., 2020), favoreciendo su retención y acumulación (Sayogo et al., 2020).
Una probable razón de haber encontrado una menor proporción de fibras con relación a los fragmentos, como se reporta en diversos ambientes marinos, se debería al hecho de haber retirado las fibras orgánicas a base de celulosa como la viscosa o algodón (Li et al., 2018; Qu et al., 2018; Xu et al., 2020a), no siendo, por lo tanto, consideradas como MP en esta investigación. Estas fibras, en otros trabajos son incluidas en el cálculo de las abundancias y proporciones (Akkajit et al., 2021; Truchet et al., 2021). Es así, que los valores registrados para las fibras en el presente estudio estarían subestimados.
El tamaño promedio de las partículas ingeridas por E. analoga (1002.74 µm) fue similar al de los señalados por Xu et al. (2020a) en invertebrados de las costas de Hong Kong (1004.2 µm), pero inferior al de los crustáceos balánidos reportados en esa misma región (1359.13 µm) (Xu et al., 2020b). Estas variaciones también han sido encontradas en bivalvos (Fang et al., 2018). En otros trabajos, el tamaño de los MPs dependió indudablemente de la zona del estudio y de las especies involucradas (Qu et al., 2018; Mohsen et al., 2019; Narmatha-Sathish et al., 2020; Truchet et al., 2021).
Los resultados obtenidos favorecen el planteamiento realizado por Horn et al. (2019) al declarar que E. analoga probablemente ingiere MP del tamaño del plancton (partículas entre 4 y 2000 µm,). El tamaño de la boca de un organismo puede ser una limitante al tamaño de los MP ingeridos; sin embargo, en esta investigación se evidenció que las fibras de MP de una longitud mayor a la de la apertura de la boca pueden ingresar, para luego enredarse o atascarse en el tracto digestivo (Mohsen et al., 2019).
La fibras rojas y azules son consideradas como las más frecuentes en moluscos (De la Torre et al., 2020a; Valencia et al., 2020) y cangrejos (Iannacone et al., 2022) en las playas de Lima; sin embargo, en el presente estudio, las transparentes predominaron, constituyendo el 34.76% del total, seguidos por el negro (25.71%), azul (18.10%) y rojo (10.48%). Este predominio de MP transparentes es consistente con otros estudios (Awuor et al., 2020; Baechler et al., 2020; Xu et al., 2020a; Ding et al., 2021). Los MPs negro y azul se encontraron con mayor frecuencia en invertebrados costeros de Brasil (Costa et al., 2019), Costa Rica (Astorga-Pérez et al., 2022) y Sudáfrica (Iwalaye et al., 2020), mientras los negros y transparentes abundaron en cangrejos de China (Zhang et al., 2021) y en bivalvos de una playa turística de Argentina (Truchet et al., 2021). El rojo, por otro lado, ha sido registrado como el color dominante en organismos bentónicos de las regiones árticas y subárticas (Fang et al., 2018).
La variedad de colores observados en las fibras, sugieren también una variedad de fuentes (Awuor et al., 2020). Algunas tienen su origen en los hogares, producto del desprendimiento que genera el lavado de ropa sintética, los que llegan al mar en las aguas residuales, pero también se pueden originar directamente en el mar, producto de las actividades turísticas y del desgaste de las artes de pesca, cuerdas y materiales empleados en actividades pesqueras (Costa et al., 2019). Es importante resaltar que el desgaste y la exposición a factores ambientales pueden decolorar los MP, tornándolos transparentes (Prarat y Hongsawat, 2022).
Sedimento
El hallazgo de MPs en los sedimentos de las playas muestreadas reconfirma que los MPs están ampliamente distribuidos a lo largo de la costa central del Perú, tal como se observó en investigaciones previas (Purca e Henostroza, 2017; Iannacone et al., 2019; De la Torre et al., 2020b; Pretell et al., 2020; Zarate y Iannacone, 2021).
La abundancia promedio entre las dos temporadas se encuentran dentro del rango de los reportados en playas de China adyacentes a zonas de maricultura o con un bajo índice de desarrollo (Zhou et al., 2020). Sin embargo, los valores registrados en la presente investigación son mayores a los obtenidos en estudios similares en el país (Purca e Henostroza, 2017; Iannacone et al., 2019; De la Torre et al., 2020b; Pretell et al., 2020; Zarate y Iannacone, 2021), como en países vecinos, tales como Chile (Hidalgo-Ruz y Thiel, 2013), Brasil (Costa et al., 2019), Guatemala (Mazariegos-Ortíz et al., 2020) y Argentina (Jaubet et al., 2021; Truchet et al., 2021). Sin embargo, se dispone de reportes con abundancias inferiores en las costas arenosas de México (2553.40 ítems/kg; Torrez-Pérez et al., 2021) y en China (6922.60 ítems/kg; Qiu et al., 2015).
Las metodologías empleadas para la toma y procesamiento de las muestras tienen un rol importante en los resultados obtenidos (De la Torre et al., 2020b). Por ejemplo, la abundancia obtenida por Purca e Henostroza (2017) para la playa Costa Azul fue de 463.33 ítems/m2 en la época seca, mientras que en este estudio para esa época fue de 22 000 ítems/m2. En el primer estudio, se contabilizaron plásticos duros entre los 1 y 2500 µm, mientras que en esta investigación fue de 0.45 a 5000 µm: además, en el primer caso el 80% de los MP fueron fueron extraídos sin ayuda de un microscopio, en tanto que toda la extracción de los MPs se hizo con ayuda del estereoscopio en el presente estudio. fue empleado en la extracción del 100% de los ítems reportados. Por otro lado, la zona para la toma de muestras puede afectar los restados, siendo así que se pueden obtener divalores muy diferentes al tomar muestras de la zona intermareal o supralitoral con relación a la línea de alta marea, utilizada en la presente investigación.
Se reconoce que los niveles de MP guardan relación con la densidad poblacional humana (Chen y Chen, 2020; Prarat y Hongsawat, 2022). Este hecho fue confirmado en la presente investigación, pues el norte, en donde se verificó una mayor abundancia de MP en sedimentos, cuenta con una población de cerca de 3.5 millones de habitantes, mientras en el sur, en donde se verificó una cantidad mucho menor, la población es menor a los dos millones de habitantes (INEI, 2014).
Respecto a la variación de las abundancias entre temporadas, a diferencia de los estudios realizados por Cheung et al. (2016) y Gao et al. (2021), el análisis general no mostró diferencias significativas en las abundancias de MP entre las temporadas de invierno y verano. Sin embargo, los resultados por playa mostraron una mayor abundancia de MP en sedimentos de las playas del norte en el verano, mientras para las playas del sur fue en el invierno. La actividad turística es un factor que ha sido asociado al incremento de la abundancia de MP en sedimentos, especialmente para las playas del norte (Chen y Chen, 2020). No obstante, el resultado para las playas del sur fue inesperado, aunque esto ya habría sido reportado por Pretell et al. (2020) para la playa Pescadores, lo cual estaría influenciado por la mayor y mejor limpieza de las playas. En el presente estudio, cuando se realizaron las colectas, se pudo observar que los residuos en la línea de alta marea en las playas del sur habían sido removidos parcialmente con la ayuda de un rastrillo, hecho que no se observó en las playas de norte.
Otro factor que se ve afectado por la variación temporal y que puede ayudar a comprender el aumento de la cantidad de MP presentes en los sedimentos durante la época de verano son las precipitaciones (Cheung et al., 2016). El verano en la costa del país se corresponde con la temporada de lluvias en la sierra. Las lluvias arrastran los desechos acumulados en las riveras de los ríos (Alvarez-Zeferino et al., 2020); además, el crecimiento de las aguas resuspende los desperdicios acumulados durante la época seca en el fondo de los ríos, siendo transportados al océano (Hurley et al., 2018).
Según Eo et al. (2019), entre el 70 y 80% de los MP que ingresan al mar a través de los ríos, lo hacen en la temporada lluviosa. Por esta razón, algunos autores encontraron mayor abundancia de MP durante la época lluviosa en verano que durante la época seca en invierno (Hurley et al., 2018; Gao et al., 2021), Sin embargo, si bien los resultados mostraron un claro aumento en la abundancia durante la epoca de verano en las playas del norte, este incremento no se pudo atribuir estadísticamente a la influencia ejercida por el río Lurín en el sur. No obstante, es un hecho que los ríos constituyen uno de los principales medios de transporte de MP hacia el medio marino (Baechler et al., 2020).
En general se vieron diferencias significativas en las abundancias entre playas, siendo Costa Azul, Conchán y Naplo las más disimiles. En general, Costa Azul, una de las playas del norte, adyacente a un área densamente poblada, con una moderada afluencia de veraneantes y localizada 7 km del punto de descarga del río Chillón, fue la que mostró la mayor abundancia de MP. Según Purca y Henostroza (2017) consideran a los residuos urbanos descargados en las bahías de distritos cercanos a esta playa como una posible fuente de MP. Además de esto, una inspección visual del entorno de las playas permitió observar que tanto en Costa Azul como en Playa Grande (la segunda con mayor abundancia de MP), presentaban grandes cantidades de basura acumulada en la zona supralitoral, lo cual sugiere además una fuente terrestre (Pérez-Alvelo et al., 2021).
El 91.52% de los MP identificados fueron fragmentos, resultados consistentes con algunas publicaciones sobre MP en playas de la costa central del Perú y otros países (Hidalgo-RuzyThiel, 2013;Youngy Elliott, 2016; Purca y Henostroza, 2017; Pretell et al., 2020; Zhou et al., 2020). Pretell et al. (2020). Sin embargo, en muchos trabajos se sitúan a las fibras como el tipo más abundante de MP en los sedimentos de playas arenosas. Entre ellos, Horn et al. (2019) reportan 95% de fibras en las playas de California, Torrez-Pérez et al. (2021) con 88% en las playas arenosas de México, y Chen y Chen (2020) encontraron entre 97 y 99% de fibras en las playas de Taiwán.
Los MP secundarios, como los fragmentos, provienen principalmente de áreas urbanas (De la Torre et al., 2020a) y tienen su origen en la degradación mecánica o química de plásticos de mayor tamaño, los cuales expuestos a las condiciones ambientales, se agrietan y fragmentan (Zhang et al., 2020), degradación que se inicia a partir de las ocho semanas de exposición al ambiente (Weinstein et al., 2016)
Las fibras representaron el 4.16% de los MP totales y pueden ser generadas en el océano, por fragmentación de cuerdas y material de pesca (Akkajit et al., 2021) o por desprendimiento a partir de la ropa de los bañistas (Pérez-Alvelo et al., 2021). No obstante, se ha reportado que la mayor cantidad de fibras resultan del lavado a máquina de telas sintéticas (Prarat y Hongsawat, 2022).
El 3.62% de los MP fueron espumas. Debido a su uso en la industria de los alimentos, es común encontrarlas en playas donde se desarrolla el turismo (Zarate y Iannacone, 2021). Las películas y los pellets conformaron menos del 1% en conjunto. Los MP tipo película, se originan a partir de envases de alimentos de plástico (Sayogo et al., 2020) y bolsas principalmente. Las películas son muy frágiles, quebrándose en pequeñas piezas (Lo et al., 2018), lo cual explicaría la baja abundancia en el estudio. Los pellets a diferencia de los fragmentos, fibras, espumas y películas son MP primarios y suelen ser abundantes en playas cercanas a industrias de fabricación de plástico, Además, se les emplea en la elaboración de productos para el cuidado personal, por lo que llegan a ser vertidos al mar a través de las aguas residuales domésticas (Prarat y Hongsawat, 2022).
Los MP encontrados en los sedimentos de tamaño entre 1000 y 3000 µm conformaron el 68.88% del total. En este sentido, estudios realizados en playas arenosas de Perú por Purca y Henostroza (2017), De la Torre et al. (2020) y Pretell et al. (2020) quienes encontraron que la fracción más abundante de MP estuvieron en los rangos de 1000 a 2500, 1000 a 2800 y 1000 a 2000 µm, representando el 80.0, 54.2 y 34.5-50.9% del total, respectivamente. Ding et al. (2021) reportaron MP de mayor tamaño durante el verano; sin embargo, no se observaron cambios en el rango de tamaño entre estaciones en el presente estudio, pues las partículas estuvieron entre 1000 y 3000 µm tanto en verano (70.47%) como en invierno (62.21%). Sin embargo, el tamaño más frecuente en las playas del norte estaba entre 1000 y 3000 µm (70.72%), mientras que en el sur era menos de 1000 µm (59.91%), mostrando la influencia de las playas del norte sobre los resultados. Resultados similares a los de las playas del norte fueron reportados por Zhou et al. (2020) en playas turísticas y cercanas a puertos pesqueros, mientras que los resultados obtenidos en las playas del sur fueron coincidentes con el trabajo de Iannacone et al. (2019), quienes encontraron que 65.80% del total de los MP en los sedimentos de la playa Venecia (sur de Lima) era menos de 1000 µm.
En lo referente al color de los MP, diversos trabajos han registrado predominio del blanco y transparente (Alvarez-Zeferino et al., 2020; Mazariegos-Ortíz et al., 2020; Narmatha-Sathish et al., 2020; Chouchene et al., 2021), en tanto que en el presente estudio fue el transparente (27.57%), seguido del blanco (23.16%), sin cambios mayores por efecto de la temporada, respaldando lo reportado por Chen y Chen (2020). Otros resultados en playas de la costa central del Perú se ha reportado la predominancia de MP de color transparente o blanco (Iannacone et al., 2019; De la Torre et al., 2020b).
La zona en la cual se localizan las playas tuvo impacto sobre las características de los MP encontrados en los sedimentos. Las playas del norte mantuvieron una proporción similar a los valores generales, con 28.09% de MP transparentes seguidos por 23.85 % de blancos. En cambio, las playas del sur mostraron un patrón diferente, siendo predominante el color azul (29.72%), seguido del negro (18.87%). Estudios realizados en Lima y alrededores muestran un patrón similar, donde el azul fue el color más abundante en las playas Chancay, Carpayo y Asia (Zarate e Iannacone, 2021), y el negro fue el más abundante en las playas D'Onofrio, Pescadores y Pucusana (Pretell et al., 2020). Esta dominancia de los colores azul y negro también ha sido observado en otros países de Centro y Sudamérica (Costa et al., 2019; Torrez-Pérez et al., 2021; Truchet et al., 2021), así como en China (Mohsen et al., 2019; Gao et al., 2021).
Los fragmentos de MP blancos y transparentes, como los de este estudio, se constituyen principalmente de polipropileno y polietileno, y son empleados para la fabricación de múltiples productos, tanto para uso doméstico como industrial (Edo et al., 2019). A esto se debe agregar el hecho de que casi la totalidad de las espumas encontradas en este estudio fueron blancas, y se contabilizaron dentro de esta categoría, a pesar de que muchas de ellas se habían tornado ligeramente amarillas, debido al prolongado tiempo de exposición al ambiente. Además, se observaron MP incoloros, tanto translucidos como opacos, y todos fueron contabilizados como transparentes, pues se sabe que, los translucidos corresponden a MP que recientemente ingresaron al medio marino, proveniente de fuentes cercanas, mientras los opacos son aquellos que han sufrido desgaste con el paso del tiempo (Mazariegos-Ortíz et al., 2020). Las fibras azules y negras, como las que abundan en la zona sur de este estudio, suelen ser más abundantes en playas y puertos relacionados con actividades pesqueras (Chouchene et al., 2021).
Relación entre Emerita analoga y Sedimentos
En esta investigación se determinó que la abundancia de MP en los tractos digestivos de E. analoga no estaba relacionada con la abundancia presente en los sedimentos de las playas de Lima. Esta falta de relación fue asimismo reportada entre los MP de los sedimentos y muy-muy de las playas de California (Horn et al., 2019). Por otro lado, se ha registrado que la constante resuspensión de los MP depositados en los sedimentos de la zona intermareal genera una fuerte correlación entre la abundancia de MP en organismos que se alimentan filtrando en la columna de agua de esta zona y los sedimentos (Su et al., 2018). Correlaciones positivas entre los sedimentos costeros y los organismos que habitan en ellos han sido reportados en percebes (Xu et al., 2020b), almejas (Narmatha-Sathish et al., 2020) y pepinos de mar (Mohsen et al., 2019), entre otros.
Si bien no se determinó la existencia de una relación entre organismo y el sedimento de su entorno, nuestros resultados demuestran que los MP están presenten en el sedimento de las playas de Lima, así como en E. analoga que habitan en ellos. Estos hechos sugieren que los MP pueden estar ingresando a la cadena alimenticia de las playas arenosas del Perú, a través de E. analoga. Este invertebrado es un importante eslabón en la cadena trófica de la zona intermareal arenosa en la cual habita, pues existe una diversa gama de vertebrados e invertebrados que ejercen una acción depredadora sobre esta especie. Por esta razón, E. analoga puede transferir MP a organismos en distintos niveles tróficos, como aves playeras (Rojas-Meza y Sebastián-Cabrera, 2010), peces que viven en los fondos arenosos y pegados a la costa, e incluso crustáceos que habitan la zona supramareal (Osorio et al., 1967).
Emerita analoga cumple con las características de un buen bioindicador y/o biomonitor, las cuales son: abundancia local, amplia distribución, facilidad para ser colectado, hábito sedentario y generalista o no selectivo (Costa et al., 2019; Morais et al., 2020; Torres et al., 2020). Sin embargo, para esta investigación, el hecho de que no pueda relacionarse con el grado de contaminación por MP existente en los sedimentos de su entorno, repercute en forma desfavorable para su empleo como un potencial biomonitor de MP dentro de una escala espacio-temporal, pues para ello, sería necesario que los MP en el tracto digestivo de E. analoga y en los sedimentos sean directamente proporcionales, tanto en abundancia como en su distribución (Costa et al., 2019). Incluso como bioindicador, una de las mayores limitantes sería su baja frecuencia de ocurrencia de ingesta de MP (15.88%).
Considerando la reducida área de muestreo empleada en este proyecto (0.10 x 0.10 m) en comparación con otras efectuadas en investigaciones similares (entre 0.25 x 0.25 a 0.50 x 0.50 m), que la distribución de MP en la línea de alta marea no está distribuida homogéneamente y que la muestra de sedimento fue obtenida directamente del rastro dejado por la línea de alta marea, en donde hay una gran concentración de MP y otros desperdicios arrojados por el mar y que toda ella fue analizada, pues constituía casi el 100% del sedimento procesado y analizado (100 g en peso seco), el valor de las abundancias obtenidas podría estar ligeramente sobre-estimado.
CONCLUSIONES
Se observó presencia de microplásticos (MP) en E. analoga y los sedimentos de las ocho playas arenosas evaluadas en la costa de Lima, Perú.
La playa con el mayor número de MP consumidos por parte de E. analoga fue Costa Azul, y la playa con la menor cantidad fue Las Conchitas. Los MP más consumidos fueron las fibras transparentes, con un tamaño promedio de 1002.74 µm. Las abundancias y distribuciones de los MP consumidos no sufrieron cambios entre temporadas o localizaciones.
El tamaño de los organismos no determinó el hecho de si consumían MP, pero influyó sobre la cantidad de MP ingeridos entre aquellos que lo hicieron. El sexo no se asoció con el consumo de MP.
La playa Costa Azul, una de las playas del norte, mostró los valores más altos de abundancia de MP en los sedimentos, en tanto que la playa Conchán, al sur de Lima, presentó la menor abundancia.
Los MP más comunes en el sedimento fueron los fragmentos de color transparente (1000 a 3000 µm). La abundancia de MP en los sedimentos fue más alta en el verano que en el invierno; pero sin diferencias por tipo, tamaño o color.
La abundancia de MP fue mayor en las playas del norte respecto a las playas del sur, así como en la distribución de los MP según tipo, tamaño y color.
La abundancia de MP presentes en el sedimento de una playa no se relacionó con la proporción de individuos que ingerían MP.












 uBio
uBio