INTRODUCCIÓN
La anestesia se utiliza en estudios de biología y acuicultura con el fin de reducir el estrés y relajar a los peces para procedimientos rutinarios como medición, reproducción artificial, cirugía, marcaje, captura y transporte (Manuel et al., 2014). La manipulación de los peces durante los procesos de investigación aumenta el riesgo de lesiones internas y externas, lo que puede ocasionar una disminución en el funcionamiento del sistema inmune, ocasionando enfermedad o muerte (Caudill et al., 2014; Tacchi et al., 2015). Estos efectos pueden disminuirse con el uso de anestésicos o analgésicos, los cuales producen relajación muscular, estabilización autonómica, analgesia, inducen inconsciencia y reducen el metabolismo, consumo de oxígeno y excreción (Bodur et al., 2018; Aydýn y Barbas, 2020).
El eugenol o aceite de clavo es el anestésico natural más comúnmente utilizado en investigación acuícola, biológica y pesquera (Sindhu y Ramachandran, 2013), ya que sus derivados (eugenol, isoeugenol y metileugenol) se encuentran ampliamente disponibles, son económicos y no son sustancias controladas (Kamble et al., 2014; Fernandes et al., 2017). Se ha demostrado que los derivados del eugenol se metabolizan rápido y son efectivos en especies de peces de agua dulce (Caudill et al., 2014; Bowker et al., 2015) y marina (Trushenski et al., 2012; Christiansen et al., 2013; Silbernagel y Yochem, 2016), considerando como adecuado su empleo en condiciones de laboratorio (Sladky et al., 2001; Vargas-Vargas, 2017; Bodur et al., 2018; El-Saber Batitha et al., 2020). Sin embargo, es importante establecer la dosis idónea y el tiempo máximo de exposición al eugenol para cada especie (Cho y Heath 2000; Barata y Soakes, 2016). Por ejemplo, en salmónidos se ha observado que bajas concentraciones de eugenol pueden ser tóxicas, mientras que en otras especies es un anestésico eficaz (Chacón-Guzmán et al., 2019; Haro-González et al., 2021).
Dormitator latifrons (Richardson, 1844), comúnmente llamado chame, es un pez anfídromo que se distribuye en el Pacífico centro oriental (Ruiz-González et al., 2020) y constituye un importante recurso acuícola, pesquero y cultural en Ecuador. Esta especie se produce a pequeña y mediana escala, tanto en estanques de agua dulce como salobre (Gonzalez-Martinez et al., 2020); sin embargo, los volúmenes de producción no son constantes debido al desconocimiento biológico de la especie. Recientemente, Vega-Villasante et al. (2021) señalan lagunas evidentes en el conocimiento de la especie, lo que ha ocasionado cuellos de botella en su manejo, conservación y reproducción.
D. latifrons tiene la capacidad de sobrevivir hasta 72 horas fuera del agua, característica que es aprovechada por los productores para su traslado, monitoreo, comercialización interna o exportación. No obstante, los estudios bajo condiciones de laboratorio deben garantizar el bienestar de los animales (Silva et al., 2013) por lo que es necesario establecer protocolos de anestesia para desarrollar investigaciones en esta especie. En este sentido, el objetivo del presente estudio fue evaluar el tiempo de inducción y tiempo de recuperación en D. latifrons mantenidos en agua dulce y salobre, expuestos a diferentes dosis con eugenol.
MATERIALES Y MÉTODOS
Un total de 240 individuos de chame fueron obtenidos en el humedal "La Segua" (0º 42' 34'' S y 80º 11' 56'' W), Ecuador. Los peces fueron transportados en cajas plásticas sin agua al laboratorio para su aclimatación. Se mantuvieron en cuarentena durante siete días en tanques circulares de 1000 L de capacidad, con fotoperiodo natural, temperatura de 23 °C, agua dulce (0 Unidades Prácticas de Salinidad - UPS) o salobre (20 UPS), pH 8.0 y 4 mg/L de oxígeno disuelto. Los peces fueron alimentados con balanceado comercial para camarón (22% de proteína y 4% de lípidos; Agripac S.A., Ecuador). Una vez pasada la cuarentena, los peces con peso 28.58 ± 10.52 g fueron distribuidos en 24 tanques (12 de agua dulce y 12 de agua salabre), cada tanque con 10 animales.
El eugenol (85% de pureza en base oleosa) fue utilizado en dosis de 42.5, 85, 170 y 255 mg/L. Posteriormente, los peces fueron transferidos individualmente a un acuario con 15 L de agua dulce (0 UPS) o agua salobre (20 UPS) con la dosis de eugenol de cada tratamiento. El acuario con la solución del anestésico se mantuvo con temperatura de 23 °C, pH 8.0 y 4 mg/L de oxígeno disuelto. En cada tratamiento se analizaron 30 peces. Se registró el tiempo de inducción calculado como el tiempo desde la exposición al fármaco hasta la pérdida de actividad muscular, así como el tiempo de recuperación calculado como el tiempo donde se observa recuperación de la posición erguida con natación normal. El tiempo de inducción y recuperación se tomó con un cronómetro digital Marathon adanac 3000.
Para la recuperación, los peces fueron colocados en un tanque de 200 L de agua dulce o salobre a temperatura de 23 °C y 4 mg/L de oxígeno disuelto. Después de la recuperación se pusieron en los tanques de 1000 L para observarlos por 7 días y calcular el porcentaje de supervivencia. Se calculó el radio entre el tiempo de recuperación y tiempo de inducción (Tr/Ti), donde valores mayores a 1 indican que el tiempo de recuperación es más largo que el tiempo de inducción.
Los procedimientos de bioética animal de este estudio contaron con el permiso del Comité de Bioética Institucional de la Universidad Técnica de Manabí, establecido en el Tomo 021-12, folio: 21-12-1.
La normalidad y homogeneidad de las variables tiempo de inducción, tiempo de recuperación y Tr/Ti se determinaron mediante los análisis de Shapiro-Wilk y de Levene's, respectivamente. Para determinar si el tiempo de inducción y el tiempo de recuperación mostraron diferencias en función a la salinidad y la dosis de eugenol se utilizó un análisis de varianza (ANOVA) factorial. En caso de encontrar diferencia se usó el post hoc de Duncan. Para determinar si las Tr/Ti variaron significativamente entre dosis de eugenol se utilizó un análisis de varianza de una vía. Los análisis se realizaron utilizando el software Statistica 7.0 (Stat Soft. Inc.) y el nivel mínimo de significancia se estableció en p<0.05.
RESULTADOS
El tiempo de inducción con eugenol no mostró diferencias significativas (F(1.232) = 3.34; p>0.05) entre salinidades (0 y 20 UPS), en tanto que el tiempo de recuperación mostró diferencias significativas (F(1.232) = 17.74; p<0.05) entre salinidades, siendo mayor en agua salobre (706 s) que en agua dulce (507 s). El tiempo de inducción fue menor con el incremento de la dosis, tanto en agua dulce como agua salobre (F(3.232)= 41.57; p0.05) (Cuadro 1); sin embargo, en la dosis más baja (42.5 mg/L) el tiempo de inducción en agua salobre fue significativamente menor que en agua dulce a la misma dosis (Figura 1A).
Cuadro 1. Efecto de la dosis de aceite de clavo (eugenol) y la salinidad del agua sobre la anestesia en el chame Dormitator latifrons
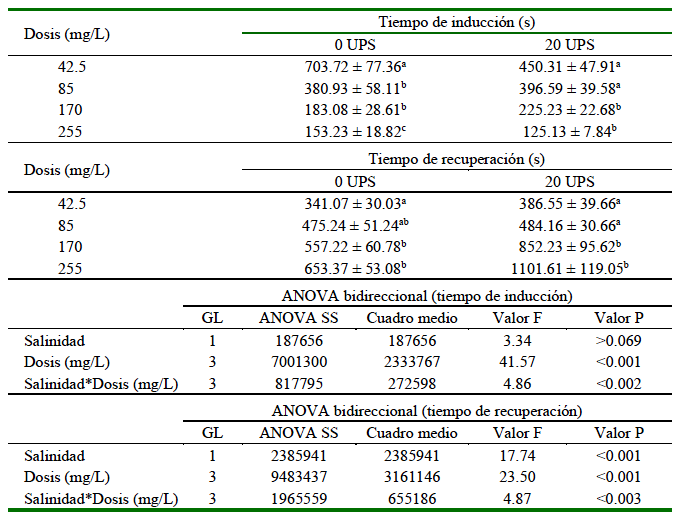
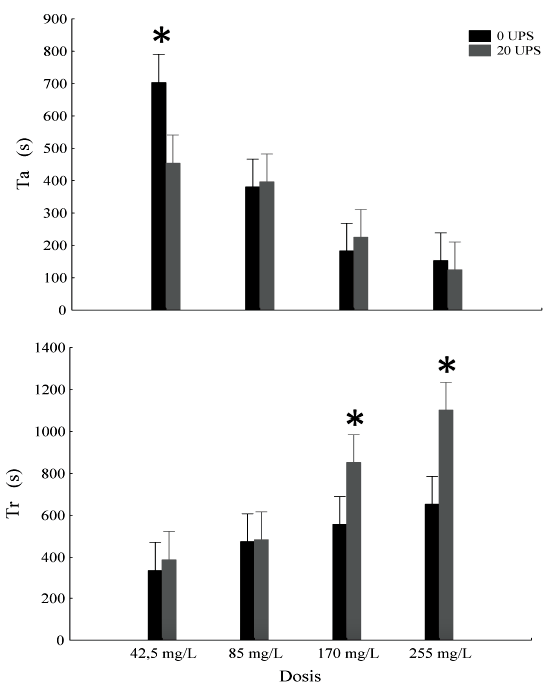
Figura 1. Tiempos de efecto de inducción (Ti) y tiempo de recuperación (Tr) en Dormitator latifrons anestesiados con cuatro dosis de eugenol en agua dulce y salobre. Promedios y desviación estándar. El asterisco indica diferencias significativas entre salinidades. s = segundos
El tiempo de recuperación incrementó significativamente con el incremento de la dosis, tanto en agua dulce como salobre (F(3.232)= 23.50; p<0.05; Cuadro 1), sin embargo, a dosis más altas (170 y 255 mg/L) el tiempo de recuperación fue significativamente mayor en agua salobre (Figura 1B). No se observó mortalidad durante los experimentos ni durante los siete días posteriores al experimento.
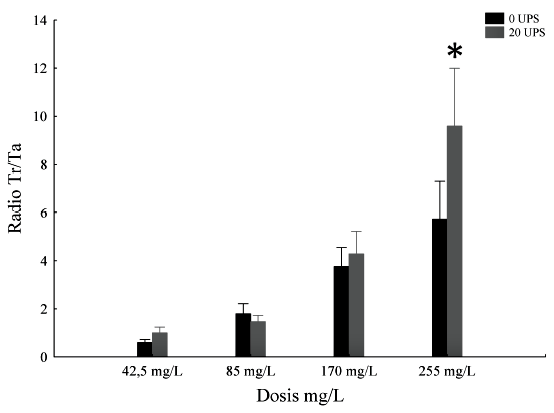
El radio Ti/Tr aumentó con el incremento de la dosis de eugenol tanto en agua dulce como salada (F(3,232) = 5.82; p<0.05). En todas las dosis el radio fue mayor a 1; sin embargo, a una dosis de 255 mg/L se observó una diferencia significativa entre agua dulce y salobre (p< 0.05) mostrando los valores más altos en agua salobre (Figura 2).
DISCUSIÓN
La anestesia se ha usado históricamente en acuicultura, experimentación y procedimientos veterinarios en organismos acuáticos (Sneddon, 2012); sin embargo, aun cuando D. latifrons es considerada una especie potencial para la acuicultura en algunos países del Pacífico centro oriental, hasta la fecha no existen estudios que evalúen el uso de anestésicos para su manipulación en acuicultura o en investigación.
Los resultados indican que D. latifrons puede ser anestesiado exitosamente con eugenol en dosis menores a 255 mg/L, tanto en agua dulce como salobre, sin ocasionar mortalidad. Este resultado concuerda con otros estudios que indican las bondades del eugenol como excelente anestésico para peces (Woody et al., 2002), incluyendo Oryzias latipes, Carassius auratus, Salmo salar, Oreochromis sp y Poecilia vivipara, entre otras (Soto y Burhanuddin, 1995; Woody et al., 2002; Iversen et al., 2003; Rucinque et al., 2016; Bolasina et al., 2017).
Los resultados indican que, tanto en agua dulce como salobre, el incremento de la dosis de eugenol disminuye el tiempo de inducción e incrementa el tiempo de recuperación. Es decir, a mayor concentración de eugenol, el organismo absorbe una mayor cantidad de anestésico, lo que podría ocasionar un tiempo más largo de remoción del producto en el organismo e incrementaría el tiempo de recuperación. Este patrón de concentración dependiente es bien conocido, tanto en peces marinos como la dorada sobaity Sparidentex hasta (Valenciennes, 1830) (Afkhami et al., 2014); el salmón Salmo salar (Linnaeus, 1758) (Iversen et al., 2003), rutilo - Rutilus frisii (Nordmann, 1840) (Javahery et al., 2012), bagre de dientes afilados - Clarias gariepinus (Burchell, 1822) (Öðretmen y Kaya, 2013), entre otros. De igual manera varios autores mencionan que este patrón se cumple para otros tipos de anestésicos como el 2-fenoxietanol, benzocaína, metomidato y MS-222 (Javahery et al., 2012; Afkhami et al., 2014).
En la dosis más baja (42.5 mg/L) se observó una disminución significativa en el tiempo de inducción en agua salobre respecto al agua dulce, sugiriendo un efecto sinérgico entre dosis de eugenol y la química del agua.
Las concentraciones más altas, al producir una inducción más rápida (Bowker et al., 2015), podrían estar menos influenciada por la química del agua, mientras que con dosis más bajas se tuvo un tiempo de inducción más largo. En este sentido, Barry et al. (2017) mencionan la posibilidad de que los aspectos del medio podrían influir en la solubilidad de los sedantes y causar una sedación más o menos potente dependiendo de las concentraciones del soluto. Por ejemplo, el agua dulce contiene mayor cantidad de carbonato de calcio que el agua salada y se conoce que el eugenol reacciona con el calcio formando quelato, reduciendo la acción del eugenol (Gonzáles-Escobar 2002).
Existe poca información sobre los mecanismos de acción del eugenol (Stoskopf y Posner, 2008) y la influencia de la salinidad en la eficacia de este producto como sedante para peces (Barry et al., 2017). En este estudio, el incremento de la salinidad produjo un aumento significativo del tiempo de recuperación en las dosis más altas (170 y 255 mg/L), lo que podría estar relacionado con la capacidad eurihalina de D. latifrons con preferencia de ambientes dulceacuícolas (Nordlie y Haney 1993).
En especies marinas o anádromas como la lubina (macho de lubina rayada Morone sexatilis x hembra de lubina blanca M. chrysops) sedadas con AQUI-S 20E, se han reportado tiempos de recuperación menores en salinidades de 15 a 25 g/L respecto a salinidades de 0 a 15 g/L (Barry et al., 2017). En el caso de especies eurihalinas, como D. latifrons, que tienen la capacidad de tolerar agua dulce y salada, los mecanismos de sedación son desconocidos; sin embargo, es posible que exista una relación entre el punto isoosmótico y la solubilidad del anestésico. Asimismo, se debe considerar que el chame es una especie sedentaria o poco ágil (Guadamud y Vera, 2009), y se ha descrito que una tasa metabólica mayor puede reducir el tiempo de recuperación al facilitar el metabolismo y excreción del anestésico (Javahery et al., 2012).
En todas las dosis el radio Ti/Tr fue mayor a 1, lo que significa que el tiempo de inducción fue más corto que el tiempo de recuperación. Se indica que un anestésico es eficaz cuando se tiene una sedación en un periodo menor o igual a 3 min y un tiempo de recuperación (nado normal) a los 15 min (Woody et al., 2002; Ghazilou et al., 2010). De acuerdo con esta definición, la dosis eficaz de eugenol para D. latifrons fue de 170 mg/L, siendo el tiempo de inducción de 3 min y tiempo de recuperación de 9 min en agua dulce, mientras que en agua a 20 UPS el tiempo de anestesiado fue ligeramente mayor a 3 min y un tiempo de recuperación de 14 min.
CONCLUSIONES
El eugenol mostró ser un anestésico eficaz y seguro que puede ser usado para estudios de laboratorio de D. latifrons.
La dosis eficaz de eugenol para D. latifrons fue de 170 mg/L; sin embargo, para procedimientos de corta duración se podría utilizar una inmersión en una dosis de 42.5 mg/L para lograr una sedación ligera o de rápida recuperación.
El incremento de la dosis de eugenol disminuyó el tiempo de inducción e incrementó el tiempo de recuperación, tanto en agua dulce como salada.












 uBio
uBio