INTRODUCCIÓN
Los incas, refiriéndose a la fibra de la vicuña (Vicugna vicugna), indicaban que la "Fibra de los Dioses" estaba reservada para el emperador. En la actualidad, la vicuña sigue produciendo la fibra animal más fina y muy cotizada a nivel internacional. Perú es el país que tiene la mayor población de vicuñas a nivel mundial, especie silvestre de la familia Camelidae, que produce un vellón con doble capa compuesto por cerdas (pelos largos y gruesos) y una abundante capa interna de fibras finas denominada fibras down (Sacchero y Mueller, 2005). Las comunidades campesinas comercializan el vellón ya sea como fibra sucia o semi procesada (fibra descerdada), especialmente con la empresa italiana Loro Piana (Loro Piana Marketing Communication et al., 2013). No obstante, a pesar de su gran valor textil y comercial, poco se ha investigado sobre la variación del color, estructura morfológica y composición química de la fibra de vicuña.
Las coordenadas del espacio CIE L*a*b* definen los parámetros colorimétricos como la luminosidad, intensidad y tonalidad de la fibra (Pinares et al., 2021; Cruz et al., 2021). El parámetro K/S es un indicador de la intensidad del color. La espectroscopía infrarroja por transformada de Fourier (FTIR) identifica bandas químicas relacionadas con enlaces químicos, incluidos los grupos de aminoácidos (McGregor et al., 2018). En la estructura del vellón y fibras individuales de vicuña están presentes los siguientes elementos químicos: carbono (50%), oxígeno (2225%), nitrógeno (16-17%), hidrógeno (7%) y azufre (4%), los cuales son los principales componentes de la proteína llamada queratina, que incluye 19 aminoácidos (Carpio y Santana, 1982; Hunter, 2020).
Las fibras primarias son las que sobresalen como una capa externa del vellón de la vicuña. Estas fibras son objetables o despreciables por ser fuertemente meduladas (conocidas como cerdas), mientras que en el down hay poca presencia de fibras meduladas. El porcentaje de medulación total incluye la suma de las fibras meduladas según el tipo de médula. Carpio y Solari (1982) reportaron un bajo porcentaje de fibra con médula continua (1.5%) y discontinua (3%) en la fibra de vicuña; sin embargo, con el OFDA 100 se reportó en promedio 7.87% de fibras meduladas en vicuñas de Apurímac (Pinares y Machaca, 2022). Basado en estos antecedentes, los objetivos de la investigación fue comparar las bandas químicas de la fibra de vicuña por espectroscopía infrarroja por transformada de Fourier (IFTR), determinar los parámetros colorimétricos por espectroscopía acoplada a una esfera de integración y determinar los porcentajes de medulación de la fibra usando un microscopio automatizado (Fiber Med) en vicuñas provenientes de las regiones de Puno y Apurímac, Perú.
MATERIALES Y MÉTODOS
Muestreo de Fibra
En diferentes chakus (captura de vicuñas) se tomaron muestras de fibras (5 g) del costillar medio de 19 vicuñas que tenían caspa y 23 vicuñas sin caspa provenientes de la Comunidad Campesina de Toma, Provincia de SanAntonio de Putina, Región Puno, Perú. Asimismo, en otro chaku se tomaron muestras de fibra (5 g) sin caspa de 20 vicuñas que provenían de la Comunidad Campesina de Pilluni y de 18 vicuñas capturadas en el Centro Ecológico Recreacional Taraccasa de la Municipalidad Provincial de Abancay, región Apurímac, Perú.
Colorimetría y Análisis del FTIR
Las impurezas de las fibras sin descerdar fueron limpiadas manualmente. Para el lavado de fibra se usó un detergente de la marca Bolívar a una concentración entre 0.2 y 0.4% con 0.5% de hidróxido de sodio (NaOH) a temperatura entre 50 y 55 °C. Las muestras fueron secadas a temperatura ambiente durante 48 horas. La cuantificación de color y la comparación de espectros infrarrojos se determinaron en el Laboratorio de Química de la Escuela Profesional de Ingeniería Agroindustrial de la Universidad Nacional Micaela Bastidas de Apurímac.
Los parámetros colorimétricos de la fibra se evaluaron usando un espectrómetro ULS2048CL-RS-EVO Avantes acoplado a una esfera integradora con luz halógena. El equipo se calibró en fondo negro y blanco (ángulo de observación de 10° e iluminantes D65). El espacio CIE L*a*b* fue graficado en un plano cartesiano tridimensional (ejes X, Y, Z) donde el eje vertical es la luminosidad (L*) entre 0 y 100, el eje horizontal a* tiene valores negativos para verde y valores positivos para rojo. El eje horizontal b* es perpendicular al eje a*, los valores negativos son para el azul y positivos para amarillo. El valor chroma, pureza de intensidad: C* = (a*2+b*2)0.5 y la tonalidad: H* = arctg (b*/ a*), llamado ángulo de matiz (Druml et al., 2018).
El parámetro K/S se determinó usando el mismo colorímetro con base a los espectros de reflectancia, la absorbancia se obtuvo a una longitud de onda aproximado de 496 nm, los valores de K/S se obtuvieron según la ecuación de Kubelka-Munk: K/S = (1-R)2/2R), donde K es el coeficiente de absorción, S es el coeficiente de dispersión y R es el valor de reflectancia de la superficie de la muestra (Džimbeg-malèiæ et al., 2011). En las fibras limpias lavadas se examinaron las bandas químicas usando un espectroscopio infrarrojo de transformada de Fourier (FTIR) a longitudes de onda entre 500 y 4000 cm-1 (Nicolet(tm) iS50 FTIR Spectrometer).
Análisis de la Medulación de la Fibra
Solo en 80 muestras de fibra se registró el porcentaje de medulación por tipo usando el nuevo equipo Fiber Med (Medulómetro), desarrollado por Natural Fiber´s Tech SAC (Quispe et al., 2022a) con inteligencia artificial para la identificación rápida de fibras sin médula (SM) y fibras meduladas: médula fragmentada (MF), médula discontinua (MD), médula continua (MC) y fuertemente medulada (FM). La sumatoria de estas fibras meduladas se reporta como el porcentaje de medulación total (MT).
Análisis Estadístico
Los datos de colorimetría y del porcentaje de medulación fueron testeadas mediante el análisis de varianza con un factor (One Way). Además, se usó la prueba de Tukey (α=0.05) para la comparación múltiple de medias usando el software estadístico R v. 3.6.3 (R Core Team, 2021).
RESULTADOS Y DISCUSIÓN
Espectroscopía infrarrojo por transformada de Fourier (FTIR)
Las bandas de intensidad de los espectros FTIR en fibra de vicuñas que provenían de dos lugares geográficos (Puno y Apurímac) se superponen, lo que indica similitud de características químicas y de la estructura de la fibra (Figura 1). Las vibraciones de los enlaces peptídicos originan las bandas conocidas como Amida A, Amida I, Amina II y Amina III (McGregor et al., 2018). La región de transmisión abarca desde 3500 hasta 3200 cm-1 donde se ha originado el estiramiento de los enlaces N-H y O-H. La banda de la Amida A, que presenta un pico en 3271 cm-1, está relacionada con la vibración de estiramiento de los enlaces N-H. Las bandas de transmisión en el rango de 3000 -2800 cm-1 están relacionadas con los modos de estiramiento del C-H y C=H. La banda de la Amida I está relacionada principalmente con la vibración de estiramiento de C=O, y se produce en el rango de 1700-1600 cm-1.
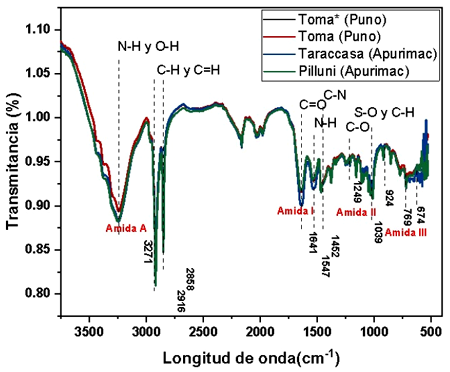
Figura 1. Intensidad de espectro infrarrojo por transformada de Fourier (FTIR) en forma de bandas en fibra de vicuñas provenientes de Puno y Apurímac. Toma*: fibra con caspa. Toma: fibra sin caspa
La banda de transmisión de la amida II se forma entre 1580 y 1480 cm-1, y está relacionada con la vibración de flexión del N-H y de estiramiento del C-H. La banda de la Amida III se produce en el rango de 1300 1220 cm-1 como resultado de la combinación en fase de estiramiento de C-N y flexión de N-H en el plano. Estos espectros obtenidos son concordantes al reporte de McGregor et al. (2018) en cachemira, lana y otras fibras animales como la vicuña. Los espectros FTIR enlafibradevicuñasdePuno yApurímacse superponen, sin mostrar diferencias estadísticas entre sí. McGregor et al. (2018) observaron diferencias significativas entre cachemira y lana, cachemira de diferentes orígenes, cachemira blanca y de color, asimismo entre cachemira y pelo.
Parámetros colorimétricos
Los parámetros de luminosidad (L*), valores de a*, tonalidad (H*) y el parámetro K/S fueron diferentes según el lugar de procedencia de la vicuña (p<0.05); pero la intensidad de color o valor chroma (C*) no muestra diferencia significativa (Cuadro 1). La mayor luminosidad (46.79 ± 04.64) se observa en la fibra sin caspa de la Comunidad Toma (Puno) respecto a las vicuñas de Taraccasa y Pilluni (Apurímac). Sin embargo, Pinares et al. (2021), al cuantificar con un colorímetro Chroma Meter CR-210 (Konica Minolta) reportaron una luminosidad de 47.74 ± 03.65 en las mismas vicuñas de Taraccasa, Apurímac.
Por otro lado, el parámetro de intensidad de color obtenido en el presente estudio (Cuadro 1) resulta similar al valor de 24.33 ± 01.39 reportado por Pinares et al. (2021) en vicuñas de Taraccasa. La tonalidad de fibra más alta (1.18 ± 0.04) se observa en vicuñas de la Comunidad de Toma (Puno) y el más bajo (1.12 ± 0.04) en vicuñas de Taraccasa (Apurímac). El parámetro K/S es el más bajo (09.79 ± 03.18) en fibras de vicuñas sin caspa de Toma (Puno) respecto a las vicuñas de Apurímac. Este parámetro es directamente proporcional a la concentración de pigmento en la fibra, siendo un indicador de la profundidad de color en un tejido natural o teñido (Ramaiah y Ari, 2019). Estas diferencias pueden ser influenciadas por la altitud y las intensidades de radiaciones ultravioleta (UV). Se sabe que la radiación UV es un modulador significativo de la pigmentación en fibras de animales (Wakamatsu et al., 2021; Yardman-Frank y Fisher, 2021).
Porcentaje de fibras meduladas
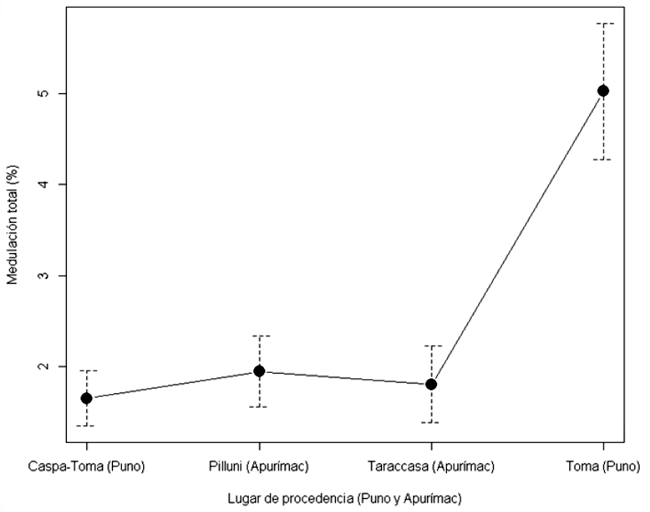
El porcentaje de medulación total o porcentaje de fibras meduladas en vicuña sin caspa es diferente entre Puno y Apurímac, siendo mayor la medulación en vicuñas de Puno (Cuadro 2). Además, hay diferencias en el porcentaje de fibras con médula fragmentada y fuertemente medulada, siendo mayor en vicuñas de Puno. En vicuñas de la Comunidad de Toma (Puno) se observa alto porcentaje de medulación total (5.02%), en cambio las vicuñas de la Comunidad de Pilluni (1.65%) y de Taraccasa (1.80%) muestran un menor porcentaje de medulación (Figura 2).
El porcentaje de fibras fuertemente meduladas (2.16%) en vicuñas de la Comunidad de Toma es similar al 2% reportado por Carpio y Solari (1981). En cambio, el porcentaje de medulación total en vicuñas de Apurímac (1.94) es inferior al 7.75% reportado por Pinares y Machaca (2022) en la comunidad de Taccata, distrito de Lambrama. En este sentido, en la subespecie Vicugna vicugna vicugna de Argentina, Rebuffi (1999) reportó 8% de medulación total.
Cuadro 1. Parámetros colorimétricos en fibra de vicuña según el lugar de procedencia
| n | L* | a* | b* | C* | H* | Parámetro K/S | |
|---|---|---|---|---|---|---|---|
| Toma* (Puno) | 19 | 43.39b | 9.76b | 21.85a | 23.94a | 1.15b | 12.55a |
| ±03.51 | ±01.41 | ±02.10 | ±02.35 | ±0.04 | ±02.64 | ||
| Toma (Puno) | 23 | 46.79a | 8.89a | 21.55a | 23.32a | 1.18a | 09.79b |
| ±04.64 | ±01.07 | ±01.49 | ±01.60 | ±0.04 | ±03.18 | ||
| Taraccasa (Apurímac) | 18 | 42.22b | 9.94b | 21.02a | 23.27a | 1.12c | 13.73a |
| ±05.63 | ±01.34 | ±02.27 | ±02.43 | ±0.04 | ±04.56 | ||
| Pilluni (Apurímac) | 20 | 42.35b | 9.53b | 21.16a | 23.22a | 1.14b | 13.29a |
| ±03.98 | ±01.49 | ±02.53 | ±02.79 | ±0.04 | ±02.39 |
Toma*: fibra con caspa; n: número de vicuñas muestreadas
Cuadro 2. Porcentaje de fibras meduladas y no meduladas en vicuñas de Puno y Apurímac
| n | MF (%) | MD (%) | MC (%) | FM (%) | MT (%) | DE* | NM (%) | DMF μm | DE μm | |
|---|---|---|---|---|---|---|---|---|---|---|
| Toma (Puno) | 23 | 1.56b | 0.49a | 0.81a | 2.16b | 5.02b | 3.60 | 94.98b | 14.86a | 1.01 |
| Toma* (Puno) | 19 | 0.62a | 0.30a | 0.45a | 0.28a | 1.65a | 1.32 | 98.34a | 13.86b | 0.54 |
| Taraccasa (Apurímac) | 18 | 0.57a | 0.20a | 0.38a | 0.65a | 1.80a | 1.79 | 98.09a | 13.67b | 0.63 |
| Pilluni (Apurímac) | 20 | 0.70a | 0.41a | 0.49a | 0.34a | 1.94a | 1.73 | 98.05a | 13.99b | 0.43 |
Toma: vicuñas con caspa (19) y sin caspa (23). Las vicuñas de Taraccasa y Pilluni no tenían caspa. MF: médula fragmentada; MD: médula discontinua; MC: médula continua; FM: fuertemente medulada; MT: medulación total o fibras meduladas (sumatoria de fibras con médula); DE*: desviación estándar para MT; DMF: diámetro medio de fibra; DE: desviación estándar de DMF
Por otro lado, se ha reportado que la presencia de fibras con médula continua (MC) y fibras fuertemente meduladas (FM) influyen sobre la variabilidad del diámetro medio de fibra en alpacas (Pinares et al., 2019; Berolatti et al., 2021; Radzik-Rant y Wierciñska, 2021; Quispe et al., 2022b) y en mohair (McGregor et al., 2013; Hunter y Botha, 2022), donde a mayor grosor de la fibra hay mayor presencia de fibras con MC y FM.
El diámetro medio de fibra en vicuñas de Toma (Puno) fue más gruesa respecto al de Pilluni y Taraccasa (Apurímac). En esta línea, Pinares y Machaca (2022) reportaron 13.36 ± 1.01 µm en vicuñas de Taraccasa y 13.88 ± 1.41 µm en vicuñas de Iscahuaca (Apurímac).
CONCLUSIONES
No se evidencian diferencias significativas en la intensidad de los espectros infrarrojos de transformada de Fourier (FTIR) en fibra de vicuñas provenientes de Puno y Apurímac debido a la superposición de las bandas.
Existe variabilidad en los parámetros colorimétricos (luminosidad y tonalidad) y el parámetro K/S en la fibra de vicuñas provenientes de Puno y Apurímac.
Existe una variación significativa en los porcentajes de fibras meduladas de vicuña (medulación fragmentada, fuertemente medulada y medulación total).












 uBio
uBio